Стрессовое недержание мочи у женщин – мультифакториальное, часто генетически обусловленное заболевание, широко распространенное в европейской популяции. Несмотря на высокую распространенность, этиопатогенез его изучен недостаточно. Значительную роль в генезе стрессового недержания мочи играют нарушения в метаболизме внеклеточного матрикса, что
позволяет считать стрессовое недержание мочи частным проявлением недифференцированной
дисплазии соединительной ткани [1]. На сегодняшний день не создана единая гипотеза, объясняющая принципиальные механизмы развития данной патологии, что обусловливает необходимость изучения молекулярно-генетических основ заболевания.
Особый интерес представляет анализ различно экспрессируемых генов у женщин со стрессовым недержанием мочи. В связи с этическими сложностями получения биологического материала от контрольной группы, а также уже имеющимися данными об экспрессии генов при стрессовом недержании мочи в базе GEO DataSets, мы решили использовать эти данные для последующего
компьютерного анализа.
Благодаря стремительному развитию геномных и постгеномных технологий стало возможным, пользуясь источниками литературы и базами данных, выделить известные ассоциированные с дисплазией соединительной ткани гены, на основании компьютерных исследований составить карты и сети, содержащие гены-кандидаты, и выделить подпроцессы, которые могут являться критическими в развитии данной патологии.
Цель исследования: выявление с помощью карт сетевых взаимодействий генов ключевых процессов, ассоциированных со стрессовым недержанием мочи как частным проявлением дисплазии соединительной ткани и генов-кандидатов данной патологии.
Материал и методы исследования
Для выполнения поставленной цели нами использована база данных GEO DataSets (http://www.ncbi.nlm.nih.gov/geo/), в которой собраны в виде электронных таблиц результаты исследований по оценке уровня экспрессии генов на биочипах: данные микрочипа записи GSE12852 для пролапса тазовых органов и стрессового недержания мочи. В исследование включены 17 пациенток (8 – больные с пролапсом гениталий и стрессовым недержанием мочи, составили основную группу, 9 – группа контроля)[6]. Отбор пациенток проводился по строгому протоколу с учетом возраста, этнической принадлежности, индекса массы тела, приема как локальной, так и системной заместительной гормональной терапии. После получения информированного согласия сравнивались образцы круглых и крестцово-маточных связок женщин основной и контрольной групп, иссеченные при гистерэктомии массой 1 г на образец. Обработка материала проводилась с помощью программного продукта MetaCore компании GenеGo Inc (США). Расклад процессов по приоритетам производится программой Metacore, исходя из того, что чем меньше значение p-value, тем больше вероятность того, что гены, попавшие в конкретный процесс, включены туда неслучайно. Изначально
порог для p-value мы выставляли равным 0,05.
Для всех генов был установлен порог изменения уровней экспрессии равный 1,5, то есть программа
работает только с теми генами, уровень экспрессии которых изменен (увеличен или уменьшен)
более чем в 1,5 раза. Установлено, с какими молекулярно-генетическими процессами ассоциированы данные гены-кандидаты. Использованы карты сетевых взаимодействий генов, с наложением изменений в уровнях экспрессии. Карта сетевых взаимодействий генов представляет собой модель различных процессов взаимодействия генов, белков, метаболитов, имеющих отношение к конкретным молекулярно-генетическим изменениям [4].
Результаты исследования и обсуждение
Для дальнейшей работы из 388 карт сетевых взаимодействий генов отобрана наиболее характерная и статистически значимая для ремоделирования соединительной ткани (рис. 1, см. на вклейке).
На рис. 2 (см. на вклейке) приведены условные обозначения, используемые на картах сетевых
взаимодействий генов.
Ремоделирование внеклеточного матрикса (ВКМ) задействовано как в нормальных (эмбриональное развитие, репродукция, пролиферация, миграция и адгезия клеток, заживление ран, ангиогенез), так и в патологических процессах, таких как дисплазия соединительной ткани, артриты и метастазирование. Рассмотрены компоненты выбранной карты сетевых взаимодействий генов
и их взаимосвязь.
Матриксные металлопротеиназы (ММП) в зависимости от их строения и определенного субстрата
воздействия можно разделить на 6 групп: коллагеназы (ММП-1 и ММП-13), желатиназы: желатиназа-А (ММП-2) и желатиназа-В (ММП-9), стромелизины: стромелизин-1 (ММП-3) и стромелизин-2 (ММП-10)), матрилизины: матрилизин-1 (ММП-7)), мембранно-связанные ММП, (тип-I трансмембранные протеины ММП-14, ММП-15 и ММП-16), другие ММП (ММП-12).
Тканевые ингибиторы ММП (ТИМП), такие как ТИМП-1, ТИМП-2 и ТИМП-3, уменьшают интенсивность деградации соединительной ткани. Баланс между активированными MMП и ТИМП определяет объем ремоделируемого ВКМ. ММП экспрессируются как проферменты, после чего подвергаются воздействию других ММП или иных классов протеолитических ферментов [10]. Стромелизин-1 активирует большое количество про-ММП, включая ММП-1, ММП-13 и ММП-7, превращая их в полноценные протеиназы. Также стромелизин-1 участвует в деградации протеинов ВКМ: кислого белка, богатого цистеином
остеонектина, и компонентов базальных мембран, таких как ламинин-1 [16]. Стромелизин-2 участвует в деградации белков ВКМ: коллагена I, коллагена III и нидогена [14]. Более того, он активирует другие ММП (ММП-1). ММП-2 активируется мембранными ММП (ММП-14, ММП-15 и ММП-16) на поверхности клетки.
Протеогликан гепарансульфат (CD44) вместе с протеолитически активным матрилизином (ММП-7) и предшественником гепарин-связывающего EGF-подобного фактора роста (HB-EGF) формируют комплекс на поверхности клетки. Матрилизин (ММП-7) фрагментирует мембранно-связанный HB-EGF-предшественник, высвобождая активный HB-EGF. Последний активирует свои рецепторы, рецептор эпидермального фактора роста (EGFR), приводя к клеточной пролиферации, обновлению и ремоделированию ткани [12]. Гепарансульфат-протеогликаны на поверхности клеток CD 44 и синдекан-2 связываются с хондроитинсульфатом-протеогликаном версиканом и ламинином альфа-4 (LAMA4) соответственно. CD 44 и синдекан-2 вовлечены в формирование непосредственной связи между ВКМ и корковой цитоплазмой посредством взаимодействия с белками, связанными с актиновым
цитоскелетом EZRIN и MOESIN [20].
Действие ММП не ограничивается деградацией ВКМ; эти протеазы модифицируют многие нематриксные субстраты (цитокины и хемокины). Например, ММП-9 потенцирует активность интерлейкина (IL)-8 посредством аминотерминального процессинга. Сигнальная система IL-8
рецептора альфа (IL-8RA) приводит к активации нейтрофилов и хемотаксису [18].
PLAU (урокиназный активатор плазминогена) играет основную роль в регуляции клеточной адгезии и миграции в процессе ремоделирования ткани. PLAU присоединяется к своему рецептору PLAUR и является медиатором различных реакций, вовлеченных в сосудистый гомеостаз, воспаление и регенерацию ткани. PLAU и тканевой активатор плазминогена (PLAT) являются важными компонентами внеклеточной системы протеаз, которые специфически превращают профермент плазминоген в плазмин, главный фибринолитический фермент. Плазмин непосредственно расщепляет белки ВКМ, такие как фибронектин, а также активирует большое количество ММП, включая ММП-1 и ММП-13, которые участвуют в деградации белков ВКМ и компонентов базальных мембран (коллаген I, коллаген II, коллаген III и витронектин) [13].
Протеолитическая активность плазмина регулируется ингибиторами активаторов плазминогена (ингибитор серпиновой пептидазы (PAI-1) и SERPINE 2), которые ковалентно соединяются с PLAU и PLAT и ингибируют их каталитическую активность [7]. Как видно из карты сетевых взаимодействий генов, в нашем эксперименте наиболее измененной является экспрессия гена PAI-1(SERPINE1) – увеличена в 4,67 раз.
Ген PAI-1 находится на длинном плече седьмой хромосомы (7q21.3-q22). Главный полиморфизм гена был выявлен в промоторной области и известен как полиморфизм 4G/5G. Аллель 5G сопровождается меньшей активностью, чем аллель 4G. Поэтому у носителей аллеля 4G концентрация PAI-1 выше, чем у носителей аллеля 5G. что приводит к повышению риска тромбообразования, а во время беременности — к повышению риска нарушения функции плаценты и невынашивания беременности [9]. Также генотип 4G/4G достоверно связан с диссеменированным внутрисосудистым свертыванием крови у детей с системной менингококциемией [5]. Особое место среди тромбофилических состояний занимают послеоперационные тромбозы глубоких вен, при которых часто отмечается повышение уровня PAI-1 как белка острой фазы [17]. Обнаружено, что в промоторной области гена PAI-1 есть участок, который может содержать последовательность либо из 4 оснований гуанина (4G), либо из 5 оснований гуанина (5G). Это является классическим примером полиморфизма по типу инсерция/делеция (INS/DEL). В популяции возможны 3 варианта генотипа: 5G/5G, 5G/4G, 4G/4G. Оказалось, что в крови людей, имеющих вариант 4G/4G, концентрация PAI-1 значительно выше, чем у людей, имеющих варианты 5G/5G и 5G/4G [8].
Поскольку многие осложнения беременности сопровождаются тромбозом спиральных артерий,
оказалось, что риск гестоза у женщин, являющихся носительницами варианта 5G/4G примерно в
2 раза выше, чем у женщин-носительниц варианта 5G/5G, а у женщин-носительниц варианта 4G/4G риск гестоза был в 2 раза выше, чем при варианте 5G/4G [19]. Поэтому исследование полиморфизма 5G/4G стало обязательной составной частью обследования при наличии в анамнезе осложнений течения беременности (остановки развития на малых сроках, тяжелые гестозы, внутриутробная смерть плода, гипотрофия и задержка внутриутробного развития, хроническая внутриутробная гипоксия плода, преждевременное созревание плаценты). Оказалось также, что у мужчин, в семьях которых были случаи рака предстательной железы, генотип 4G/4G (но не генотип 5G/5G) сопровождался значительным повышением риска рака простаты [11].
Вариант 5G сопровождается повышенной активностью активаторов плазминогена, а следовательно более высокой скоростью превращения плазминогена в плазмин, что способствует более высокой активации тканевых металлопротеиназ, растворяющих соединительную ткань. Поэтому носители варианта 5G имеют, в частности, повышенный риск развития аневризмы аорты по сравнению с носителями генотипа 4G [15].
Уровень и соотношение экспрессии компонентов системы активации плазминогена в опухолевой ткани может служить показателем инвазивной и метастатической активности опухоли, являясь вследствие этого биологически значимым фактором прогноза, показателем риска малигнизации. В многочисленных репрезентативных исследованиях продемонстрирована высокая прогностическая значимость PAI-1 при раке молочной железы: риск прогрессирования, даже при ранних стадиях заболевания, возрастает в 1,5–3 раза, если уровень данного белка превышает определенные пороговые значения. В связи с этим, определение PAI-1 может быть рекомендовано для больных ранними стадиями рака молочной железы с целью выявления повышенного риска рецидива заболевания, назначения в этих случаях более интенсивного лечения [2].
Высокий уровень PAI-1 ассоциируется с ожирением, нарушением толерантности к глюкозе, гиперлипедемией, гиперинсулинемией — признаками метаболического синдрома. Некоторые исследователи считают, что к компонентам метаболического синдрома относится предрасположенность к тромбозам и повышенный уровень PAI-1, поскольку гиперинсулинемия, способствуя отложению жира, обусловливает усиление синтеза в жировой ткани PAI-1, тем самым, снижая фибринолиз и способствуя клеточной агрегации [3].
Учитывая достоверную связь PAI-1 с металопротеиназами (рис. 3), мы высказываем предположение о его важной роли в патогенезе дисплазии соединительной ткани и, в частности, при стрессовом недержании мочи.
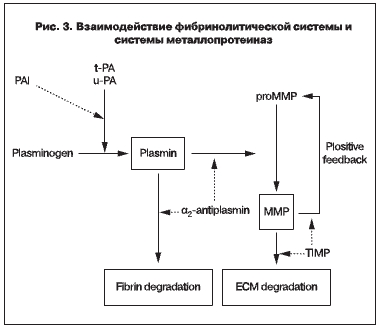
Известно, что плазмин непосредственно активирует про-ММП-1,-3,-9,-10,-13. Активация про-ММП-9 может осуществляться как под влиянием плазмина, так и независимо от него. Некоторые активные ММП способны, в свою очередь, посредством положительной обратной связи активировать другие про-ММП [13]. PAI-1 препятствует превращению плазминогена в плазмин и, следовательно, противодействует данному пути активации ММП, таким образом замедляя деградацию соединительной ткани. Мы полагаем, что посредством взаимодействия множества генов, сигнальных систем организма экспрессия PAI-1 у женщин с проявлениями дисплазии соединительной ткани увеличивается в 4,67 раз компенсаторно, препятствуя дальнейшей деградации соединительной ткани.
Возможно исследование полиморфизма PAI-1 поможет утвердить его в качестве гена-кандидата и позволит своевременно прогнозировать развитие данного заболевания у молодых женщин с наличием других факторов риска развития стрессового недержания мочи.



