Работа выполнена при финансировании Министерством образования и науки Российской Федерации в рамках федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» на 2009 – 2013 гг. (соглашение № 8068).
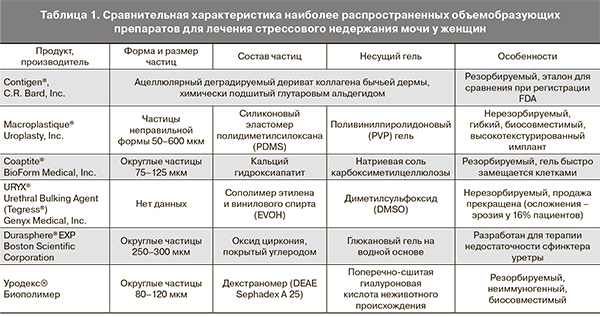
Недержание мочи у женщин является одной из самых частых и до конца не решенных проблем современной урогинекологии. Данное заболевание значительно ухудшает качество жизни пациентов, зачастую приводя к социальной дезадаптации. По данным эпидемиологических исследований распространенность недержания мочи у женщин значительна: проблемы с удержанием мочи испытывают до 25% молодых женщин, от 44 до 57% женщин в постменопаузе и до 75% женщин старшего возрастной группы [1]. Поиск новых методов лечения стрессового недержания мочи (наиболее распространенной формы) не прекращается: на сегодняшний день зарегистрировано 189 клинических исследований в этой области [2]. Наряду с консервативным подходом применяется также хирургическое лечение – слинговые операции («поддерживание» уретры с помощью петли из синтетических материалов). Вторым по распространенности хирургическим методом лечения стрессового недержания мочи является введение объемобразующих препаратов (табл. 1), который в силу своей малой инвазивности обладает рядом преимуществ: меньший риск инфицирования и формирования рубцов, лучшая переносимость пациенткой, более доступная цена. В то же время вышеописанные хирургические методы лечения недержания мочи не всегда эффективны и могут требовать проведения повторных вмешательств [3, 4].
Новейшим направлением в лечении стрессового недержания мочи можно считать применение клеточных технологий. В экспериментальных исследованиях продемонстрирована высокая эффективность трансплантации клеток в периуретральную область на модели стрессового недержания мочи лабораторных животных [5, 6]. Зарегистрировано 8 подобных клинических исследований, касающихся изучения безопасности и эффективности введения скелетных миобластов или мультипотентных стромальных клеток (МСК) [2]. Предварительные результаты этих исследований свидетельствуют о безопасности и эффективности данных подходов [7, 8].
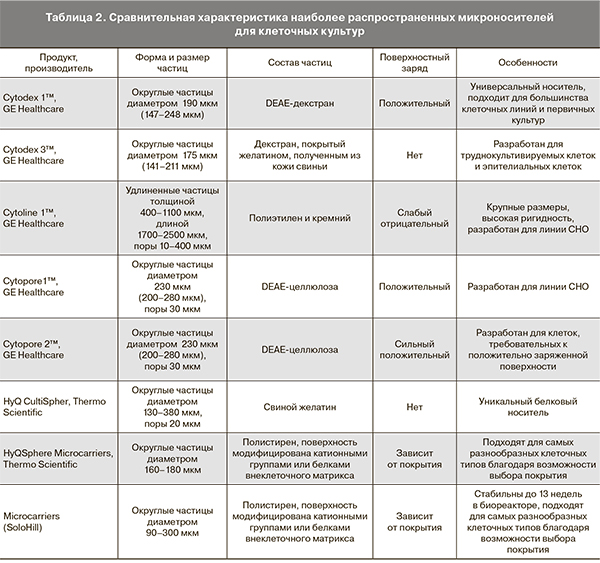
Следующим этапом развития этих технологий, несомненно, должно стать введение не суспензионных клеточных культур, а тканеинженерных конструкций, которые могут обеспечить более высокую выживаемость клеточного компонента и его иммобилизацию в области введения [9]. Оптимальной с этой точки зрения представляется комбинация объемобразующего препарата и стромальных клеток. Выбор носителя может быть обусловлен его максимальным приближением к микроносителям, которые широко применяют для масштабирования клеточных культур. Сравнительная характеристика наиболее часто применяемых клеточными технологами микроносителей приведена в табл. 2.
Как видно из табл. 1 и 2, наибольшим сходством обладают объемобразующий препарат уродекс (Биополимер, Германия) и универсальный микроноситель Cytodex 1™. Обращает на себя внимание меньший диаметр декстрановых гранул в уродексе (80–120 мкм) и наличие в нем гиалуроновой кислоты в качестве несущего геля. Однако в литературе представлены данные о возможности выживания стромальных клеток на поверхности декстрановых гранул диаметром 80 мкм в присутствии гиалуроновой кислоты по меньшей мере в течение 12 часов [10]. Возникает также вопрос о влиянии диэтиламиноэтил-декстраномера (DEAE-декстраномера) в качестве подложки на свойства клеточного компонента конструкции. В недавно опубликованной работе было продемонстрировано, что культивирование на микроносителе из DEAE-декстраномера не влияет на профиль экспрессии поверхностных антигенов, клоногенную активность и время удвоения популяции даже у таких чувствительных культур, как МСК фетального костного мозга [11].
Таким образом, состав объемобразующего препарата уродекс (положительно заряженные за счет DEAE-групп декстрановые гранулы, нетоксичная гиалуроновая кислота в качестве геля-носителя), удобная форма выпуска и медицинское назначение делают его оптимальным для создания инъекционной формы тканеинженерной конструкции и ее последующего применения в области урогинекологии. В то же время данные о подобных исследованиях в современной литературе отсутствуют. В настоящей работе представлены результаты нашего исследования о возможности использования уродекса в качестве микроносителя для тканевой инженерии.
Материалы и методы исследования
МСК выделяли из жировой ткани (липоаспирата) (n=5) или вартонова студня (n=5) человека путем ферментативной обработки с помощью коллагеназы I и II типов (200 Ед/мл). Клетки культивировали в ростовой среде DMEM/F12 (ПанЭко, Россия) с добавлением эмбриональной телячьей сыворотки до 10% (PAA Laboratories, США). Принадлежность выделенных клеток к МСК подтверждали в соответствии с требованиями ISCT [12]. Для дифференцировки в адипогенном, остеогенном и хондрогенном направлениях использовали готовые дифференцировочные среды StemPro® Adipogenesis Differentiation Kit (в течение 7–10 сут), StemPro® Osteogenesis Differentiation Kit (в течение 21 сут), StemPro® Chondrogenesis Differentiation Kit (в течение 28 сут) (Gibco, США). Дифференцировку клеток верифицировали с помощью общепринятых гистохимических методов с использованием Судана III (адипогенез), ализаринового красного S (остеогенез) или альцианового синего (хондрогенез). Для иммунофенотипирования использовали набор антител Human MSC Analysis Kit, содержащий антитела к положительным маркерам СD73, СD90, СD105 и отрицательным маркерам СD11b, СD19, СD34, СD45 и HLA-DR (BD Biosciences, США). Анализ проб проводили на проточном цитофлуориметре FC 500 (Beckman Coulter, США) с программным обеспечением CXP 2.2.
Для оценки стабильности препарат уродекс смешивали с культуральной средой в пропорции 1:1 или 1:10 и инкубировали в течение 7 суток при 37°С. Дополнительно оценивали стабильность препарата в культуральной среде в течение длительного времени (6 месяцев) при 4°С. Целостность компонентов препарата Уродекс исследовали с помощью световой микроскопии (Axiovert 40 CFL, Zeiss, Германия).
Цитотоксичность препарата уродекс оценивали с помощью МТТ-теста. Для тестирования использовали МСК третьего пассажа. Клетки рассаживали в 96-луночные планшеты (NUNC, Дания) из расчета 5 тысяч клеток на лунку. После прикрепления клеток в каждую лунку вносили образец уродекса и инкубировали в течение 2 или 7 суток в стандартных культуральных условиях. После инкубации образцы удаляли, в каждую лунку добавляли 20 мкл стокового раствора МТТ (ПанЭко, Россия) (50 мг/мкл) и инкубировали в течение 2 часов при 37°С, контролируя развитие окраски. Реакцию останавливали, удаляя среду с МТТ. Для элюирования формазана добавляли ДМСО (ПанЭко, Россия) и помещали планшет на шейкер (режим 200 об/мин, 20 мин). Оптическую плотность элюата измеряли при длине волны 540 нм, фоновое значение – при 620 нм. В качестве контроля использовали лунки с клетками без внесения уродекса. Измерение проводили на планшетном спектрофотометре Fluoroscan Ascent (Labsystems Oy, Финляндия).
Соединение клеточного компонента и микроносителя
МСК жировой ткани или пупочного канатика открепляли от подложки стандартным методом с помощью раствора трипсина-ЭДТА (ПанЭко, Россия) и осаждали центрифугированием (1100 об/мин, 10 мин). Осадок ресуспендировали в ростовой среде в концентрации 5 млн клеток в 1 мл и смешивали с равным объемом препарата уродекс. Полученную суспензию переносили в стандартную культуральную посуду из полистирола или в посуду с низкими адгезивными свойствами из полипропилена (NUNC, Дания). Для оценки количества адгезированных на поверхности носителя клеток их ядра докрашивали 0,05 мкг/мл DAPI (Sigma-Aldrich, США). Наблюдение осуществляли с помощью инвертированного микроскопа Axiovert 40 CFL (Zeiss, Германия) и программного обеспечения AxioVision Rel.4.8.
Оценка выживаемости клеток в условиях, имитирующих трансплантацию
Суспензию уродекса с адгезированными клетками отмывали от культуральной среды, переносили в охлажденный до 4°С физиологический раствор (ПанЭко, Россия) и пропускали через иглу 20G (внутренний диаметр иглы 603 мкм). Для выявления живых и погибших клеток суспензию окрашивали 0,4% трипановым синим (ПанЭко, Россия) в течение 1 мин.
Результаты исследования
Выделенные из липоаспирата или пупочного канатика человека клеточные культуры имели характерный для МСК фенотип. На 3-м пассаже более 96% клеток экспрессировали положительные для МСК маркеры CD90, CD73 и CD105, менее 2% – негативные маркеры CD11b, CD19, CD34, CD45 и HLA-DR. Клеточные культуры ответили на действие индукторов дифференцировки: липидные включения в цитоплазме в процессе адипогенеза появлялись на 5–7-е сутки индукции, отложения мукополисахаридов при хондрогенезе или кальцификатов при остеогенезе фиксировали к концу 3-й недели индукции.
Оценка стабильности препарата уродекс в культуральной среде
При смешивании препарата уродекс с культуральной средой наблюдали окрашивание декстрановых гранул, но не гиалуронового носителя красителем Phenol Red, входящим в состав среды и являющимся индикатором уровня рН (рис. 1а, 1б см на вклейке). Помимо окрашивания никаких видимых изменений в течение 7 суток инкубирования при 37°С не обнаруживали. При длительной (6 месяцев) инкубации уродекса в культуральной среде при 4°С выявляли отдельные очаги резорбции гиалуронового носителя, пластины которого распадались на небольшие фрагменты (рис. 1в см на вклейке). При этом сами декстрановые гранулы не изменялись, сохраняя форму и характерный рисунок поверхности (рис. 1г см на вклейке).
Оценка цитотоксичности препарата уродекс
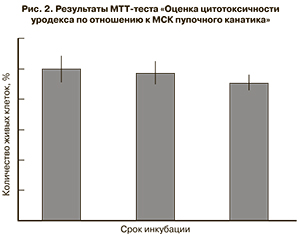
Проведенный МТТ-тест показал отсутствие цитотоксичности препарата уродекс по отношению к МСК пупочного канатика и МСК жировой ткани человека. Даже через 7 суток количество живых клеток по сравнению с контролем снижалось незначительно (рис. 2).
Соединение клеточного компонента и микроносителя
При смешивании суспензии клеток и препарата уродекс наблюдали адгезию клеток к поверхности декстрановых гранул и пластинам гиалуроновой кислоты (рис. 3а, 3б см на вклейке).
Перенос соединенных компонентов в стандартную культуральную посуду из полистирола приводил к тому, что клетки прикреплялись к плоской подложке, увлекая за собой декстрановые гранулы (рис. 4а см на вклейке). Дальнейшее культивирование приводило к образованию скоплений, состоящих из нескольких клеточных слоев и декстрановых гранул, при этом фрагменты гиалуроновой кислоты, вероятно, были резорбированы (рис. 4б см на вклейке). Такое взаимное притяжение обусловлено наличием на поверхности декстрановых гранул положительно заряженных DEAE-групп и отрицательного заряда на клеточной мембране.
Культивирование в посуде из полипропилена с низкими адгезионными свойствами позволяло сохранить клетки на поверхности декстрановых гранул (рис. 5а см на вклейке). Стоит отметить, что распластывание клеток мы наблюдали только на поверхности декстрановых гранул, но не на пластинах гиалуроновой кислоты. Количество прикрепленных клеток с помощью световой микроскопии было определить достаточно сложно, так как клетки располагались на сферическом носителе. Подсчет клеточных ядер, окрашенных DAPI, показал, что на одной единице носителя располагалось 17±8 клеток (рис. 5б см на вклейке). Более длительное культивирование (более 5 суток), однако, также приводило к образованию достаточно крупных конгломератов (рис. 5в см на вклейке).
Оценка выживаемости клеток в условиях, имитирующих трансплантацию
 Пропускание отмытой от культуральной среды суспензии уродекса с адгезированными клетками через иглу 20G не приводило к гибели клеток. При окрашивании 0,4% трипановым синим декстрановые гранулы адсорбировали краситель, клетки же оставались неокрашенными. При этом часть поверхности гранул в процессе развития окраски и после ее завершения оставалась более светлой, так как прикрепленные клетки препятствовали проникновению красителя (рис. 6а, 6б см на вклейке).
Пропускание отмытой от культуральной среды суспензии уродекса с адгезированными клетками через иглу 20G не приводило к гибели клеток. При окрашивании 0,4% трипановым синим декстрановые гранулы адсорбировали краситель, клетки же оставались неокрашенными. При этом часть поверхности гранул в процессе развития окраски и после ее завершения оставалась более светлой, так как прикрепленные клетки препятствовали проникновению красителя (рис. 6а, 6б см на вклейке).
Заключение
Результаты проведенного нами исследования показывают, что объемобразующий препарат уродекс обладает свойствами, позволяющими использовать его в качестве инъекционного микроносителя для тканевой инженерии: 1) достаточная стабильность в условиях культивирования; 2) отсутствие цитотоксичности по отношению к МСК; 3) эффективная адгезия клеток; 4) механические свойства, обеспечивающие выживаемость прикрепленных клеток при трансплантации.
В то же время использование данного микроносителя имеет ряд технологических особенностей: 1) высокие сорбционные свойства декстрановых гранул не допускают использования в процессе культивирования сред с добавлением красителей; 2) возможность образования конгломератов клеток и гранул задает достаточно узкие временные рамки процесса культивирования.
Разработанная на основе уродекса инъекционная форма тканеинженерной конструкции теоретически может значительно увеличить и пролонгировать эффект применения препарата в моноварианте за счет дополнительного воздействия клеточного компонента на регенеративные процессы в периуретральной области. Следующим этапом нашей работы станет оценка безопасности и эффективности разработанной конструкции на экспериментальной модели стрессового недержания мочи in vivo.