Известно, что пролапс гениталий (ПГ) является мультифакториальным заболеванием с аддитивным вкладом причин, в основе которого лежат конституциональные, генетические, социальные факторы, а также ряд особенностей течения беременности и родов [1, 2].
Ранее у пациенток с ПГ нами был описан синдром дисплазии соединительной ткани, который в 50,9% случаев клинически проявлялся слабостью стромально-мышечного компонента в виде преобладания апикальных форм ПГ (79,5%) (р=0,020), в том числе в 60,2% случаев – синдромом протрузии и релаксации тазового дна [3].
Слабость стромально-мышечного компонента на экстрагенитальном уровне подтверждали: отсутствие элонгации шейки матки у 60% больных (элонгация шейки матки у пациенток с ПГ – залог сохранности стромально-мышечного компонента), уменьшение толщины миокарда левого желудочка при эхокардиографии (0,871*, р=0,024), плоскостопие (73,8%), причем в 50% случаев – III степени, наличие дисфункции аноректального отдела тазовой диафрагмы с формированием истинного ректоцеле (-0,715**, р=0,001), астенический тип телосложения (72,9%), низкий индекс мышечной массы и снижение толерантности к длительным статическим нагрузкам, низкие показатели кистевой манометрии (0,247**, р=0,015), сколиоз II степени (33%), феномен «плоской спины» (66,7%), гипермобильность суставов (индекс 4,7 (2,74 балла), нарушения рефракции с детства (22,2%), склонность к артериальной гипотензии, тенденция к функциональной истмико-цервикальной недостаточности во время беременности (23%), высокая степень зрелости шейки матки к моменту родов по шкале Бишоп у первобеременных (5,1 (0,9 баллов), тенденция к несвоевременному излитию околоплодных вод, быстрым и стремительным родам (37,6%) или к удлинению фазы ускорения и/или второго периода родов при выраженном синдроме гипермобильности суставов с реализацией в слабость родовой деятельности (р=0,011) и т.д. [3].
Нами было показано, что ПГ у молодых пациенток сопровождается снижением уровня экспрессии α-1-субъединицы потенциал-зависимого кальциевого канала CaV1.2 в круглой связке [3].
Кальциевые каналы CaV1.2 представлены во всей гладкомышечной системе: гладких мышцах органов и сосудов, в том числе в матке, кишечнике; также каналы CaV1.2 необходимы для сократимости сердца, нейроэндокринной регуляции и множества других процессов [4].
α-1-субъединица потенциал-зависимого кальциевого канала CaV1.2 является основной каналообразующей структурой, которая образует проводящий канал и несет сенсор потенциала и участок, связывающий дигидропиридины [5]. Работа Са2+-каналов опосредуется транспортом ионов Са2+ внутрь клетки и из клетки, что ведет к изменению сопряжения процессов возбуждения и покоя с последующим изменением функции клетки, что и обуславливает многофункциональные эффекты на уровне многих органов и систем.
Нарушение функции кальциевых каналов может привести к развитию таких состояний, как угроза преждевременных родов и преждевременные роды, аномалии родовой деятельности с тенденцией к слабости родовой деятельности, врожденная кардиомиопатия и нарушения ритма сердца у новорожденных, артериальная гипотензия.
Что касается снижения уровня экспрессии α-1-субъединицы потенциал-зависимого кальциевого канала CaV1.2 в гладкомышечной ткани у пациенток с ПГ, то ни в отечественной, ни в зарубежной литературе подобных исследований мы не нашли.
Учитывая, что ПГ у молодых пациенток нередко носит наследственный характер и сопровождается слабостью стромально-мышечного компонента на экстрагенитальном уровне, в помощь практическому врачу мы представляем клиническое наблюдение, в котором показана взаимосвязь снижения уровня экспрессии гена CACNA1C в гладкомышечной ткани у пациентки 37 лет с ПГ с системными экстрагенитальными проявлениями слабости стромально-мышечного компонента. Представлен разработанный метод комбинированной хирургической коррекции многокомпартного пролапса тазовых органов.
Клиническое наблюдение
Пациентка 37 лет поступила в клинику в январе 2018 г. с диагнозом: неполное выпадение матки и стенок влагалища, ректоцеле 2–3-й степени, синдром протрузии и релаксации тазового дна.
В анамнезе: росла и развивалась нормально. Менструации с 14 лет, установились сразу по 5 дней, через 28 дней, умеренные, безболезненные. Беременностей – 2, родов – 2. Первые самопроизвольные своевременные роды (3450/51 см) в 2006 г. осложнились вторичной слабостью родовой деятельности, родостимуляцией окситоцином. Длительность второго периода составила 3,5 ч. Промежность интактна, послеродовый период без осложнений. Вторые самопроизвольные своевременные роды (3750/50 см) – без особенностей. Длительность родов 8 ч. Промежность интактна, послеродовый период без осложнений.
Анамнез заболевания. Впервые ПГ у данной пациентки был выявлен через 1 год после вторых родов в 2014 г. В течение 3 лет заболевание прогрессировало до неполного выпадения матки и стенок влагалища.
Наследственные заболевания отрицает. Сын от второй беременности страдает аутизмом.
При поступлении пациентка предъявляла жалобы на выпадение половых органов, запоры по 2–3 дня, оказание ручного пособия при дефекации, чувство «неполного опорожнения кишечника», учащенное мочеиспускание по типу императивного, тянущие боли внизу живота к вечеру.
Сопутствующие заболевания: с пубертата страдает артериальной гипотензией (АД может снижаться до 90/60 мм рт. ст.), имеет хронический ринит, хронический ларингит (преподаватель вуза), дискинезию желчевыводящих путей, геморрой 2 ст., миопию с ранней манифестацией в возрасте 14 лет (-3Д), склонность к запорам. Пациентка отмечает плохое заживление ран, повышенную кровоточивость при повреждении кожных покровов.
Объективно: рост 162 см, масса тела 66 кг, кожа и слизистые обычной окраски, эластичность кожи повышена (2–3 см), истончена, стрий нет. Имеет малые аномалии развития: сандалевидную щель на обеих ногах, второй палец ноги больше первого, поперечное плоскостопие, длина кисти/к росту ×100 (19:162×100=11,7), размах рук – рост + 3 см, положительный тест запястья для всех пальцев кисти, гипермобильность суставов 8 баллов, склонность к вывихам голеностопного сустава. Таким образом, фенотипически пациентка имела синдром дисплазии соединительной ткани, элерсоподобный фенотип.
Проведено общеклиническое обследование, включая ультразвуковое исследование гениталий, эхокардиографию, специальные методы исследования (дефекография, изучение проводимости по тазовому нерву, сфинктерометрия, аноректальная манометрия).
 Ткань круглой связки матки, взятую во время хирургической коррекции ПГ, резали на криостате (толщина среза 15 мкн) и помещали в пробирку с лизирующим буфером и протеинкиназой А. Выделение нуклеиновой кислоты производили, используя набор «РНК-экстран» («Синтол»). Далее проводили реакцию обратной транскрипции с праймерами oligodt («Синтол») и с полученной ДНК осуществляли постановку полимеразной цепной реакции в реальном времени. Для подбора праймеров использовали программы PrimerSelect и Primer-Blast. В качестве референсного гена выступал RPL19.
Ткань круглой связки матки, взятую во время хирургической коррекции ПГ, резали на криостате (толщина среза 15 мкн) и помещали в пробирку с лизирующим буфером и протеинкиназой А. Выделение нуклеиновой кислоты производили, используя набор «РНК-экстран» («Синтол»). Далее проводили реакцию обратной транскрипции с праймерами oligodt («Синтол») и с полученной ДНК осуществляли постановку полимеразной цепной реакции в реальном времени. Для подбора праймеров использовали программы PrimerSelect и Primer-Blast. В качестве референсного гена выступал RPL19.
При эхокардиографии отмечено пролабирование митрального клапана II степени (5 мм), с митральной регургитацией I степени, трикуспидальной регургитацией I степени, аортальной регургитацией I степени, поперечная хорда левого желудочка, миксоматозная дегенерация и недоразвитие задней створки митрального клапана. Конечный диастолический объем левого желудочка составил 103,9 мл, фракция выброса 64,9.
На ЭКГ диагностирован синусовый ритм, 70 в минуту, нарушение внутрижелудочковой проводимости, неполная блокада правой ножки пучка Гиса.
Учитывая, что пациентка предъявляла жалобы на склонность к запорам, использовала ручное пособие при дефекации, имела жалобы на чувство неполного опорожнения кишечника, а также для исключения иных причин, приведших к развитию ПГ (пудендальная нейропатия), ей были выполнены дефекография, сфинктерометрия, исследование проводимости по пудендальному нерву.
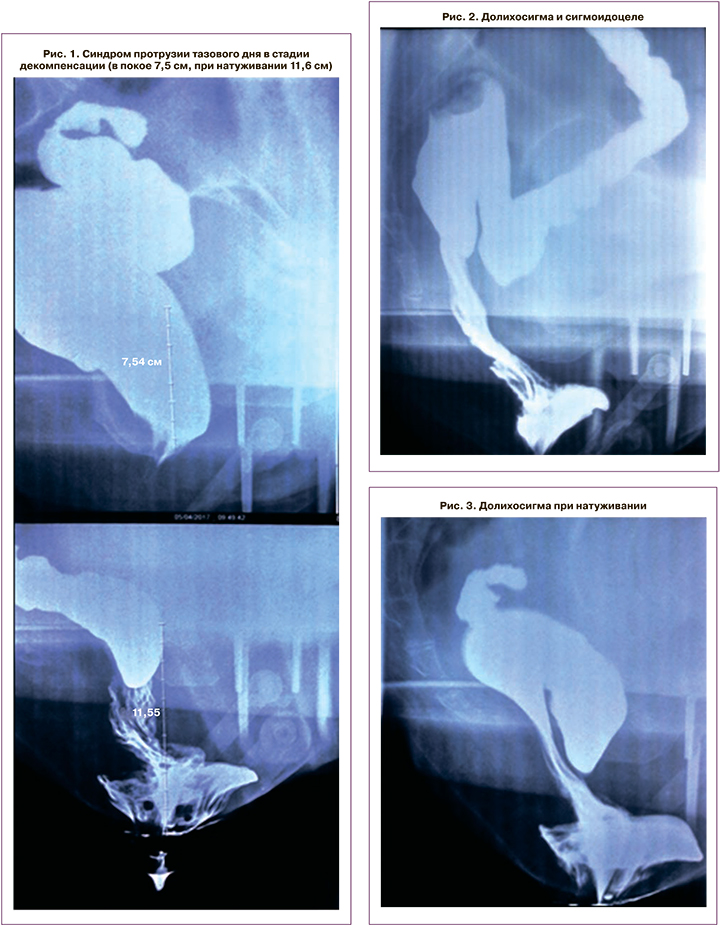
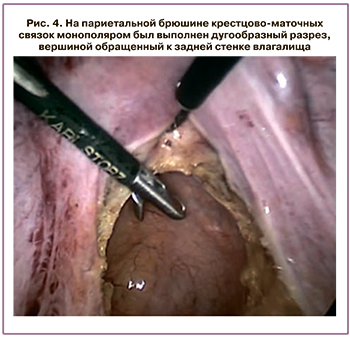
 При дефекографии диагноз «синдром протрузии тазового дна» был подтвержден (рис. 1). Кроме того, при дефекографии были выявлены сигмоидоцеле и долихосигма (рис. 2, 3). При исследовании проводимости по пудендальному нерву патологии выявлено не было.
При дефекографии диагноз «синдром протрузии тазового дна» был подтвержден (рис. 1). Кроме того, при дефекографии были выявлены сигмоидоцеле и долихосигма (рис. 2, 3). При исследовании проводимости по пудендальному нерву патологии выявлено не было.
В клинике была выполнена операция по разработанной нами методике: лапароскопия, комбинированная гистеропексия с использованием сетчатого импланта в сочетании с сигмоидопексией, ректопексией [6], передняя кольпоррафия, кольпоперинеоррафия, леваторопластика.
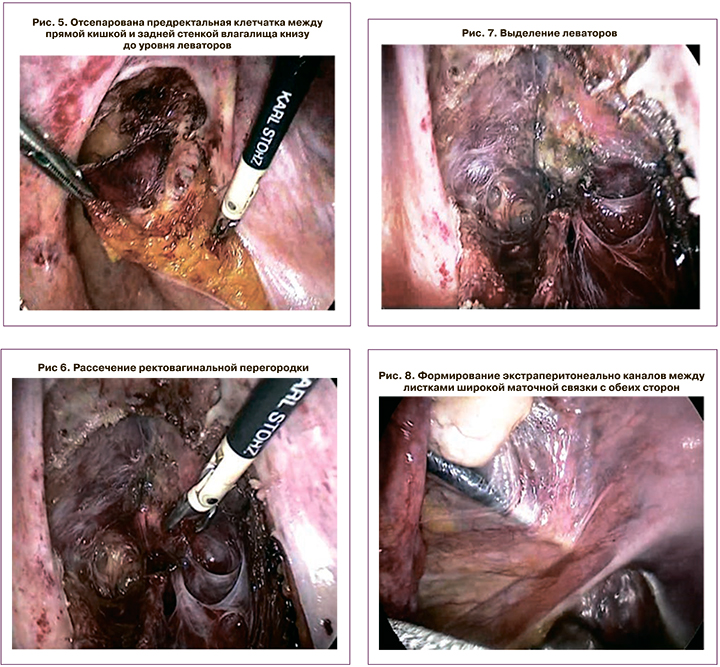
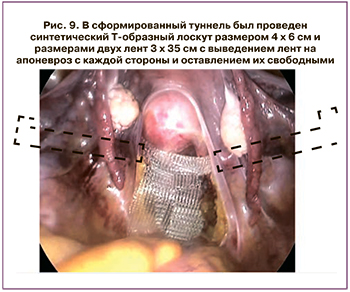
Интраоперационно обращало на себя внимание истончение брюшины, варикозное расширение вен органов малого таза, имелась долихосигма (петля сигмовидной кишки выпадала в дугласов карман, что клинически проявлялось апикальным выбуханием заднего свода влагалища). Ход операции: по париетальной брюшине крестцово-маточных связок монополяром был выполнен дугообразный разрез, вершиной обращенный к задней стенке влагалища, отсепарован эмбриональный слой между прямой кишкой и задней стенкой влагалища книзу до уровня m. levator ani. Затем с обеих сторон был сформирован экстраперитонеальный туннель: через левый латеральный прокол со стороны наружного края левой наружной косой мышцы между листками левой широкой маточной связки, левой и правой крестцово-маточными связками, между листками правой широкой маточной связки, со стороны наружного края правой наружной косой мышцы, через правый латеральный прокол. В сформированный туннель был проведен синтетический Т-образный лоскут размером 4×6 см и размерами двух лент 3×35 см. Лоскут был фиксирован в двух местах: в точке проекции отхождения крестцово-маточных связок от матки и к леваторам, с выведением лент на апоневроз с каждой стороны и оставлением их свободными. Выполнены облитерация дугласова кармана, пликация крестцово-маточных связок, сигмоидопексия (рис. 4–13) и типичным доступом – передняя кольпоррафия, кольпоперинеоррафия, леваторопластика. Послеоперационный период протекал без осложнений. Выписана на 6-е сутки. Через 1 год пациентка жалоб не предъявляла. На контрольной дефекографии патологии не выявлено (рис. 14).

Обсуждение
У больной, помимо саркопенического фенотипа, имеются также нарушения сердечного ритма и проводимости, что не исключает наличие стертых форм врожденных каналопатий (синдрома Бругада). Также на возможный генетический дефект гена CACNA1C указывает и наличие аутизма у сына от второй беременности и родов [7, 8].
Разработанный в клинике метод комбинированного хирургического вмешательства является патогенетически обоснованным именно у молодых больных с саркопеническим фенотипом при многокомпартных пролапсах тазовых органов. Метод позволяет одномоментно экстраперитонеальным проведением лоскута снизить травматичность и длительность операции, препятствует развитию спаечного процесса в брюшной полости, уменьшает количество синтетического материала в организме, позволяет укрепить крестцово-маточный аппарат и ректовагинальную перегородку с позиций анатомо-функциональных и этиопатогенетических подходов. Наличие только заднего синтетического полукольца («задний слинг»), а также расположение импланта экстраперитонеально не препятствует вхождению в брюшную полость при возможных последующих хирургических вмешательствах, в том числе при кесаревом сечении. Облитерация дугласова пространства заменяет фиксацию лоскута к прямой кишке, что профилактирует функциональные расстройства прямой кишки.
Заключение
Снижение экспрессии α-1-субъединицы потенциалзависимого кальциевого канала CaV1.2 в гладкомышечной ткани у пациенток с ПГ может лежать в основе «саркопенического фенотипа» при синдроме дисплазии соединительной ткани.
Нарушение функции кальциевого канала CaV1.2 вследствие снижения экспрессии α-1-субъединицы проявляется на тканевом, органном и системном уровне.
Разработанный метод комбинированной лапароскопической гистеропексии (вагинопексии) в сочетании с ректопексией, коррекцией «высокого» ректоцеле (энтероцеле) является патогенетически обоснованным методом у пациенток с многокомпартными формами пролапса тазовых органов.



