Заживление шва на матке после кесарева сечения (КС) является определяющим фактором для формирования полноценного рубца и благополучного течения последующей беременности и ее исхода [1].
В комплексе мероприятий по подготовке к предстоящей беременности важную роль играет оценка состояния рубца на матке в интервальном периоде. Эффективным хирургическим методом коррекции несостоятельности рубца на матке (НРМ) является лапароскопическая метропластика (через 2–5 лет после родов). Мотивацией для выполнения лапароскопической метропластики в интервальном периоде служат угроза разрыва матки по рубцу во время беременности и родов, высокий риск гистерэктомии в родах при врастании плаценты в рубец и образование «маточной грыжи», несостоятельный рубец с клиническими проявлениями (дисменорея, постменструальные кровянистые выделения) [2].
Операция лапароскопической метропластики нижнего сегмента матки при НРМ после КС, выполняемая в интервальном периоде, описана Tower A.M и Frishman G.N (2013), Поповым А.А. и Буяновой С.Н. (2010) [3, 4]. Однако в данных работах отсутствуют сведения об отдаленных результатах.
Цель исследования: определить влияние хронического эндометрита на формирование несостоятельного рубца на матке и результаты лапароскопической метропластики.
Материал и методы исследования
Дизайн: простое проспективное наблюдательное несравнительное клиническое исследование.
Материал: С 2009 по 2018 гг. нами выполнено 96 лапароскопических метропластик нижнего сегмента матки по поводу НРМ после КС. В исследование включено 50 пациенток с НРМ, обратившихся в ЦОГ «Женская клиника» г. Екатеринбурга, прооперированных одним хирургом, по единой методике, в условиях одного лечебного учреждения, у которых с момента операции КС прошло более 1 года и отвечавшие требованиям включения/исключения. Они были разделены на две группы. В I группу вошли 26 пациенток с наличием хронического эндометрита (ХЭ, N71.1 – хроническая воспалительная болезнь матки), во II – 24 пациентки без ХЭ. Диагноз ХЭ ставился до операции либо ретроспективно после выполнения диагностической гистероскопии, перед хирургическим вмешательством (метропластикой), впоследствии подтвержденным на основании морфологического исследования аспирата из полости матки.
Критерии включения в исследование: возраст 25–45 лет; несостоятельный рубец на матке после кесарева сечения (код по МКБ-10 – О34.2); интервал от КС до включения в исследование – не менее 12 мес., овуляторный менструальный цикл; изокоагуляция крови; наличие добровольного информированного согласия.
Критерии исключения: острые инфекционные заболевания; пороки развития половых органов; ИППП без предварительной санации; злокачественные новообразования любой локализации; тяжелая соматическая патология; туберкулез любой локализации; заболевания эндокринной системы; неполный объем данных в отдаленном послеоперационном периоде.
Методы диагностики. Ультразвуковое исследование матки выполняли на 7–9 день менструального цикла в прямой и боковой проекции (аппарат Voluson E8, конвексный датчик 2–5 МГц, влагалищный (внутриполостной) датчик 4–9 МГц., в том числе режим 3D Statiсa). Васкуляризацию рубца определяли методом допплерометрии. С помощью гистероскопии определяли признаки неполноценности рубца, аденомиоза и эндометриоза рубца и других локализаций, оценивали состояние эндометрия, наличие внутриматочных сращений. Выполняли морфологическое исследование аспиратов эндометрия, полученных во время гистероскопии, и иссеченных во время операции тканей рубца миометрия, окрашенных гематоксилином и эозином, пикрофуксином по Ван Гизону на световом микроскопе ECL1PS 50.
У части пациенток до операции был взят посев из полости матки по показаниям (наличие в анамнезе ХЭ, привычного невынашивания, несостоявшегося выкидыша, длительных белей из половых путей).
Катамнез изучался на основании телефонного опроса по специально разработанной анкете.
Методы лечения. При выявлении роста условно-патогенной микрофлоры в значимом титре перед хирургическим вмешательством проводилась антибактериальная терапия (согласно чувствительности к антибиотикам) в сочетании с процедурами орошения полости матки с помощью растворов, кавитированных низкочастотным ультразвуком аппаратом ФОТЕК АК101. Использовали 0,05% раствор водного хлоргексидина, частота ультразвуковых колебаний 25 кГц, расход лекарственного раствора 100–150 мл/мин., объем инфузии 200–300 мл. Курс состоял из пяти процедур, каждая из которых длилась 3–4 минуты [5]. Оперативное вмешательство выполняли после контрольного бактериологического исследования.
Метропластика проводилась на 4–7 день менструального цикла под эндотрахеальным наркозом, лапароскопическим доступом, с использованием 3-х лапаропортов для инструментов (К. Storz), установленных в типичных точках. Предварительно (в условиях одного анестезиологического пособия) всем пациенткам проведена диагностическая гистероскопия, вакуум-аспирация эндометрия. После осмотра органов малого таза и брюшной полости выполняли адгезиолизис (при наличии послеоперационных спаек) и хирургическое лечение сопутствующей гинекологической патологии (миома, эндометриоз, кисты яичника и т.д.). Далее переходили непосредственно к основному вмешательству (метропластике), которое выполняли по стандартной методике, дополненной аргоноплазменной коагуляцией. Видимая рубцовая ткань иссекалась ножницами с верхнего и нижнего края образовавшегося дефекта стенки матки. Края дефекта обрабатывались факелом аргоновой плазмы (Аппарат Фотек ЕА-142, режим «Спрей», мощность 60 Вт) [6]. На рану матки накладывались 1–2-х рядные, отдельные швы (викрил 2.0). Затягивание швов осуществлялось экстракорпорально. Повторно выполняли аргоноплазменную коагуляцию шва. Перитонизация шва не производилась. При отклонении матки кзади, с целью временного ее репозиционирования (для уменьшения нагрузки на шов и профилактики прорезывания шва) выполнялась пликация круглых связок к передней поверхности матки отдельным швом (викрил 1.0).
Показаниями для выполнения лапароскопической метропластики были: желание пациентки иметь последующие беременности, длина дефекта более 7–8 мм (более 1/3 ширины нижнего сегмента матки в области рубца), ширина дефекта более 4 мм, формирование истмоцеле, толщина стенки матки в верхушке ниши менее 2,5 мм, наличие жидкостного образования в рубце, наличие пограничных размеров дефекта в сочетании с клиническими проявлениями (дисменорея, боли, бесплодие, постменструальные мажущие кровянистые выделения) либо УЗ-признаками эндометриоза рубца.
Условиями выполнения операции были: комплексная санация ХЭ до операции (при его дооперационном выявлении), локализация рубца на уровне или выше внутреннего зева, отсутствие противопоказаний.
Интраоперационно вводили амоксиклав 1,2 г в/в капельно (92% от общего количества пролеченных) или цефтриаксон 2,0 в/в капельно (8%). При выраженных признаках ХЭ по данным гистероскопии введение антибиотиков продолжали до 5 дней.
В послеоперационном периоде с 1 суток после операции проводили: магнитотерапию на низ живота аппаратом Полюс 2Д, 40 мТл, частота – 12,5 Гц, вид поля – пульсирующий, продолжительность – 20 мин, количество сеансов – 5; внутривенное лазерное облучение крови (ВЛОК), длинной волны 0,63 мкм, продолжительность – 15–20 мин, 5 сеансов на курс.
Исследование проведено с учетом требований международных и российских законодательных актов о юридических и этических принципах медико-биологических исследований у человека, одобрено этическим комитетом Уральского государственного медицинского университета Минздрава России (протокол № 28 от 03.04. 2015 г.), все пациентки дали свое информированное добровольное согласие.
Статистическая обработка результатов проведена с помощью пакета прикладных программ Statistica 6.0 и программного обеспечения Microsoft Excel 2000. Нормальность распределения данных непрерывного типа определяли по критерию Колмогорова-Смирнова. Количественные данные представлены в виде среднего и стандартного отклонения [M(SD)]. Статистическую значимость различий между двумя средними показателями оценивали с помощью непарного t-теста Стьюдента (различия считали статистически значимыми при р≤0,05). Качественные показатели представлены в виде абсолютного значения в выборке и его доли (n/ %). При оценке достоверности различий качественных показателей опирались на уровни значимости различий, вычисленные при помощи точного теста Фишера в модуле «Таблицы 2×2» программы Statistica.6. При р менее 0,05 различия считали значимыми. При сравнении групп малого объема к критерию χ2 Пирсона применяли поправку Йетса, если абсолютные частоты в клетках таблицы были меньше 10.
Результаты исследования
Клиническая характеристика пациенток. Возраст обследованных колебался от 25 до 45 лет и в среднем составил 33,2 (3,7) лет. Данные социального статуса и анамнеза представлены в таблице 1.
По данным анамнеза течение послеоперационного периода после КС осложнилось послеродовым эндометритом, гипертермией и/или нагноением послеоперационного шва у 15,4% (4/26) пациенток I группы и у 4,2% (1/24) – II (р=0,05), т.е. только у 10% пациенток с НРМ отмечались острые послеродовые инфекционно-воспалительные заболевания.
В клинической картине НРМ имели место дисменорея у 19,2% (5/26) и 20,8% (5/24, р=0,45) пациенток соответственно и постменструальные мажущие кровянистые выделения – у 57,7% (15/26) и 33,3% (8/24, р=0,04) соответственно.
Особенности объективного гинекологического статуса. Положение матки в retroflexio выявлено у 40% (20/50) пациенток. При этом в I группе – у 34,6% (9/26) и во II – у 45,8% (11/24, р=0,60). У 54% (27/50) дефект передней стенки матки определялся при влагалищном исследовании.
Результаты лабораторных методов исследования. Бактериологическое исследование (посев из полости матки) выполнено по показаниям у 14 и 6 пациенток I и II групп. Рост условно-патогенной флоры выявлен у 50% (7/14) и 33,3% (2/6) пациенток соответственно (р=0,18).
Выделенная микрофлора была представлена преимущественно энтерококками (E. fecalis) – в 56% наблюдений, энтеробактериями (E. coli) – в 33% и грибами рода Candida (albiсans, krusei) – в 22%. В половине и более случаев (50 и 67% соответственно) патогенных возбудителей не выявлено.
Результаты функциональных методов исследования. По данным УЗИ «ниша» – дефект миометрия, была визуализирована в 100% случаев, толщина миометрия в верхушке ниши была 1,7 (0,61) и 1,78 (0,75) мм в I и II группах соответственно (р=0,39). При этом длина дефекта составила в среднем 11,8 мм, а ширина 5,8 мм в обеих группах. У 30,8% (8/26) и 29,2% (7/24) (р=0,45) отмечалось втяжение наружного контура матки. У 23,1% (6/26) и 33% (8/24) обследуемых соответственно (р=0,2) ниши сочетались с жидкостными включениями и полостями в области рубца. Сопутствующие гинекологические заболевания выявлены у 80% (43/50) пациенток обеих групп: миома матки у 7,7% (2/26) и 4,2% (1/24) соответственно (р=0,54) и аденомиоз (в дальнейшем подтвержден гистероскопически) – у 76,9% (20/26) и 83,3% (20/24) соответственно (р=0,73).
Признаки эндометриоза рубца по данным УЗИ выявлены у 28% (14/50) пациенток обеих групп: у 23,1% (6/26) – в I группе и у 33,3% (8/24) – во II (р=0,2), из них диагноз подтвержден гистологически – только у 10% (5/50).
При гистероскопии обращали внимание на признаки ХЭ. При этом в совокупности они выявлялись не у всех пациенток, и были обнаружены у 23 из них, при этом морфологически диагноз был подтвержден – у 19 (82,6%). Напротив, в 7 (14%) случаях по гистероскопическим признакам ХЭ не был обнаружен, а по результатам гистологического исследования – выявлен.
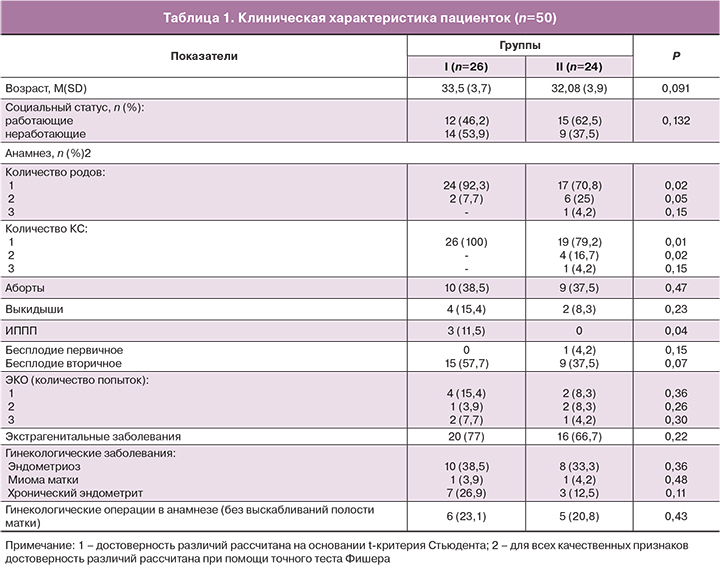
На основании многолетнего опыта нами были сформулированы гистероскопические признаки несостоятельного рубца: на фоне розового эндометрия в нижнем сегменте матки визуализируется ниша в виде полусферы (иногда с перемычками – «хордами») с четкими, ровными краями. Ниша (или ряд ниш в виде крупных сот) выстлана белой, блестящей пленкой с выраженной сосудистой сетью – симптом «инъецированной склеры». В области дефекта визуализируются «прилипшие» пузырьки газа, возможны очаги эндометриоза (черного или темно-красного цвета). По краям дефекта на границе с эндометрием визуализируются сосочковидные разрастания. Нижний край ниши может граничить с внутренним зевом или переходить в цервикальный канал, у части пациенток он имеет вид «козырька» и затрудняет осмотр стенок и дна дефекта. Кратерообразный дефект с округлыми краями белесоватого цвета, занимающий большую часть нижнего сегмента матки, без возможности осмотреть дно дефекта (как правило это картина истмоцеле). При осмотре дна ниши визуализируется полупрозрачная пленка (брюшина пузырно-маточной складки), что может говорить о полном дефекте миометрия.
Особенности ультразвуковой и гистероскопической картин на примере пациентки К., 31 год представлены на рисунке 1.
Особенности хирургического вмешательства. Дополнительные хирургические манипуляции на органах малого таза во время лапароскопической метропластики выполнены в 56% (28/50) случаях (табл. 2).
Обращает внимание более высокая частота адгезиолизиса и удаления очагов наружного эндометриоза крестцово-маточных связок в I группе.
Состояние рубца на матке после лапароскопической метропластики оценивали в динамике (табл. 3).
Анализ таблицы 3 показал, что статистически значимой разницы в результатах заживления шва после оперативного вмешательства не было. Однако отрицательный результат оперативного вмешательства (несостоятельный рубец) в I группе был в 3 раза чаще, чем во II (у 3 пациенток против 1 соответственно).
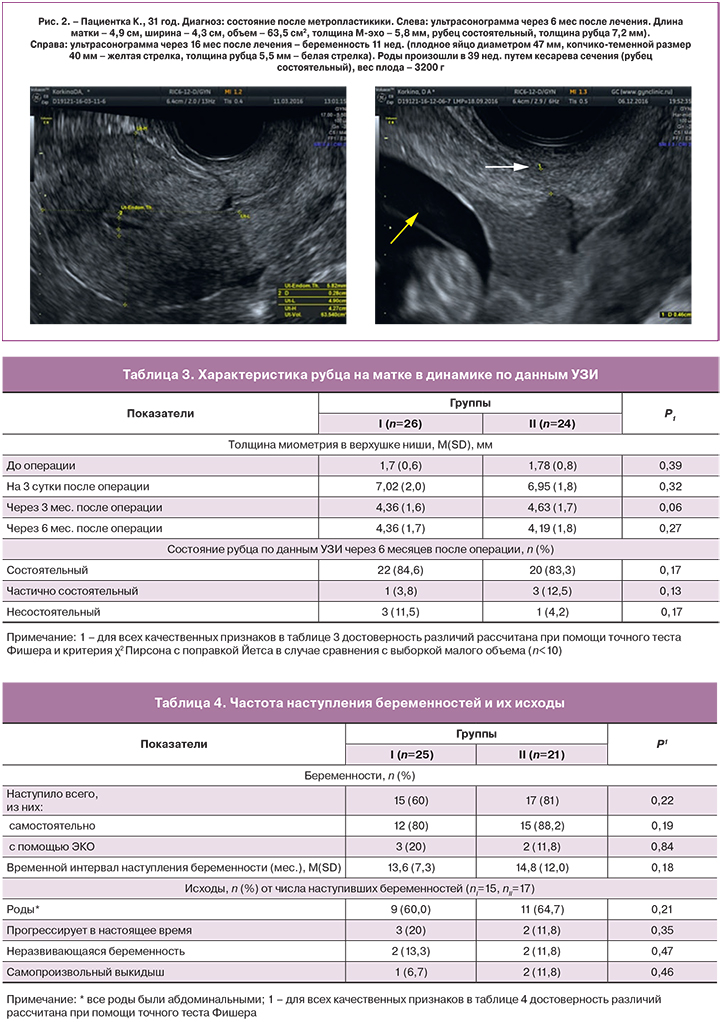
Особенности ультразвуковой картины после лечения на примере пациентки К., 31 год представлены на рисунке 2.
Общая эффективность метропластики составила 92%. У 1 пациентки в I группе и у 1 – во II была выполнена повторная лапароскопическая метропластика, в обоих случаях результат положительный – рубец состоятельный.
Результаты реализации репродуктивной функции (катамнез) представлены в таблице 4. Учитывали пациенток, которые заинтересованы в наступлении беременности – в I группе их было 25, во II – 21 (1 и 3 пациентки соответственно по разным причинам отказались от дальнейшей беременности и используют контрацептивы).
Из таблицы 4 видно, что полученные показатели наступления беременности и их исходы статистически значимо не отличались в группах.
Таким образом, фоновые показатели перед операцией метропластики в исследуемых группах отличались статистически значимо в большую сторону у пациенток I группы с ХЭ по сравнению с пациентками без ХЭ по наличию ИППП в анамнезе (11,5% против 0, р=0,04), мажущих кровянистых выделений в перименструальном периоде (57,7 против 33,3%, р=0,04), спаечного процесса в брюшной полости, по поводу которого был выполнен адгезиолизис (34,6 против 4,2%, р=0,003) и эндометриоза крестцово-маточных связок (50 против 20% соответственно, от числа пациенток с выявленных наружным эндометриозом, р=0,05). Результаты лапароскопической метропластики были одинаковыми у пациенток с НРМ при наличии ХЭ и без него.
Обсуждение результатов
Несмотря на значительное число исследований, посвященных разработке критериев оценки состояния рубца на матке после операции КС, систематический обзор русскоязычных исследований, посвященных вопросам родоразрешения пациенток с оперированной маткой, показал значительный разброс частоты встречаемости НРМ – от 5 до 60% [7].
Считается, что основными причинами, приводящими к развитию НРМ, служат послеоперационные гнойно-септические осложнения в раннем послеоперационном периоде (послеродовый эндомиометрит) и наличие любых внутриматочных вмешательств в течение первого года после КС [8]. Однако в настоящем исследовании инфекционно-воспалительные осложнения после КС имели место не более чем у 10% пациенток, что свидетельствует о наличии иных причин формирования НРМ.
В литературе отмечается, что большое значение имеет стертое течение эндометрита, ранняя выписка из акушерского стационара, поздняя диагностика эндометрита и несостоятельности шва на матке [1]. Те же авторы подчеркивают, что клинической особенностью формирования несостоятельного рубца на матке является прогрессирующий эндометрит, имеющий 2 варианта течения: с выраженной воспалительно-интоксикационной симптоматикой (в 22% наблюдениях) и стертой клинической картиной с преобладанием астенического синдрома (в 30%).
По нашему мнению внедрение хирургических методов обработки раневой поверхности на матке привело к существенному улучшению результатов лечения послеродовых эндометритов [6]. Однако недостаточно внимания уделяется стертым его формам, в связи с чем эндометрит принимает затяжное хроническое течение и на его фоне формируется вторичная несостоятельность рубца.
Наши данные подтверждают тезис о влиянии не диагностированных, а, следовательно, не леченных стертых форм послеродового эндометрита на формирование хронического процесса (52% пациенток имели ХЭ), что в свою очередь может являться одним из факторов, которые приводят к частичной несостоятельности шва, а в дальнейшем – рубца на матке после КС. Это косвенно подтверждается также наличием спаечного процесса в переднем Дугласовом кармане (34,6 против 4,1% в I и II группах соответственно, р=0,003) и ИППП в анамнезе (11,5% против 0 соответственно, р=0,04) среди обследованных нами пациенток.
В 80% случаев по совокупным данным УЗИ и гистероскопии у пациенток в настоящем исследовании выявлен аденомиоз, что, по-видимому, так же является фактором, влияющим на развитие НРМ. Постменструальные кровянистые выделения – признак клинически значимого ХЭ – достоверно чаще встречался в I группе (57,7 против 33,3% – во II, р=0,04), что нельзя объяснить только наличием аденомиоза (т.к. частота его статистически значимо не отличалась в сравниваемых группах – 77% против 83,3% соответственно, р=0,73) и величиной маточного дефекта (также одинаков).
Нами отмечено, что диагностические признаки ХЭ, определяемые во время гистероскопии, выявляются лишь у 82,6% пациенток с подтвержденным в дальнейшем диагнозом ХЭ морфологическим методом. Эти данные совпадают с результатами исследований других авторов, которые показали, что наиболее информативные признаки ХЭ, такие как неравномерная толщина эндометрия, полиповидные нарастания, неравномерная окраска и гиперемия слизистой оболочки, гистероскопически выявляются только у 30% пациенток. При этом чувствительность метода составляет всего 40%, специфичность – 80% (для сравнения соответствующие показатели морфологического исследования аспиратов эндометрия – 93 и 100%) [9]. Поэтому при подозрении на ХЭ гистероскопия важна для исключения всего спектра внутриматочной патологии, но не для верификации диагноза ХЭ.
Выполнение лапароскопической метропластики в интервальном периоде позволило получить положительные исходы по критерию наступление беременности у 60 и 81% пациенток в обеих группах без статистической разницы между ними и ее реализации родами у 60 и 64,7% соответственно и прогрессированием беременности в настоящее время – у 20 и 12,5% соответственно. Общая эффективность метропластики составила 92%. Отсутствие существенной разницы в отдаленных результатах между пациентками с ХЭ и без него мы можем объяснить комплексом всех мероприятий, проведенных в периоперационном периоде, направленных на подготовку к хирургическому вмешательству и реабилитационными воздействиями, выполненными во время и после него.
Так, орошение полости матки кавитированными растворами при ХЭ оказывает противовоспалительное действие, что было доказано на основании изучения основных медиаторов воспалительного ответа – острофазовых белков и системы цитокинов у женщин после неразвивающейся беременности (происходит снижение в 6 раз уровня IFN-γ и концентрации IL-8), позволяет достичь восстановления нормального биоценоза и структуры эндометрия [5].
Терапевтический эффект аргоноплазменной коагуляции во время операции метропластики основан как на прямом термическом воздействии на микробный агент, так и на активизации репаративных процессов в результате глубокого прогревания тканей в области шва [6].
Заключение
Высокая частота хронического эндометрита (52%) свидетельствует о его возможной роли в патогенезе недостаточности рубца на матке после кесарева сечения. Лапароскопическая метропластика в комплексе с подготовительными и реабилитационными мероприятиями является эффективной в 92% независимо от наличия или отсутствия хронического эндометрита.



