В настоящее время изучение хронического цервицита (ХЦ), ассоциированного с вирусом папилломы человека (ВПЧ) является одним из приоритетных направлений гинекологии ввиду высокой частоты его выявления среди женщин репродуктивного возраста (15–40% случаев) [1]. ВПЧ на сегодняшний день является наиболее распространенной инфекцией, передающейся половым путем, являющейся значимым фактором индукции и поддержания хронического воспаления шейки матки [2]. ВПЧ- ассоциированный ХЦ, в зависимости от персистенции или транзиторного характера течения инфекции, имеет ряд клинических, кольпоскопических и морфологических особенностей [3]. Развитие цервицитов обусловлено сложными взаимоотношениями микробиоты влагалища – возбудителей инфекций, передаваемых половым путем (Chlamydia trachomatis, Trichomonas vaginalis, Mycoplasma genitalium) с грибами, условно-патогенными аэробными и анаэробными микроорганизмами [4]. В последние годы, наряду с папилломавирусной инфекцией (ПВИ) доказана значимая роль хронического воспаления, ассоциированного с ВПЧ в развитии дисплазии и рака шейки матки [5]. Поиск современных информативных методов диагностики и определение молекулярно-генетических маркеров хронического воспаления позволит персонализировать подход и определить правильную тактику ведения пациенток [6].
Цель исследования: Изучить частоту выявления ХЦ, распространенность различных типов ВПЧ, значимость вирусной нагрузки, особенности экспрессии мРНК генов регуляции клеточного цикла, апоптоза, иммунитета, матриксных металлопротеиназ (ММР) и уровень метилирования промоторного участка гена WIF1 среди пациенток с ХЦ, ассоциированным с ПВИ.
Материал и методы
В исследование включено 202 пациентки 25–49 лет, средний возраст которых составил 31,8 (5,8) лет, обратившихся с целью диагностики и лечения патологии шейки матки на прием в научно-поликлиническое отделение ФГБУ «НМИЦ АГИ им. В.И. Кулакова» Минздрава России в период с октября 2016 г. по сентябрь 2018 г.
Критерии включения: женщины в возрасте от 25 до 49 лет с диагнозом ХЦ, подтвержденным данными цитологического и/или гистологического исследования и ВПЧ – положительным тестом; пациентки с диагнозом ХЦ при ВПЧ – отрицательным тесте; пациентки с положительным тестом на ВПЧ при отсутствии признаков ХЦ; женщины с ВПЧ – отрицательным тестом при отсутствии признаков ХЦ (контрольная группа). Всеми пациентками подписано информированное согласие на участие в исследовании.
Критерии исключения: беременность и период лактации, дисплазия и рак шейки матки, неспособность отвечать на требования протокола.
Проводился сбор клинико-анамнестических данных, общий и гинекологический осмотр, типирование с количественной оценкой ВПЧ, жидкостная цитология и/или прицельная биопсия шейки матки с последующим гистологическим исследованием (по показаниям), расширенная кольпоскопия, а также молекулярно-биологические методы исследования.
Методом полимеразной цепной реакции (ПЦР) с определением результатов в режиме реального времени (ООО «НПО ДНК-Технология», Россия, РУ Росздравнадзора № ФСР 2010/08811) проводили исследование на ВПЧ 21 типа (6, 11, 16, 18, 26, 31, 33, 35, 39, 44(55), 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82) с определением вирусной нагрузки. С помощью специального зонда проводили забор материала из цервикального канала в пробирки эппендорф объемом 1,5 мл с 0,9% раствором натрия хлорида [7].
Результаты жидкостной цитологии оценивали согласно классификации Бетесда (TDS – Terminology Bethesda System) (2014). Биопсию шейки матки и гистологическое исследование проводили по показаниям и оценивали по классификации ВОЗ (2014).
Оценка результатов расширенной кольпоскопии проводилась в соответствии с рекомендациями по кольпоскопической терминологии, представленной на 16-м Всемирном Конгрессе Международной Федерации по цервикальной патологии и кольпоскопии (IFCPC) (Орландо, 2017 г.). При проведении расширенной кольпоскопии оценивалось состояние эпителия шейки матки, сосудов, кольпоскопические признаки, такие как гипертрофия, наличие деформации, множественных наботовых кист, выраженный сосудистый рисунок, наличие или отсутствие ацетобелого эпителия на пробе с 3% раствором уксусной кислоты, неравномерное йодпозитивное и йоднегативное окрашивание шейки матки на пробе Шиллера [8].
Определение уровня экспрессии мРНК генов врожденного иммунитета IFNAR1, IL1RN, IL1B, IL10, IL18, TNFA, GATA3, TLR4, CD68, TGFB1, CXCL5, CXCL10, CXCL13, регуляции клеточного цикла и апоптоза KI67, CCND1, CDKN2A, BCL2, MMP8, MMP9, рецепторов прогестерона PGR и эпидермального ростового фактора EGFR проведено методом количественной ПЦР в режиме реального времени с предварительной обратной транскрипцией (реактивы и детектирующие амплификаторы производства ООО «НПО ДНК-Технология», Россия). В реакциях обратной транскрипции и амплификации использовались специфичные олигонуклеотиды и флуоресцентно-меченные по FAM пробы. Расчет относительного уровня экспрессии осуществлялся методом сравнения индикаторных циклов (∆Ср) с нормировкой по референсным генам B2M, GUSB, TBP [9].
Определение уровня метилирования участка промотора гена WIF1 проводилось в выделенном из гомогенизированных D образцов клеток шейки матки ДНК, концентрацию которого определяли флуориметрически с применением Qubit dsDNA HS Assay Kit на флуориметре Qubit 2.0 (Life Technologies, США) стандартного набора. С использованием набора innuCONVERT Bisulfite Basic Kit (Analytik Jena, Германия) 150 нг выделенного ДНК подвергали бисульфитной конверсии и фотометрическому определению количества конвертированной ДНК с использованием мультидетектора CLARIOstar (BMG Labtech, Германия). Выделили 20 нг бисульфит-конвертированной ДНК для проведения «тачдаун» ПЦР-амплификации с применением полимеразной смеси GoTaq Hot Start Green Master Mix (Promega, США) и праймеров, позволяющих увеличить число копий участка промотора гена WIF1 от -554 до -140 нуклеотидов до старт-кодона и содержащих комплементарную и универсальную последовательность M13 на 5’-конце: WIF1-M13F и WIF1-M13R. Посредством электрофореза в 2,5% агарозном геле с маркерами молекулярного веса 100 bp Molecular Ruler (Bio-Rad, США) определяли наличие и размер (длину) ПЦР-продуктов [10].
В центре коллективного пользования «ГЕНОМ» на базе Института молекулярной биологии им. В.А. Энгельгардта РАН проводилось дальнейшее секвенирование с использованием универсальных праймеров M13: M13F и M13R и проведен анализ продуктов реакции на автоматическом секвенаторе Applied Biosystems 3730 DNA Analyzer (США) [11].
Статистический анализ: проводился с помощью пакета SPSS for Windows v.22. IBM, USA. Количественные показатели были проверены на соответствие закону нормального распределения с помощью критерия Колмогорова-Смирнова. Для количественных данных, имеющих нормальное распределение, были рассчитаны среднее арифметическое (М) и стандартное отклонение (SD), которые представлены в формате М (SD). При описании показателей, отличающихся от нормального распределения, использовались медианы (Me) и квартили Q1 и Q3 в формате Me (Q1;Q3). Качественные показатели представлены как в абсолютных, так и в (%) относительных величинах.
Статистическая обработка результатов исследования в группах проводилась с определением значимости межгрупповых различий количественных показателей с помощью критерия Краскела-Уоллиса, и затем осуществлялось попарное сравнение количественных показателей с помощью U-критерия Манна-Уитни с поправкой Бонферрони для множественных сравнений. Для анализа качественных показателей использовался критерий Хи-квадрат c поправкой Йетса (в случаях абсолютных чисел менее 10), при невозможности его использования применялся Z-критерий для долей с поправкой для концевых точек.
Результаты и обсуждение
Обследованы 202 женщины в возрасте от 25 до 49 лет, средний возраст которых составил 31,8 (5,8) лет. По результатам цитологического исследования и ВПЧ-типирования сформированы 2 группы, которые разделены на 2 подгруппы в зависимости от наличия или отсутствия ПВИ на фоне ХЦ: 1 группа – 108 женщин с ХЦ, из них 1а подгруппа – 52 (25,7%) женщины с ХЦ и ВПЧ позитивным тестом, 1б подгруппа – 56 (27,7%) женщин с ХЦ и ВПЧ-негативным тестом; 2 группа – 94 женщины без признаков ХЦ, из них 2а подгруппа – 44 (21,8%) женщины без признаков ХЦ и ВПЧ-позитивным тестом, 2б – подгруппа – 50 (24,8%) здоровых женщин – без признаков ХЦ и ВПЧ-негативным тестом (контрольная группа). ВПЧ-ассоциированный ХЦ в структуре патологии шейки матки у женщин репродуктивного возраста выявлен в 25,7% случаев (рис. 1)
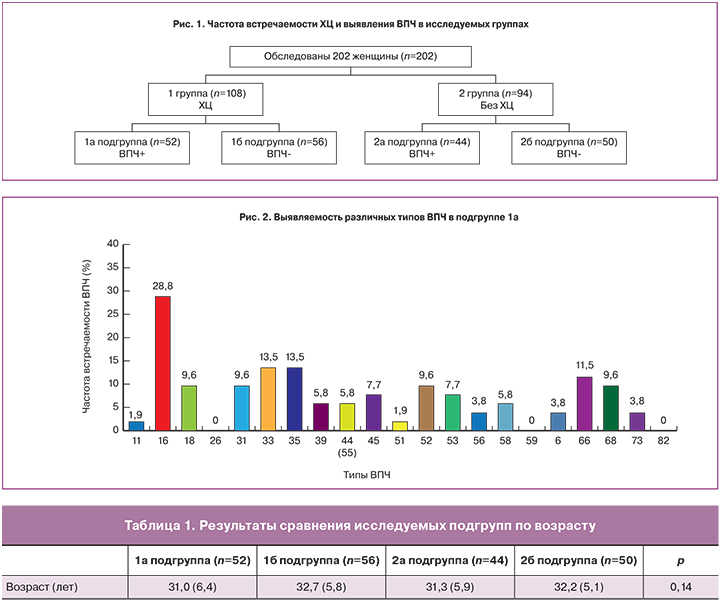
Средний возраст пациенток в подгруппах представлен в таблице 1, статистически значимых различий по критерию Краскела-Уоллиса не выявлено (р>0,05).
Наиболее часто в 1а подгруппе с ХЦ были выявлены ВПЧ 16, 33, 35, 66, 18, 31, 52, 68, 53, 45 39, 44 (55) и 58 типов. ВПЧ 16 типа выявлен у 15 женщин (28,8%); 33 и 35 – у 7 (13,5%); 66 – у 6 (11,5%); 18, 31, 68 и 52 – у 5 (9,6%); 53 и 45 – у 4 (7,7%); 39, 44 (55) и 58 – у 3 (5,8%). Остальные генотипы ВПЧ – 11, 56, 6, и 73 встречались менее чем в 5,0% случаев (рис. 2). Доминирующим в структуре канцерогенных генотипов ВПЧ являлся 16 тип. При проведении исследования на ВПЧ в 71,2% (n=37) случаев был выявлен один тип вируса, в 21,1% (n=11) – два типа ВПЧ, в 5,8% (n=3) случаев – три типа ВПЧ и в 1,9% (n=1) случаев – пять типов ВПЧ одновременно [12].
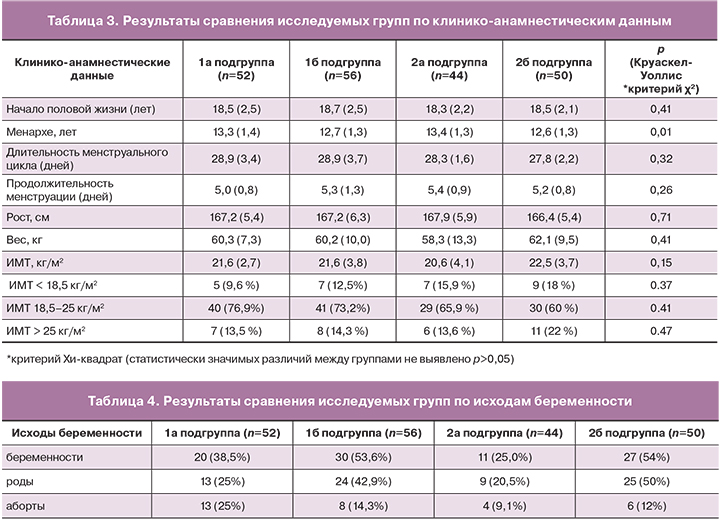
Наиболее часто в 2а подгруппе без признаков ХЦ были выявлены ВПЧ 16, 31, 52, 51, 53, 68, 18, 66, 33, 44 (55), 45, 56, 59 и 73 типов. ВПЧ 16 типа выявлен у 16 женщин (36,4%); 31 и 52 – у 8 (18,2%); 51, 53 и 68 – у 6 (13,6%); 18 и 66 – у 4 (9,1%). Остальные генотипы ВПЧ – 33, 44 (55), 45, 56, 59 и 73 выявлялись менее, чем в 5,0% случаев (рис. 3). Доминирующим в структуре высокоонкогенных ВПЧ являлся 16 генотип [13].
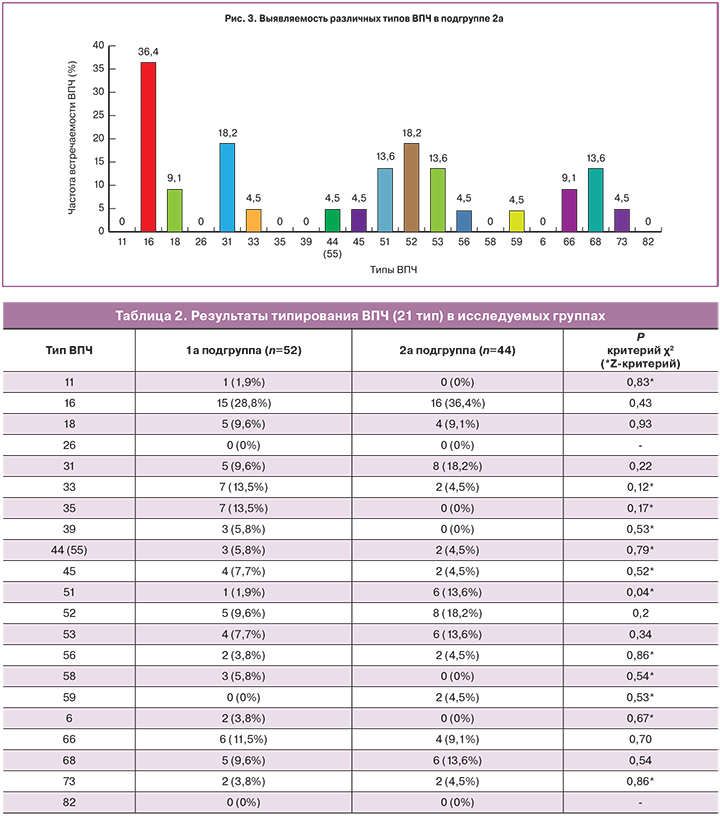
В исследуемых подгруппах выявлено статистически значимое преобладание ВПЧ 51 типа среди женщин 2б подгруппы без признаков ХЦ, по сравнению с 1б подгруппой с ХЦ (р=0,04) (табл. 2).
В 63,6% (n=28) случаев при проведении исследования на ВПЧ был выявлен один тип вируса, в 22,7% (n=10) – 2 типа ВПЧ, в 4,6% (n=2) – 3 типа ВПЧ и в 9,1% (n=2) – 4 типа ВПЧ одновременно.
Средняя вирусная нагрузка в 1а подгруппе с ХЦ на момент взятия в исследование составила 4,9 log копий вируса в образце (интерквартильный размах 3,6–6,6), а во 2а подгруппе (без признаков ХЦ) – 4,5 log копий вируса в образце (межквартильный размах 4,2 – 8,8). Величины вирусных нагрузок в исследуемых подгруппах существенно не отличались и не могут быть приняты в качестве критерия прогнозирования развития ХЦ.
Анализ клинико-анамнестических данных показал, что средний возраст начала регулярной половой жизни женщин составил в подгруппе 1а – 18,5 (2,5) лет, 1б –18,7 (2,5) лет, 2а –18,3 (2,2) года, в 2б (контрольной) группе – 18,5(2,1) года. Анализ среднего возраста начала половой жизни статистически значимых различий между подгруппами не выявил.
Возраст наступления менархе в среднем составил: в подгруппе 1а – 13,3 (1,4) года, 1б – 12,7 (1,3) года, 2а – 13,4 (1,3) года, 2б (контрольная группа) – 12,6 (1,3) года. Анализ среднего возраста менархе выявил статистически значимые различия: между подгруппами 1а и 2б (р=0,03), 1б и 2а (р=0,02), 2 а и 2 б(р=0,01). Продолжительность менструального кровотечения в среднем составила 5,2 (0,9) дней, при длительности менструального цикла в 28,4 (2,7) дней. При оценке менструальной функции значимых различий между подгруппами не выявлено.
Анализ усредненных данных клинико-анамнестических показателей пациенток, таких, как: рост – 60,2 (10) кг, вес – 167,2 (5,7) см, индекс массы тела (ИМТ) – 21,6 (3,6) кг/м2 статистически значимых различий между подгруппами не выявил (табл. 3).
Общее число беременностей в анамнезе в подгруппе 1а составило – 20 (38,5%), 1б – 30 (53,6%), 2а – 11 (25,0%), 2б – 27 (54%). Выявлено статистически значимое преобладание общего количества беременностей в 1б подгруппе по сравнению со 2а подгруппой (р=0,01). Общее число самопроизвольных родов в подгруппе 1а составило 13 (25%), 1б – 24 (42,9%), 2а – 9 (20,5%); Наибольшее число самопроизвольных родов отмечено в группе 2б (группа контроля) – 25 (50%). Имеются статистически значимые различия по числу самопроизвольных родов между 1а и 2а подгруппами, по сравнению с контрольной группой (р=0,01 и р=0,01 соответственно), и статистически значимые различия (р=0,01) между 1а и 1б подгруппами. Общее число абортов составило в подгруппе 1а – 13 (25%), 1б – 8 (14,3%), 2а – 4 (9,1%), 2б – 6 (12%). Установлено статистически значимое различие (р=0,03) по общему числу абортов между 2а и 1а подгруппами (табл. 4).
Цитологическое заключение «хронический цервицит» было получено в 61,5% (n=32) случаях в подгруппе 1а и в 69,6 % (n=39) случаях – в подгруппе 1б. У пациенток подгруппы 2а и 2б (контрольной) в 100% (n=44) и (n=50) случаях, соответственно, получено цитологическое заключение NILM (интраэпителиальные изменения и злокачественные процессы отсутствуют).
Расширенная кольпоскопия была проведена всем пациенткам (n=202). При кольпоскопическом исследовании значительно чаще наблюдались эктопия, выраженный сосудистый рисунок, гипертрофия и деформация шейки матки, множественные наботовы кисты с перерастянутым сосудистым рисунком, слабовыраженные кольпоскопические изменения, такие как тонкий ацетобелый эпителий, нежная пунктация, нежная мозаика и йоднегативные участки с нечеткими контурами среди женщин с ВПЧ- ассоциированным ХЦ. Хроническое воспаление в 78 (38,6%) случаях сопровождалосья аномальными кольпоскопическими изменениями шейки матки. По результатам кольпоскопического исследования 1а подгруппы у 18 (34,6%) пациенток выявлены множественные наботовы кисты, у 17 (32,3%) – гипертрофия шейки матки, у 14 (26,9%) – выраженный сосудистый рисунок, у 11 (21,1%) – тонкий ацетобелый эпителий с нежной пунктацией. У 47 (90,3%) женщин обнаружено неравномерное йодпозитивное и йоднегативное окрашивание шейки матки на пробе Шиллера. У всех 50 женщин (100%) контрольной 2б подгруппы описана нормальная кольпоскопическая картина. По сравнению с контрольной группой, среди исследуемых пациенток 1а и 1б подгрупп значительно чаще отмечены слабовыраженные изменения эпителия шейки матки (тонкий ацетобелый эпителий), в 71 и 65,8% случаев соответственно.
Женщинам 1а и 2а подгрупп с персистенцией ВПЧ со слабовыраженными кольпоскопическими изменениями (наличием ацетобелого эпителия с нежной мозайкой у 23 (23,9%) и пунктации – у 27 (28,1%)) и выраженными кольпоскопическими изменениями (плотный ацетобелый эпителий и грубая мозайка у 5 (5,1%)) была проведена прицельная биопсия шейки матки. По результатам гистологического исследования у 10 (18%) был диагностирован LSIL (плоскоклеточное интраэпителиальное поражение легкой степени); у 1(1,8%) – HSIL (плоскоклеточное интраэпителиальное поражение тяжелой степени), у 6 (10,9%) – лейкоплакия шейки матки, у 22 (40%) – подтвердился диагноз ХЦ. Пациентки с гистологически подтвержденным диагнозом LSIL и HSIL в дальнейшем были исключены из исследования (согласно критериям исключения).
ВПЧ – ассоциированный ХЦ наиболее часто был представлен 16, 52, 45, 31 типами ВПЧ высокого онкогенного риска; в сочетании с грибами рода Candida – у 68 (33,7%), с вирусами герпеса – у 29 (14,4%) и с другой условно-патогенной микрофлорой, среди которой доминирующими являются Escherichia coli – 42 (20,8%), Staphylococcus sарrорhуticus и aureus (33,7 и 14,4% соответственно).
Количественное и качественное определение состава микробиоценоза влагалища у женщин с ХЦ (подгрупп 1а и 1б) выявило у 45 (41,6%) женщин облигатно-анаэробные микроорганизмы в высоком количественном титре, факультативно-анаэробные микроорганизмы – у 21 (19,4%), грибы рода Candida – у 36 (33%) женщин, в 1 (0,9%) случае была обнаружена трихомонадная инфекция.
По результатам исследования транскрипционного профиля генов, связанных с ПВИ и воспалительным процессом (генов регуляции клеточного цикла, апоптоза, иммунитета, матриксных металлопротеиназ) было установлено, что при наличии ВПЧ у женщин в соскобах из цервикального канала в 1,8 раза повышается уровень экспрессии мРНК гена CDKN2A/p16 (p=0,02) (табл. 5). ВПЧ оказывает иммуносупрессорное действие, опосредованное противовоспалительным IL10, уровень которого повышается в 2,4 раза (p=0,01) при наличии ПВИ (подгруппа 2а). Иммуносупрессорное действие ВПЧ может приводить к формированию неадекватного провоспалительного иммунного ответа (отсутствие выраженных провоспалительных изменений в подгруппе 1а), дисбалансу нормальной и условно-патогенной флоры, что в конечном итоге, является фактором риска длительной персистенции вируса и дальнейшей дисплазии.

ХЦ в отсутствии ПВИ сопровождается повышением уровня экспрессии мРНК генов иммунитета IFNAR1, IL1B, IL10, TNFA, TLR4, CD68, TGFB1 и провоспалительной MMP9 от 1,5 до 2,9 раз (р=0,03).
Появление сайтов гиперметилирования гена WIF1 свидетельствует о начальных этапах формирования дисплазии шейки матки. По результатам исследования, метилирование промоторной области гена WIF1 не наблюдалось или было выражено слабо. Уровень метилирования промоторной области гена WIF1 между исследуемыми группами статистически значимо не отличался. Результаты секвенирования полученных образцов ДНК представлены на рисунке 4 [14].

Определение и оценка уровня гиперметилирования промоторного участка гена WIF1 является диагностическим и прогностическим маркером раннего выявления и лечения ВПЧ-ассоциированных заболеваний шейки матки.
Выводы
- ВПЧ-ассоциированный ХЦ в структуре патологии шейки матки выявлен у 52 (25,7%) женщин репродуктивного возраста.
- Результаты кольпоскопического исследования не выявили статистически значимых различий 1а и 2а подгрупп. Наиболее частыми кольпоскопическими изменениями при ХЦ являются: множественные наботовы кисты у 64 (59,2%), гипертрофия у 62 (57,4%) и деформация шейки матки у 58 (53,7%), выраженный сосудистый рисунок у 39 (36,1%) женщин. ХЦ в 1а и 2а подгруппах в 38,9% случаев сопровождается аномальными кольпоскопическими изменениями шейки матки.
- В 1а подгруппе наиболее часто выявляются следующие типы ВПЧ: 16 тип (28,8%), 33 и 35 (13,5%), 66 (11,5%), 18, 31, 68 и 52 (9,6%), 53 и 45 (7,7%), 39, 44 (55%) и 58 (5,8%) случаев. Наиболее часто выявляемыми типами ВПЧ во 2а подгруппе являются: 16 (36,4%), 31 и 52 (19,1%), 51, 53 и 68 (13,5%), 18 и 66 (9,5%) случаев. Доминирующим в структуре канцерогенных ВПЧ в 1а и 2а подгруппе являлся 16 генотип. Остальные генотипы ВПЧ выявлялись менее чем в 5,0% случаев. В 1а подгруппе один тип ВПЧ выявлен в 71,2% случаев, два и более типа ВПЧ – в 28,8% случаев. В 2а подгруппе один тип ВПЧ был выявлен в 63,6% случаев, два и более типа ВПЧ – в 36,4% случаев.
- Гены IFNAR1, IL1B, IL10, TNFA, TLR4, CD68, TGFB1 и MMP9 рассматриваются, как маркеры ХЦ. Наличие ВПЧ способствует повышению уровня экспрессии мРНК генов CDKN2A/p16 и иммуносупрессорного IL10, что может приводить к неадекватному иммунному ответу, дисбалансу нормальной и условно-патогенной флоры и способствовать длительной персистенции вируса и развитию дисплазии.
- Уровень метилирования промоторной области гена WIF1 между исследуемыми группами статистически значимо не отличался.
Заключение
Таким образом, полученные результаты свидетельствуют о высокой частоте выявления ВПЧ-ассоциированного ХЦ, который встречается у каждой четвертой пациентки. Вместе с тем, кольпоскопические признаки ХЦ являются не специфическими, и при этом, у каждой третьей пациентки выявляются аномальные кольпоскопические изменения шейки матки, характерные для LSIL, но не подтвержденные данными морфологического метода исследования. Отсутствие или слабое проявление аномального гиперметилирования промоторной области гена WIF1 у пациенток с ХЦ может расцениваться, как благоприятный прогностический признак в отношении канцерогенеза. Повышение уровня экспрессии мРНК генов IFNAR1, IL1B, IL10, TNFA, TLR4, CD68, TGFB1 и MMP9 практически в три раза может рассматриваться в качестве фактора, сопровождающего воспалительный процесс.



