Работа частично поддержана Государственным контрактом Министерства образования и науки РФ № 16.522.12.2009 от 29.09.2011.
Согласно современным представлениям, беременность развивается на фоне супрессии специфического иммунного ответа матери и компенсируется активацией неспецифической врожденной иммунной системы [1, 2]. Хроническая персистирующая инфекция в организме матери способствует постоянному поддержанию уровня внутрисосудистых гранулоцитов и моноцитов в активном состоянии [3, 4] посредством воздействия липополисахаридов, пептидогликанов и вирусных лигандов на толл-рецепторный аппарат клеток системы врожденного иммунитета. Результатом активации микроорганизмами макрофагов, гранулоцитов, лимфоцитов и естественных киллеров является запуск цитокинового каскада и реализации воспалительного ответа [5, 6]. Уровень продукции различных цитокинов и чувствительность к иммунотропной терапии характеризуются выраженной индивидуальной вариабельностью, что может быть обусловлено генетической предрасположенностью и, в частности, функциональным аллельным полиморфизмом генов цитокинов [7–9]. В современной научной литературе имеются единичные исследования, посвященные изучению клеточных и молекулярных механизмов в развитии плацентарной недостаточности (ПН). Учитывая неуклонный рост частоты ПН, проблемы прогнозирования и диагностики данной патологии актуальным представляется изучение особенностей функциональной активности нейтрофильного звена врожденного иммунитета, изменений уровня продукции цитокинов и определения полиморфизмов генов цитокинов.
Цель исследования: разработка критериев прогнозирования развития внутриутробной инфекции (ВУИ) у новорожденных на основании комплексного клинико-иммунологического и молекулярно-генетического обследования беременных с ПН.
Материалы и методы исследования
Было проведено проспективное исследование 287 пациенток, выполненное в акушерском обсервационном отделении ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России. Все пациентки были ознакомлены с целью и методами, дали письменное согласие на включение в научное исследование. Критерии включения: ПН, установленная по данным клинического обследования, результатам функциональных методов исследования (нарушение фетоплацентарного кровотока и/или кровотока в венозном протоке и/или усиление кровотока в среднемозговой артерии по данным допплерометрии, задержка развития плода (ЗРП) по данным УЗИ). Критерии исключения: многоплодная беременность, тяжелая экстрагенитальная патология, пороки развития плода.
В зависимости от полученных данных клинико-лабораторного обследования, выставленного диагноза и разработанных критериев включения, пациентки были разделены на две группы (случай-контроль). В 1-ю группу были включены 98 беременных с ПН, во 2-ю – 189 беременных без ПН. После родоразрешения, в зависимости от исхода беременности, пациентки 1-й и 2-й групп были разделены на подгруппы. В подгруппы 1А и 2А вошли пациентки с ВУИ у новорожденных, развившейся в раннем неонатальном периоде и подтвержденной при клинико-лабораторном обследовании, в подгруппы 1Б и 2Б – без реализации ВУИ у новорожденного.
Для проведения иммунологического исследования было отобрано 118 пар образцов венозной крови матерей и пуповинной крови новорожденных.
Учитывая характер проводимого исследования, с целью избежать искажения анализируемых иммунологических параметров пациентки, включенные в иммунологическое исследование, были родоразрешены путем операции кесарева сечения до начала родовой деятельности. Показаниями к операции кесарева сечения у пациенток с ПН стало ухудшение состояния и нарастание тяжести хронической гипоксии плода по данным функциональных методов обследования. Пациентки подгрупп 2А и 2Б были родоразрешены путем операции кесарева сечения по сочетанным показаниям (анатомические особенности таза, миопия высокой степени и др.).
Фагоцитарную активность нейтрофильных гранулоцитов определяли с помощью метода проточной цитометрии с использованием набора PHAGOTEST фирмы «Biotechnology» (Германия). Генерацию активных форм кислорода (АФК) оценивали по люминол-зависимой хемилюминесценции. Определяли уровень спонтанной и индуцированной опсонизированным зимозаном (0,5 мг/мл) продукции АФК в образцах нефракционированной венозной крови матери и пуповинной крови новорожденного. Определение содержания цитокинов в сыворотке крови беременных проводили методом твердофазного иммуноферментного анализа (ELIZA) с использованием наборов «Cytimmune» (CША). Оценку оптической плотности осуществляли на фотометре «Microplate reader Model 550» («Bio Rad», США), при длине волны 495 нм.
У всех 287 пациенток и их новорожденных было проведено исследование распределения аллелей и генотипов следующих полиморфных локусов у матерей и их новорожденных детей: CD14-260 (-159) C>T, интерлейкин (IL)-6 174 C>G, IL-8-251 A>T, IL-10-592 A/C, ESR1: PvuII-397T>C, ESR1: XbaI, TLR9-1486 T>C, IL-1A-889 C>T, IL-1B-31 T>C, TNF-308 G>A, TNF-238 G>A, IL4-590 C>T, IL-4-33 C>T, IL-4R-1902 A>G (Gln576Arg), IL-6R-1510 (1073) A>C (Asp358Ala). Определение замен одиночных нуклеотидов проводили модифицированным методом «примыкающих проб» (adjacent probes, kissing probes), используя оригинальные олигонуклеотиды. Полимеразную цепную реакцию и определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия).
Статистическая обработка данных проводилась с помощью свободно распространяемого программного продукта WINPEPI версии 9.7 (Abramson, J.H. WINPEPI (PEPI-for-Windows): computer programs for epidemiologists. Epidemiologic Perspectives & Innovations 2004, 1:6). Для определения статистической значимости различий применялись точный двухсторонний критерий Фишера и U-тест Манна–Уитни для несвязанных совокупностей. Отношение шансов (OR) приведено с 95% доверительным интервалом (CI).
Результаты исследования
Возраст беременных, включенных в исследование, колебался от 18 до 41 года и составил в среднем 31,4±0,5 и 28,4±0,5 года соответственно по группам. В подгруппах с ПН отмечалось большее количество пациенток старше 36 лет (26,5%), тогда как пациенток от 18 до 23 лет – всего 6,1% (р<0,05).
Анализ структуры экстрагенитальной патологии показал, что у пациенток с ПН достоверно чаще отмечались заболевания ЛОР-органов, в то время как у пациенток с ПН и ВУИ у новорожденных чаще выявлялся хронический пиелонефрит, цистит (p<0,05) и аутоиммунный тиреоидит (p>0,05). Был проведен анализ исходной инфекционно-воспалительной заболеваемости с определением анализа спектра возможных возбудителей. В подгруппах 1А и 1Б достоверно чаще, по сравнению с контролем, встречались хроническое носительство вируса простого герпеса (46,2 и 33,3%), кандидозный вульвовагинит (42,3 и 33,3%) (p<0,05). Уреаплазма достоверно чаще встречалась только в подгруппе 1А (38,5%) (p<0,05).
Была подробно изучена структура гинекологической заболеваемости. В подгруппах 1А и 1Б достоверно чаще встречались хронический эндометрит (23,0 и 13,9%) (p<0,05), в подгруппе 1А– доброкачественные новообразования яичников (16,1%) и эндометриоз (8,1%) (p<0,05), в подгруппе 1Б– хронический сальпингоофорит (25,0%) (p<0,05).
 Так как большинство пациенток, включенных в исследование, были повторнородящими, нами был проведен анализ акушерского анамнеза. В подгруппе 1А достоверно чаще, по сравнению с контролем, встречались самопроизвольные выкидыши (19,2%), бесплодие (26,9%) (p<0,05), беременности, наступившие в результате ЭКО (11,5%) (p<0,05); во 2 А подгруппе – интранатальная гибель плода (8,3%), прерывание беременности до 12 недель (33,3%) (p<0,05).
Так как большинство пациенток, включенных в исследование, были повторнородящими, нами был проведен анализ акушерского анамнеза. В подгруппе 1А достоверно чаще, по сравнению с контролем, встречались самопроизвольные выкидыши (19,2%), бесплодие (26,9%) (p<0,05), беременности, наступившие в результате ЭКО (11,5%) (p<0,05); во 2 А подгруппе – интранатальная гибель плода (8,3%), прерывание беременности до 12 недель (33,3%) (p<0,05).
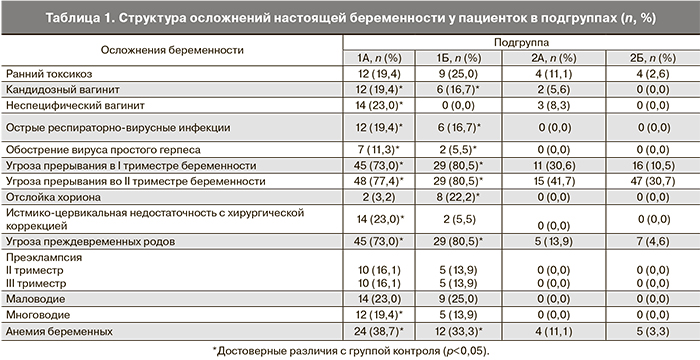
Учитывая разноречивые данные о частоте и структуре осложнений беременности, родов, послеродового периода у пациенток с ПН, был проведен анализ акушерских и перинатальных исходов. Обострение инфекции имелось при ПН с дальнейшей реализацией ВУИ у новорожденных и без такового. Это подтверждает воспалительный характер развития ПН. В то же время только у пациенток подгруппы 1А (ВУИ) отмечались такие проявления, как неспецифический вульвовагинит, истмико-цервикальная недостаточность и многоводие, которые, по-видимому, являются факторами риска реализации ВУИ в большей степени в сравнении с ПН. Однако необходимо проведение дальнейшего исследования. Структура осложнений настоящей беременности у пациенток в исследуемых подгруппах представлена в табл. 1.
В подгруппе 1А 61,5% пациенток были родоразрешены путем операции кесарева сечения, из них по экстренным показаниям – 38,5% (р<0,05). Более чем в половине случаев кесарево сечение выполнялось в связи с ухудшением состояния плода и нарастанием тяжести хронической гипоксии плода. В подгруппе 1Б 75% пациенток были родоразрешены путем операции кесарева сечения, из них по экстренным показаниям 37,5% (р<0,05). При этом у 12,5% пациенток подгруппы 1Б отмечалось преждевременное излитие околоплодных вод (р<0,05). В подгруппе 1А средний гестационный срок, на котором пациентка была родоразрешена, составил 33,6 недели, в подгруппе 1Б – 36,4 недели, тогда как в группе контроля 2Б – 39,3 недели.
Послеродовый период у пациенток подгруппы 1А в 23,1% случаев протекал с осложнениями: диагностировали эндометрит (7,7%) и субинволюцию матки (15,4%) (p<0,05).
Результаты изучения исхода родов для плода и течения раннего неонатального периода у новорожденных показали, что у детей подгруппы 1А достоверно чаще диагностировалась асфиксия (53,2%) и неонатальная желтуха (23,0%) (p<0,05). Анализ структуры врожденной инфекции показал, что в подгруппе с ПН превалировали тяжелые формы: врожденная пневмония (62,0%), сепсис (8%). В то время как при отсутствии ПН регистрировали увеличение частоты малых форм ВУИ (таких как конъюнктивит и везикулез) (44%) и отсутствие диагностированного сепсиса. Таким образом, сочетание ПН и ВУИ приводит к более неблагоприятному прогнозу для новорожденного.
Проводилась оценка уровня продукции АФК фагоцитами крови, являющейся критическим иммунным фактором защиты против микроорганизмов. В образцах венозной крови матерей, индуцированной зимозаном, получено достоверное увеличение продукции АФК в подгруппе 1А (р<0,05), свидетельствующее о высокой активации нейтрофилов и напряженности данного звена иммунного ответа. В образцах пуповинной крови новорожденных, индуцированной зимозаном, мы получили достоверно низкий уровень продукции АФК в подгруппе 1А (р<0,05), что свидетельствовало о функциональном или генетически обусловленном снижении способности новорожденных детей отвечать на инфекцию или воспаление. Данные представлены на рис. 1. Также нами было проведено количественное определение уровня про- и противовоспалительных цитокинов в сыворотке беременных. Были получены данные о достоверном увеличении уровня IL-8 (p=0,038) и IL-6 (р<0,05) в сыворотке крови беременных, родивших детей с последующей реализацией ВУИ. При оценке уровня IL-10 было выявлено его достоверное увеличение в сыворотке крови беременных, родивших детей с последующей реализацией ВУИ (р<0,05), что может косвенно свидетельствовать о длительности воспалительного процесса в организме у данной группы беременных.
Принимая во внимание результаты иммунологического исследования, было проведено изучение распределения однонуклеотидных генных полиморфизмов цитокинов. У матерей с генотипом ТТ в 251 позиции промоторной области гена IL-8 достоверно чаще рождались дети с последующей реализацией ВУИ (OR=2,6 (1,2–5,8), p=0,022). Учитывая данные исследования, свидетельствующие о повышении функциональной активности нейтрофилов и уровня IL-8 в крови матерей, с последующей реализацией ВУИ у их новорожденных, можно предполагать генетически детерминированную предрасположенность к увеличению продукции IL-8 у данного контингента пациенток (рис. 2).
Потенциальным генетическим маркером, ассоциированным с реализацией ВУИ у новорожденного, был полиморфизм проморной области гена IL-10. При исследовании пуповинной крови наличие генотипа IL-10: 592 A/A у ребенка ассоциировалось с ПН и ЗРП (85,7 против 32,6% при других генотипах, OR=12,4 (1,7–89,9), р=0,007). Соответственно чаще наблюдалась хроническая гипоксия плода (71,4 против 17,6%, OR=11,7 (2,5–55,8), р=0,003). Влияния материнского генотипа на возникновение данной патологии выявлено не было.
Учитывая предрасположенность носителей генотипа IL-10: 592 A/A к снижению воспалительного ответа, ожидалось повышение вероятности ВУИ при наличии данного генотипа у ребенка. Указанная тенденция действительно наблюдалась (28,6 против 10,4%), но не достигала статистической значимости (р=0,173). Учитывая приведенные выше данные о связи генотипа А/А с ПН, была проанализирована ассоциация ВУИ, ПН и генотипа IL-10: 592 A/A у ребенка.
Влияние генотипа А/А с ВУИ прослеживалось у детей, рожденных у матерей с ПН, тогда как при отсутствии ПН частота ВУИ оставалась низкой при всех генотипах. При сочетании обоих факторов мы получили статистически значимое повышение вероятности реализации ВУИ у новорожденных (p=0,031, OR=18.9 (1,7–215,2)).
Учитывая данные иммунологического исследования, свидетельствующие о снижении функциональной активности нейтрофилов в пуповинной крови новорожденных, с последующей реализацией ВУИ, можно предполагать, что генетически детерминированное снижение воспалительного ответа является фактором риска ВУИ при ПН, связанной с инфекционными агентами.
Обсуждение
 К факторам риска развития ВУИ у пациенток с ПН следует относить: хронические заболевания мочевыделительной системы (хронический пиелонефрит и цистит) и самопроизвольные выкидыши в анамнезе, истмико-цервикальную недостаточность и многоводие во время данной беременности. Сравнительный анализ акушерских исходов в двух подгруппах (подгруппа 1А – пациентки с ПН и реализацией ВУИ у новорожденных, 1Б – ПН без ВУИ) показал, что обострение инфекции имелось при ПН с дальнейшей реализацией ВУИ у новорожденных и без такового. Это подтверждает воспалительный характер развития ПН. В то же время только у пациенток 1А подгруппы (ВУИ) отмечались такие проявления, как неспецифический вульвовагинит, истмико-цервикальная недостаточность и многоводие, которые, по-видимому, являются факторами риска ВУИ в большей степени, чем ПН. По данным F. Moscuzza и соавт. (2011) ПН, осложняющая беременность, напрямую влияет на прогноз для новорожденного. Во время беременности ПН может служить критерием для ранней диагностики хронической гипоксии плода и подробного мониторинга течения беременности. Ранняя диагностика ПН очень важна для прогнозирования риска развития таких серьезных осложнений для новорожденного, как ретинопатия новорожденных и внутрижелудочковые кровотечения [10]. Ряд авторов выделяют такие факторы риска ПН и ВУИ, как отягощенный акушерско-гинекологический анамнез, патологическое течение беременности, заболевания мочеполовой системы у матери, инфекционные заболевания любых других органов и систем у матери, которые возникают во время беременности [11, 12]. Однако C. Bose и соавт. (2009) указывает на отсутствие корреляции между воспалительными заболеваниями матери и развитием ВУИ и ЗРП [13]. Вероятно, это связано с необходимостью более детального отбора пациенток группы риска и проведением среди них углубленного диагностического поиска.
К факторам риска развития ВУИ у пациенток с ПН следует относить: хронические заболевания мочевыделительной системы (хронический пиелонефрит и цистит) и самопроизвольные выкидыши в анамнезе, истмико-цервикальную недостаточность и многоводие во время данной беременности. Сравнительный анализ акушерских исходов в двух подгруппах (подгруппа 1А – пациентки с ПН и реализацией ВУИ у новорожденных, 1Б – ПН без ВУИ) показал, что обострение инфекции имелось при ПН с дальнейшей реализацией ВУИ у новорожденных и без такового. Это подтверждает воспалительный характер развития ПН. В то же время только у пациенток 1А подгруппы (ВУИ) отмечались такие проявления, как неспецифический вульвовагинит, истмико-цервикальная недостаточность и многоводие, которые, по-видимому, являются факторами риска ВУИ в большей степени, чем ПН. По данным F. Moscuzza и соавт. (2011) ПН, осложняющая беременность, напрямую влияет на прогноз для новорожденного. Во время беременности ПН может служить критерием для ранней диагностики хронической гипоксии плода и подробного мониторинга течения беременности. Ранняя диагностика ПН очень важна для прогнозирования риска развития таких серьезных осложнений для новорожденного, как ретинопатия новорожденных и внутрижелудочковые кровотечения [10]. Ряд авторов выделяют такие факторы риска ПН и ВУИ, как отягощенный акушерско-гинекологический анамнез, патологическое течение беременности, заболевания мочеполовой системы у матери, инфекционные заболевания любых других органов и систем у матери, которые возникают во время беременности [11, 12]. Однако C. Bose и соавт. (2009) указывает на отсутствие корреляции между воспалительными заболеваниями матери и развитием ВУИ и ЗРП [13]. Вероятно, это связано с необходимостью более детального отбора пациенток группы риска и проведением среди них углубленного диагностического поиска.
При ПН в 62,9% случаев наблюдается активация механизмов врожденной иммунной системы. О высоком инфекционном риске для плода свидетельствует сочетание повышенной концентрации IL-8, высокого уровня индуцированной продукции АФК лейкоцитами периферической крови матери и сниженная функциональная активность клеток пуповинной крови, характеризующая слабый противоинфекционный иммунитет ребенка. Полученные результаты частично согласуются с данными о более низкой экспрессии некоторых поверхностных маркеров и фагоцитарной активности фетальных гранулоцитов и моноцитов, по сравнению с клетками взрослых, с чем может быть связана большая чувствительность новорожденных к инфекции [14].
В нашей работе была прослежена зависимость частоты выявления ВУИ у новорожденных детей от наличия полиморфизма IL-8 у их матерей и полиморфизма IL-10 у самих новорожденных в основной группе, что косвенно указывает на самостоятельную возможность плода внутриутробно влиять на течение и исход беременности. Ключевая роль в хематтракции лейкоцитов принадлежит IL-8, под действием которого происходит активация нейтрофилов и их миграция в очаг воспаления. Уникальность IL-8 заключается в том, что, будучи одним из самых ранних медиаторов воспаления, этот цитокин долгое время находится в очаге воспаления [15].
При количественном анализе концентрации IL-8 в периферической крови матерей с различным генотипом выявлено достоверное снижение уровня цитокина при генотипе IL-8-251 А/А (p=0,038). Средний уровень IL-8 составил 0,75 пг/мл по сравнению с 11,6 пг/мл соответственно.
В нашем исследовании только в 40% наблюдений уровень IL-8 был определен количественно, в остальных случаях IL-8 в кровотоке не определялся с помощью используемой тест-системы или его уровень находился ниже линейного диапазона. В связи с этим был проведен качественный анализ – оценена доля пациенток, в крови которых детектировался IL-8. Среди матерей с генотипом A/A IL-8 в кровотоке детектировался в 15,4% наблюдений, тогда как среди носителей аллеля T IL-8 определялся в 45,3% случаев (р=0,065).
Цитокины определяют функциональную кооперацию клеток при реализации реакции воспаления; при этом кооперация клеток может быть как позитивная, так и негативная. Негативное действие на функции нейтрофилов оказывают такие противовоспалительные цитокины, как IL-10, супрессирующий продукцию практически всех провоспалительных цитокинов и нейтрофилокинов, подавляя транскрипцию генов цитокинов воспаления в нейтрофилах [16]. По данным литературы аллель A полиморфизма гена IL-10-592 C>A ассоциирована с повышенным уровнем спонтанной и стимулированной продукции IL-10 мононуклеарами крови, что приводит к снижению интенсивности воспалительной реакции и переключению Th1>Th2 ответа. Ряд авторов указывает на взаимосвязь повышенной частоты аллеля IL10-592 А с тяжестью сепсиса, развитием полиорганной недостаточности и высокой вероятностью летального исхода, что указывает на важный вклад аллельного полиморфизма генов цитокинов в индивидуальные различия больных сепсисом по характеру течения инфекционного процесса и эффективности механизмов протекторного иммунитета [16, 17].
В нашем исследовании у матерей с генотипом А/А уровень IL-10 в сыворотке крови не отличался от такового при наличие аллеля C в генотипе.
Однако при анализе в сыворотке крови уровня IL-6 – мощного провоспалительного цитокина – выявлено снижение его уровня в кровотоке у пациенток с генотипом IL-10-592 A/A (p=0,05). Ряд авторов, исследовавших уровень IL-10 в пуповинной крови, указывают на достоверно более низкий уровень данного противовоспалительного цитокина в кровотоке новорожденных с ЗРП [18, 19]. P. Vural и соавт. (2010), напротив, указали зависимость выявления полиморфизма гена IL-10 с повышением его продукции и развития преэклампсии [20]. Влияние генотипа А/А с ВУИ прослеживалось у детей, рожденных у матерей с ПН (p=0,031, OR=18.9 (1,7-215,2)), тогда как при отсутствии ПН частота ВУИ оставалась низкой при всех генотипах.
Заключение
Полученные данные позволяют использовать ранний генетический скрининг как среди беременных, входящих в группу высокого риска по развитию ПН и реализации ВУИ, так и среди их новорожденных детей. Принципиальной особенностью данного метода является возможность ранней (дородовой) диагностики, что позволяет вовремя провести профилактические мероприятия. Также немаловажно, что исследование крови матери является неинвазивной процедурой для плода. Вышеизложенное определяет диагностическую значимость генетического тестирования для снижения риска инфекционных осложнений у новорожденных и обосновывает перспективность дальнейших исследований в этой области для поиска новых генетических маркеров.



