Микроциркуляция (МЦ) представляет собой фундаментальный процесс, определяющий основную цель функционирования сердечно-сосудистой системы и играющий ключевую роль в трофическом обеспечении тканей и поддержании тканевого метаболизма. Посредством МЦ клетки тканей получают питание и освобождаются от метаболитов в результате меняющегося потока крови, соответствующего потребностям тканей [1–3].
Строение микроциркуляторного русла (МЦР) в различных органах имеет особенности и зависит от функционального предназначения органа, но в целом оно подчинено единым закономерностям. Нарушения МЦ лежат в основе или развиваются вторично при многих заболеваниях. Нарушения МЦ включаются, как важное патогенетическое звено в ряд типических патологических процессов и во многие частные патологические формы различных заболеваний [4].
Состояние МЦ играет ключевую роль для благоприятного завершения беременности, начиная от момента прегравидарной подготовки эндометрия, периода нидации плодного яйца, развития эмбриона и завершается созданием благоприятных условий для развития плода на всех последующих стадиях беременности. Процессы аутогемоделюции, увеличения объема циркулирующей крови, новообразования сосудистого русла, изменения коагуляционного потенциала крови направлены на благоприятный исход беременности, являются важнейшими составляющими состояния МЦ. В свою очередь, изменения реологии крови, активация процессов внутрисосудистого тромбообразования в системе МЦ, нарушение тонуса сосудов с депонированием крови в венулярном компоненте в условиях низкого сосудистого сопротивления и медленного кровотока в плаценте способно привести к неблагоприятному исходу беременности [1, 5, 6].
Метод биомикроскопии сосудов бульбарной конъюнктивы (БМСБК) позволяет открыть информационное «окно» в сосудистую систему организма человека. Данный метод предоставляет возможность прямой оценки многих морфофункциональных параметров и организации МЦР, процессов МЦ и отчасти состояния тканевого окружения [4, 7, 8].
Состояние МЦР изучено в недостаточной степени, как при неосложненном течении беременности, так и при различных видах акушерской патологии.
Целью настоящего исследования явилось: определить состояние основных компонентов МЦР при неосложненном течении беременности и при различных видах акушерской патологии, приводящих к развитию плацентарной недостаточности (ПН).
Материал и методы исследования
В исследование включены 50 беременных с установленным диагнозом суб- и декомпенсированной формы ПН в сроках беременности 28–36 недель, составившие основную группу (ОГ). Диагноз ПН установлен на основании данных ультразвуковго исследования о маловодии и задержке роста плода, данных доплерометрии о нарушении маточно-плацентарного и плодово-плацентарного кровотока, патологических характеристиках при проведении кардиотокографии, мекониального характера вод при проведении амниоскопии в соответствии с клиническими рекомендациями по акушерству Российского общества акушеров-гинекологов [9]. На основании предполагаемого генеза ПН из числа женщин ОГ выделены подгруппы. В подгруппу ОГ-I вошли 24 беременные с развитием ПН в связи с тромбофилией. Беременные ОГ-I имели факторы высокого тромбогенного риска, установленные на основании данных личного и семейного анамнеза, результатов обследования на предмет генетических и приобретенных форм тромбофилии, имели в период постановки диагноза ПН характерные изменения в показателях системы гемостаза.
К критериям тромбофилии были отнесены: наличие антифосфолипидного синдрома, мутации фактора V Лейден, протромбина, гипергомоцистеинемия, их комбинации или комбинации с полиморфизмом генов; три гомозиготные формы полиморфизма генов или более; пять гетерозиготных форм полиморфизма генов или более [10].
Подгруппу ОГ-II составили 26 беременных с установленным диагнозом ПН в связи с развитием тяжелой преэклампсии. Дополнительно нами обследованы 30 беременных в аналогичные сроки беременности, сопоставимые по возрасту с женщинами ОГ, с неосложненным течением беременности и ее благоприятным исходом, составившие группу сравнения (ГС). В качестве контроля (КГ) исследование проведено у 20 небеременных после завершения менструации без использования гормональной контрацепции. Женщины КГ сопоставимы по возрасту и соматическому статусу с беременными ОГ и ГС. Критериями исключения служили: тяжелая соматическая патология; инфекционное осложнение беременности; сахарный диабет.
Исследование МЦ проводили методом БМСБК на аппаратно-диагностическом комплексе, состоящем из щелевой лампы ЩЛ-2Б, обеспечивающей визуализацию МЦР конъюнктивы и видеокамеры. Полученные данные обрабатывались с помощью системы анализа видеороликов «ЭПОС МЦ» с последующей автоматической обработкой параметров показателей МЦ [4]. При проведении БМСБК в условиях 96-кратного увеличения определяли следующие параметры МЦ: диаметры артериол (dA в мкм), венул (dV в мкм); артериовенозное отношение (A/V); количество капилляров на единицу площади конъюнктивы (кап/мм2); признаки агрегации в артериолах, венулах и капиллярах (в баллах); скорости кровотока в артериолах, венулах и капиллярах (мм/с). Неинвазивный характер метода позволял использовать его многократно с целью выявления признаков тромботической готовности, к которым относили нарушение венозного оттока в МЦ и признаки агрегатного состояния форменных элементов крови [11]. Фиксация результатов исследования на видеоролик позволяла в режиме реального времени проводить сравнительный анализ при многократном исследовании у каждой беременной.
Статистическую обработку данных производили с использованием статистического пакета программ Statistica 7.0 и Microsoft Excel 2010. В сравниваемых группах вычисляли среднюю арифметическую (М), среднюю ошибку средней арифметической (±m). Для сравнения групп использовали t-критерий Стьюдента, F-критерий Фишера и степень вероятности (p). Различия между сравниваемыми величинами признавали статистически достоверными при уровне значимости p<0,05. Анализ взаимной зависимости признаков проводили с использованием коэффициента ранговой корреляции Спирмена.
Результаты исследования
Установлено, что к третьему триместру течения беременности у женщин ГС относительно КГ происходят значимые изменения артериовенозных взаимоотношений и частичные структурные изменения микрососудов с возрастанием собирательного звена МЦР (табл.).
Присутствуют признаки гипердинамических циркуляторных изменений МЦ, преимущественно функционального характера. Повышение тонуса артериол (p<0,001) сопряжено с увеличением скорости кровотока, как в приводящем, так и в отводящем звене МЦР. Отмечаются первые признаки повышения агрегационной активности форменных элементов крови (рис. 1).
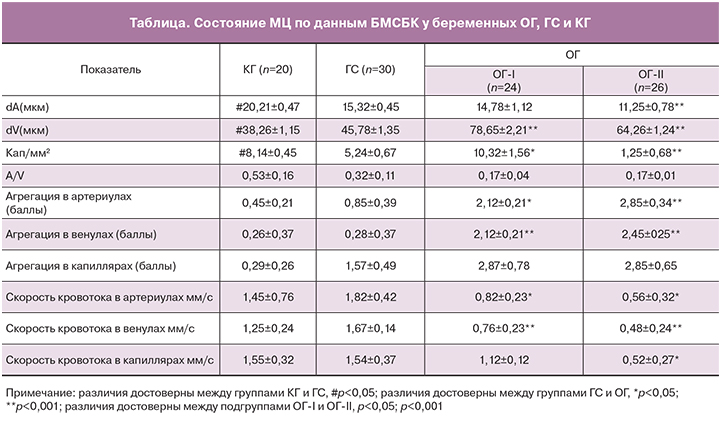
 В подгруппе ОГ-I относительно женщин ГС отмечены признаки выраженного нарушения МЦР (таблица). На фоне нормативных показателей центральной гемодинамики в МЦ отмечается тенденция к уменьшению диаметра приносящего сосуда с выраженным увеличением диаметра венул (p<0,001), уменьшение скорости кровотока, как в артериолах (p<0,05), так и в венулах (p<0,001), что на фоне выявленного у женщин ОГ-I повышения агрегационной активности клеток крови во всех звеньях МЦР способно привести к развитию тромботической ситуации в МЦ (рис. 2).
В подгруппе ОГ-I относительно женщин ГС отмечены признаки выраженного нарушения МЦР (таблица). На фоне нормативных показателей центральной гемодинамики в МЦ отмечается тенденция к уменьшению диаметра приносящего сосуда с выраженным увеличением диаметра венул (p<0,001), уменьшение скорости кровотока, как в артериолах (p<0,05), так и в венулах (p<0,001), что на фоне выявленного у женщин ОГ-I повышения агрегационной активности клеток крови во всех звеньях МЦР способно привести к развитию тромботической ситуации в МЦ (рис. 2).
Микрососуды в условиях нарушения оттока крови вследствие изменения реологии крови и агрегации форменных элементов крови превращаются в пассивные проводники крови. В итоге перераспределение потоков крови в тканях не соответствует функциональной потребности клеток в различных зонах, а происходит в соответствии с теми анатомическими отношениями, которые определяют сопротивление кровотоку, то есть преимуществом обладают микрососуды с большим диаметром, меньшим числом узлов ветвлений, меньшей протяженностью или более пологим углом ответвления.
В силу указанных морфофункциональных особенностей, в эти микрососуды поступает большая часть потока крови и в них появляются признаки стаза. Обращает внимание в ОГ-I значимое увеличение площади капиллярной сети (p<0,05), что на начальных этапах может иметь компенсаторный характер, но в условиях выраженного ограничения скорости кровотока в венулярном компоненте (p<0,001) и повышения агрегационной активности клеток крови (p<0,001) способно привести к шунтированию кровотока в МЦ. В дальнейшем движение крови происходит по меньшей части капилляров, «обкрадывая» соседние области микрорегиона в метаболическом отношении.
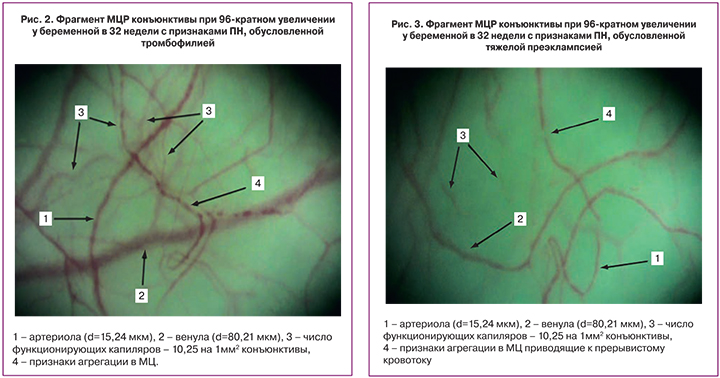
Наиболее выраженные изменения МЦР отмечены при ПН, обусловленной развитием тяжелой преэклампсии (подгруппа ОГ-II). На фоне спастического состояния приносящего звена МЦР (p<0,001), реактивной перестройки венул (p<0,001), уменьшении (A/V) отношения в 1,9 раза отмечаются признаки тяжелой степени недостаточности МЦ (табл.). Уменьшение плотности функционирующих капилляров (p<0,001), то есть рарефикация или разрежение капиллярной сети сокращает суммарную площадь функционирующих сосудов в 4 раза, повышает сосудистое сопротивление, служит причиной неадекватной перфузии, ведущей в ишемии органов и тканей (рис. 3).
Максимальные проявления агрегационной активности форменных элементов крови во всех звеньях МЦР происходят на фоне более чем трехкратного ограничения скорости кровотока во всех звеньях МЦР, что способствует развитию органной дисфункции/недостаточности. Только у женщин ОГ-II отмечены периваскулярные изменения, характеризующиеся мутным фоном конъюнктивы вследствие отека и возникновением отдельных геморрагий.
При проведении корреляционного анализа нами установлена сильная прямая связь между диаметром венул и агрегацией форменных элементов крови: в артериолах (r=+0,75) и в венулах (r=+0,87) в ОГ-I; в артериолах (r=+0,85) и в венулах (r=+0,72) в ОГ-II.
Обсуждение
Результаты проведенного исследования позволяют акцентировать внимание на состоянии МЦР, как в период адаптации к беременности, так и в период развития патологии беременности, приводящей к ее неблагоприятному результату, как для матери, так и для плода.
Выявленные изменения в состоянии МЦР в ГС относительно КГ в полной мере соответствуют гипердинамической форме нарушений МЦ [1, 4]. Данные изменения отражают преимущественно функциональные, обратимые сдвиги в МЦ, не приводящие к микроциркуляторной недостаточности. Изменения МЦР объяснимы с точки зрения понимания процессов адаптации МЦ к новым условиям гемодинамики при беременности, связанным с процессами аутогемоделюции, приводящей к увеличению объема циркулирующей крови, изменению реологии крови, уменьшению периферического сопротивления кровотоку в условиях увеличенного коагуляционного потенциала крови и снижения фибринолитической активности [1].
У беременных с клиническими проявлениями ПН, обусловленными тромбофилией (подгруппа ОГ-I) нами выявлены признаки атонической формы нарушений МЦ, что на начальном этапе может отражать преимущественно функциональный характер поражения МЦР [4]. В ходе проведения БМСБК у данной категории беременных установлены признаки тромботической готовности в системе МЦ, характеризующиеся проявлениями венозного застоя на фоне агрегатного состояния форменных элементов крови во всех звеньях МЦР. В условиях медленного кровотока, выявленного, как в приводящем, так и в отводящем звеньях МЦР способны привести к развитию тромботической микроангиопатии и всех ее фатальных последствий [10–14].
При исследовании состояния МЦР у беременных с клиническими проявлениями ПН, обусловленными развитием преэклампсии (подгруппа ОГ-II) нами установлены спастико-атоническая и ишемическая формы нарушений МЦР, отражающие структурно-функциональные и, как правило, необратимые нарушения МЦР, ведущие к микроциркуляторной недостаточности [4, 15–19]. В ОГ-II признаки нарушения МЦР в полной мере характеризуют проявления системного поражения сосудов в МЦ. Наряду со значительным повышением тонуса приводящего сегмента МЦР отмечается выраженное расширение венулярного компонента, высокая агрегационная активность форменных элементов крови на фоне медленного кровотока во всех сегментах МЦ. В отличие от показателей ОГ-I, отмечается критическое ограничение площади функционирующих капилляров, признаки высокой проницаемости и ломкости сосудистой стенки.
В ОГ-I нарушение МЦ с признаками развития тромботической готовности в МЦР носят обратимый характер, поскольку все изменения связаны с нарушением коагуляционного звена системы гемостаза, что с успехом корригируется при проведении антикоагулянтной терапии [9, 10, 20, 21]. В ОГ-II нарушения МЦ носят критический характер, а готовность к тромботической ситуации является вторичной, обусловленной глубоким поражением эндотелия сосудов, при котором единственно обоснованным является своевременное родоразрешение. Пролонгирование беременности при подобном состоянии МЦР способно привести к необратимой структурно-дегенеративной форме с органическими признаками нарушения МЦ [10, 22].
Заключение
Полученные данные соответствуют представлениям о патогенетических механизмах развития различных форм ПН, обосновывают целесообразность проведения антикоагулянтной терапии при тромбофилии во время беременности и подтверждают нецелесообразность пролонгирования беременности при тяжелой преэклампсии.
Выявленные особенности состояния МЦР могут быть использованы в диагностике на различных стадиях развития плацентарных проблем, способствовать выбору рационального ведения беременной для достижения благоприятного результата, как для матери, так и для плода. Неинвазивный характер метода позволяет рекомендовать его к многократному использованию, а фиксация данных на видеоролик – сравнивать в динамике полученные результаты.



