В настоящее время основной причиной неонатальной заболеваемости и смертности во всем мире являются преждевременные роды [1]. В общем числе младенческой смертности доля недоношенных детей составляет не менее 70% [2]. Несмотря на большое число выполненных научных и клинических исследований и значимые достижения в понимании молекулярных основ физиологии этой патологии, число преждевременных родов во всем мире остается стабильно высоким [3].
Роль воспалительных факторов в патогенезе физиологической и осложненной беременности широко обсуждается в современной литературе. Известно, что беременные с привычным выкидышем (ПВ) в анамнезе или угрожающим выкидышем (УВ) во II и III триместрах беременности чаще развивают такие плацента-ассоциированные осложнения, как плацентарная недостаточность, задержка роста плода, что нередко заканчивается элективным досрочным родоразрешением и преждевременными родами [4–6].
Ведущая роль воспаления в индукции целого ряда осложнений беременности была показана в 2016 г. в исследовании, выполненном группой авторов из Канады, Великобритании и США [7]. В работе интернационального коллектива было продемонстрировано, что появление в крови беременных провоспалительного фактора, ассоциированного с повреждением клеточных структур митохондриального происхождения (ПФМП), приводит к плацентарным нарушениям и задержке роста плода. Интересно, что в генезе задержки роста плода, преэклампсии, преждевременных родов описано не только воспаление, обусловленное инфекционными агентами, но и асептическое воспаление в результате воздействия ПФМП или аларминов (эндогенные активаторы воспаления), одним из которых является мочевая кислота [8, 9].
Было показано, что ассоциированный с введением кристаллов этого вещества механизм воспаления реализуется через интерлейкин-1 и вызывает не только асептическое воспаление, но также апоптоз клеток плаценты и ее дисфункцию, приводя к задержке роста плода.
Известно, что факторы риска развития преждевременных родов неспецифичны, и в патофизиологии преждевременных родов важное место занимает переход от противовоспалительного состояния системы врожденного иммунитета к провоспалительному [10, 11].
Позднее было показано, что важную роль в каскаде реакций, приводящих к развитию воспаления неинфекционного генеза, играют протеолипиды и пептидные фрагменты митохондриальных мембранных белков, содержащие на N-конце остаток формилметионина, сходные по своей иммуностимулирующей активности с бактериальными белками [12, 13].
При физиологической беременности (ФБ) по мере увеличения гестационного срока нарастает дисбаланс окислительно-восстановительных реакций в плаценте. Один из фундаментальных механизмов биохимической адаптации элементов функциональной системы «мать-плацента-плод» к изменяющимся в ходе беременности условиям основан на регулируемой генерации активных форм кислорода (АФК) [14, 15]. Несмотря на актуальность проводимых исследований, многие вопросы, связанные с развитием дисфункции плаценты в условиях окислительного стресса, еще весьма далеки от разрешения [16, 17]. В связи с этим в современных публикациях все чаще обсуждается молекулярный состав факторов асептического воспаления, попадающих в периферический кровоток при повреждении клеток и тканей при осложнениях, ассоциированных с нарушением баланса окислительно-восстановительных реакций [18–20].
Вследствие наличия в своей структуре вышеупомянутых особенностей ПФМП являются наиболее сильнодействующими иммунологическими активаторами, вызывающими асептическое воспаление. Эти молекулы распознаются специфическими рецепторами, широко представленными на поверхности клеток эндотелия. Согласно последним данным, ПФМП могут вызвать генерализованные изменения сосудов с помощью механизмов, связанных с активацией эндотелия [7]. Среди последних, как наиболее активные в плане индукции воспаления, выделяют такие ПФМП, как митохондриальная ДНК (мтДНК), белок TFAM (mitochondrial transcription factor A), аденозинтрифосфат (АТФ), кислые липиды митохондриальных мембран и др. [8, 10].
Помимо вышеуказанных, одним из перспективных потенциальных ПФМП является белок ОРА1 (protein optic atrophy 1), ответственный за слияние митохондрий после прохождения процедуры контроля качества этой органеллы. Белок ОРА1 участвует в защите клетки от апоптоза, в регуляции уровня кальция, а также с высоким родством связывается с мтДНК. Этот белок состоит из двух доменов: трансмембранного и внешнего, обращенного в межмембранное пространство митохондрий [11].
В результате проведенных многочисленных исследований к настоящему времени известно, что с увеличением срока гестации в синцитиотрофобласте возрастает количество митохондрий, что может привести к увеличению вклада электроннотранспортной цепи митохондрий плаценты в образование АФК, играющих роль триггеров родов [21–23].
Учитывая основополагающую роль митохондрий в физиологическом развитии беременности и патогенетическую значимость митохондриальной дисфункции при осложненном течении беременности, особую актуальность приобретает разработка неинвазивных методических подходов оценки состояния митохондрий плаценты в норме и при патологии во II триместре беременности.
Цель исследования: изучить динамику ПФМП – белков OPA1 и TFAM в периферической крови женщин с УВ, ПВ и при ФБ.
Материалы и методы
В настоящее проспективное исследование были включены 89 беременных, которые составили 3 группы. Первую группу составили 32 беременные женщины с ПВ, т.е. с наличием двух и более самопроизвольных прерываний беременности от одного и того же партнера. Во 2-ю группу включены 29 пациенток с УВ без отягощенного акушерского анамнеза. В состав 3-й группы вошли 28 пациенток, чья беременность протекала без осложнений (ФБ), родоразрешенных в доношенном сроке беременности.
Пациентки трех групп были включены в исследование при сроке беременности 6–7 недель от первого дня последней менструации после подтверждения сердцебиения эмбриона по данным ультразвукового исследования. Критериями включения являлись: возраст женщин от 20 до 40 лет; самопроизвольное наступление беременностей (отсутствие бесплодия); отсутствие выраженных гормональных нарушений, регулярный менструальный цикл; отсутствие анатомических причин УВ, подписанная пациенткой форма информированного согласия на проведение исследования.
У пациенток группы УВ на момент включения в исследование были проявления УВ (кровяные выделения из половых путей, ретрохориальная гематома). Пациентки были госпитализированы в стационар, где проводилась терапия, направленная на пролонгирование беременности, включающая гестагенные (дидрогестерон 40 мг в сутки), спазмолитические и гемостатические препараты (антифибринолитик – транексамовая кислота). При возникновении признаков угрожающих преждевременных родов пациентки госпитализировались в стационар – 2-е акушерское отделение патологии беременности ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России, где проводилась терапия, направленная на пролонгирование беременности, включавшая внутривенный токолиз, профилактику респираторного дистресс-синдрома плода, мониторинг показателей ультразвуковой фетометрии и допплерометрии. При критических изменениях в состоянии плода проводилось досрочное родоразрешение (в 4 наблюдениях).
Группу ФБ составили женщины с физиологическим течением беременности, неотягощенным акушерским анамнезом, подписавшие информированное согласие на проведение исследования. Ведение беременности и родоразрешение женщин контрольной группы проводились в условиях Центра.
Критериями исключения во всех трех группах были: многоплодная беременность, наличие онкологических, тяжелых экстрагенитальных, системных аутоиммунных заболеваний.
У беременных исследуемых групп забор крови для проведения исследования выполнен 10 раз на сроках 6, 9, 12, 15, 18, 21, 25, 29, 33, 37 недель беременности.
Специальные методы исследования
Для определения уровня ПФМП у пациенток исследуемых групп проводили фракционирование венозной крови, выделение микровезикул из полученной плазмы и методом Вестерн-блот анализировали содержание митохондриальных белков.
Забор крови проводился натощак из локтевой вены у беременных по стандартной методике в пробирку с этилендиаминтетраацетатом (ЭДТА). Плазму крови получали методом осаждения форменных элементов крови в течение 10 минут при 3000 g, 4°С на центрифуге Eppendorf 5410R (США). Определение содержания белка в плазме крови проводили биуретовым методом. Микровезикулы плазмы крови получали при помощи двукратного центрифугирования – 30 минут при 10 000 g, 4°С на центрифуге Centrifuge 5430R (США). Осадок ресуспендировали в буфере нанесения для электрофореза.
Определение содержания белков OPA1, TFAM и VDAC1 (норма/контроль) в осадке микровезикул плазмы крови проводили методом иммунодетекции после разделения белков электрофорезом в денатурирующих условиях по методу Лэммли в системе Biorad MiniProtean (США) и последующего переноса белков на нитроцеллюлозную мембрану методом Вестерн-блот. Первичные антитела, выработанные против определяемых белков в мыши (Abcam, США), использовали в соответствии с рекомендациями производителя. Для проявления первичных антител использовали вторичные антитела к мышиным IgG, конъюгированные с пероксидазой хрена, и биолюминесцентную систему визуализации ChemiDOC (Biorad, США). Определение идентифицированных компонентов ПФМП в полосе соответствующего молекулярного веса полипептидов на нитроцеллюлозной мембране проводили при помощи системы Geldoc (США) с нормировкой на VDAC.
Статистический анализ
Анализ полученных результатов проводили с помощью программы GraphPad Prism 8.0.
Для оценки клинико-анамнестических данных для каждой выборки проводили оценку нормальности распределения с помощью критерия Шапиро–Уилка. Нормальный характер распределений позволил анализировать полученные результаты с помощью методов дисперсионного анализа (ANOVA). В случае достоверного влияния выбранных факторов или их взаимодействия проводили последующий post hoc анализ с использованием критерия Тьюки. Данные в таблице представлены в виде среднего и стандартного отклонения (ср. (ст. откл.)).
Сравнение долей при оценке исходов беременности проводили с помощью теста χ2 на независимость.
Межгрупповые различия динамических показателей (относительное содержание исследуемых белков) оценивались с помощью метода ограниченного максимального правдоподобия (ОГМП; Restricted maximum likelihood (REML)) с последующим применением критерия Тьюки. Данные на рисунках представлены в виде медианы и интерквартильного размаха. Отличия считали достоверными при p<0,05.
Результаты
Данные клинико-анамнестического анализа женщин исследуемых групп представлены в таблице 1.
Как следует из представленных в таблице 1 данных, женщины исследуемых групп не отличались по возрасту и индексу массы тела (ИМТ). Отличия в числе беременностей и выкидышей обусловлены критериями включения в группы. Отличия в числе беременности и родов были отмечены в группе ПВ по сравнению с УВ и ФБ (р<0,001) (табл. 2).
Были проанализированы исходы беременностей и частота развития плацентарной недостаточности у женщин исследуемых групп (табл. 3). Оказалось, что наибольшее число преждевременных родов отмечалось в группе УВ – в 27,5% случаев, как и частота плацентарной недостаточности – в 10,0% случаев, потребовавших досрочного оперативного родоразрешения. Своевременные роды в этой группе отмечены в 72,5%. В группе ФБ во всех случаях роды произошли своевременно, лишь в 1 случае отмечалось рождение маловесного новорожденного. У женщин I группы под действием проводимой терапии удалось доносить беременность до срока своевременных родов в 87,5% наблюдений, в 12,5% случаях произошли преждевременные роды. Досрочное оперативное родоразрешение, обусловленное плацентарной недостаточностью, отмечено в 3,0% наблюдений.

Результаты анализа для белка OPA1 с применением метода ОГМП (REML) представлены в таблице 4. Было выявлено значимое влияние фактора «Неделя» и взаимодействие факторов «Неделя» × «Группа», что свидетельствует о сложном характере динамических изменений белка OPA1 в течение осложненной и ФБ.
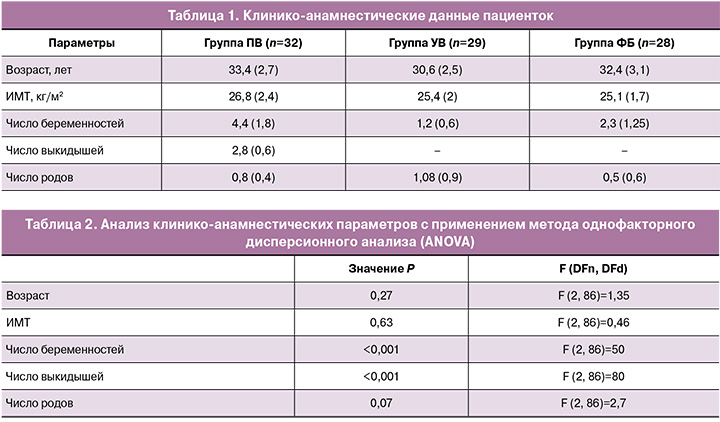
Оценка внутригрупповых различий показала, что в группе женщин с ФБ пик содержания OPA1 в микровезикулах плазмы крови приходится на 37-ю неделю. Статистически значимые отличия (p<0,05) от данного срока наблюдались на 6–12, 18–21 и 29-й неделях в группе ФБ. В группе УВ пик содержания OPA-1 наблюдался на 18-й неделе, и статистически значимые отличия от данной временной точки были отмечены на 9-й и 12-й неделях (p<0,01). В группе ПВ максимальное содержание OPA-1 было показано на 12-й неделе, содержание белка в данной временной точке было значимо выше (p<0,01), чем на 6–9-й и 15–33-й неделях (рис. 1).
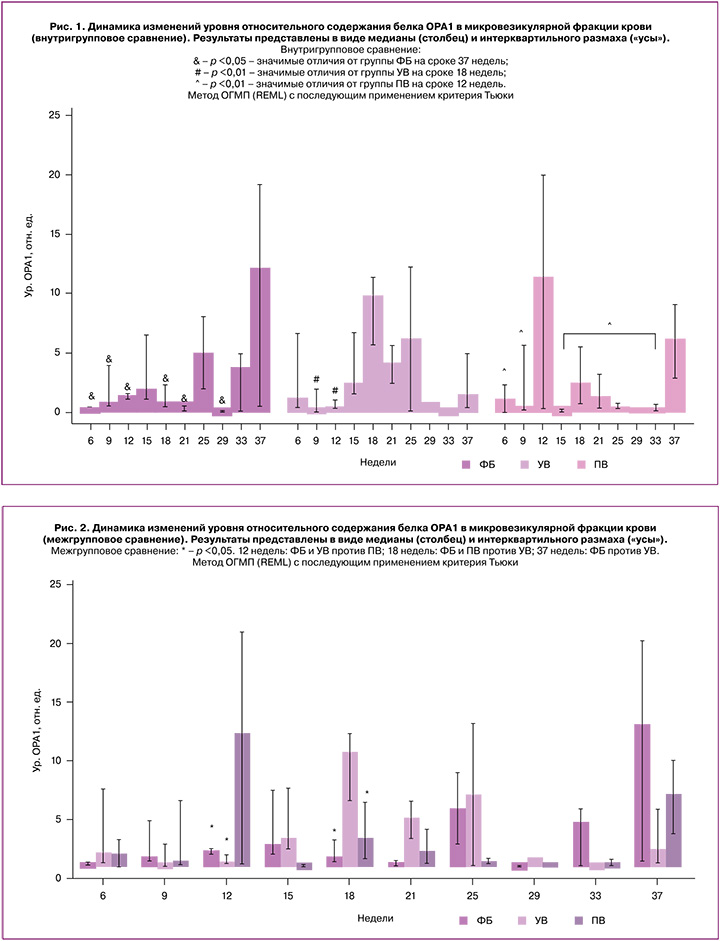
Оценка межгрупповых различий показала достоверное увеличение уровня относительного содержания OPA1 на 12-й неделе в группе ПВ, по сравнению с группой ФБ и УВ (p<0,001). Пик содержания данного белка в группе УВ при этом приходится на 18-ю неделю беременности, и данный результат значимо выше по сравнению с группой ФБ и ПВ (p<0,007). При ФБ содержание OPA1 на 37-й неделе значимо выше по сравнению со значениями в группе УВ (p=0,006) (рис. 2).
Результаты анализа для белка TFAM с применением метода ОГМП (REML) представлены в таблице 5.
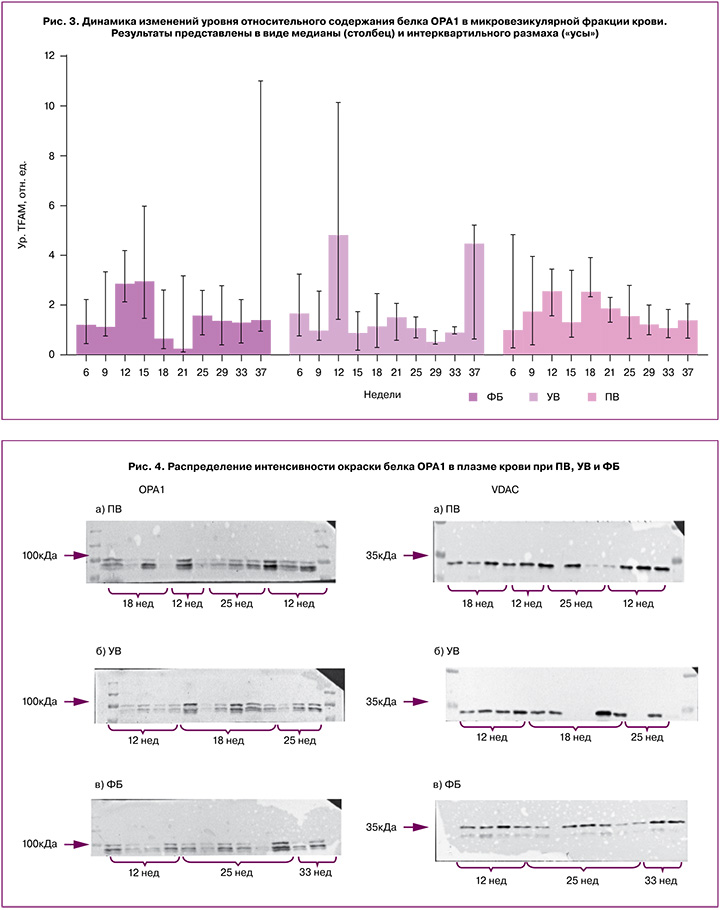
Было выявлено значимое влияние фактора «Неделя» на содержание белка TFAM в микровезикулярной фракции крови женщин исследуемых групп, при этом фактор «Группа» и взаимодействие факторов «Неделя» × «Группа» не оказали влияния на уровень белка TFAM. Таким образом, для данного белка характерны динамические изменения в течение беременности, на которые не оказали влияния акушерские осложнения (рис. 3).
Обсуждение
Разнонаправленность уровня ОРА1 на разных сроках гестации отражает различное состояние плаценты в норме и при плацентарной недостаточности. Если на ранних сроках гестации блокировать или в значительной степени ингибировать процесс отбора митохондрий, то в клетках плаценты будут накапливаться поврежденные митохондрии, потенцирующие состояние окислительного стресса с последующей индукцией апоптоза клеток плаценты. Нарастающая дисфункция плаценты приводит к терминации либо осложнению течения беременности. На раннем этапе беременности в норме мы наблюдали низкий уровень этого белка в секретоме матери (1,79 (0,38)), контролирующем состояние плаценты, а при ПВ – резкое повышение этого белка, приводящее к снижению эффективности системы элиминации поврежденных митохондрий (8,86 (5,08)) – источников АФК на фоне экзогенного окислительного стресса, ассоциированного с воспалением (рис. 4).
Обратная ситуация имеет место на 25-й неделе гестации, когда вследствие старения клеток плаценты априори качество митохондрий снижается, и даже в норме необходимо понизить барьерный уровень отбора митохондрий, что и приводит к росту OРА1. Высокий уровень повреждения при низком уровне ОРА1 при ПВ (0,73 (0,19)), в отличие от ФБ (7,79 (3,33)), способствует элиминированию массы митохондрий и резкому падению энергообеспеченности плаценты и способности к транспорту нутриентов. Нами были зарегистрированы статистически значимые различия в уровнях ОРА1 при ФБ, УВ и ПВ. При этом если на ранних этапах беременности максимальные значения были отмечены в группе ПВ, в 18 недель – в группе УВ, то на сроке 37 недель беременности – в группе ФБ.
Общепризнано, что преждевременные роды ассоциированы с системным воспалительным ответом, который, как известно, сопровождается дисбалансом окислительно-восстановительных реакций, приводящим к нарушениям как на клеточном, так и субклеточном уровнях, подъему уровня апоптоза в плаценте, следствием чего является развитие плацентарной недостаточности [24].
Клиническая значимость асептического воспаления при преждевременных родах была определена в работе, проведенной R. Romero et al., посвященной изучению возможности определения воспалительных маркеров в амниотической жидкости при преждевременных родах, ассоциированных с разрывом плодных оболочек [25]. Интересно, что преждевременные роды у женщин с асептическим воспалением были отмечены на тех же гестационных сроках и сопровождались острыми воспалительными изменениями в плаценте и неблагоприятными неонатальными исходами с той же частотой, что и у женщин с воспалением, обусловленным микроорганизмами.
Полученные нами результаты наглядно демонстрируют, что на ранних сроках беременности отмечены статистически значимые различия в маркерах асептического воспаления у женщин с УВ и ПВ. Если у женщин с ПВ пик уровня белка ОРА1 приходится на срок 12 недель, что статистически значимо отличается от показателей в обеих группах – УВ и ФБ, то впоследствии, под действием проводимой терапии гестагенами, происходит снижение данного показателя, который до 37 недель держится на уровне, соответствующем ФБ. В группе УВ без отягощенного акушерского анамнеза терапия гестагенами носит кратковременный характер, и пик воспалительных маркеров приходится на срок беременности 18 недель.
В литературе отсутствуют сведения как о структурных особенностях, так и о соотношении систем образования и элиминации АФК в митохондриях клеток разных функциональных зон плаценты при физиологическом и осложненном течении беременности. При этом к настоящему моменту накоплено большое количество экспериментальных данных, позволяющих обосновать представления о ведущей роли митохондрий в генерации АФК в клетке [26, 27].
В работах [15, 28] было показано, что повышенная продукция АФК в митохондриях плаценты может привести к истощению отдельных звеньев антиоксидантной защиты и к развитию системного нарушения баланса окислительно-восстановительных реакций в клетках, сопровождающегося нарастанием клеточной гибели (апоптоза и некроза синцитиотрофобласта) и развитием плацентарной недостаточности, приводящей к невынашиванию беременности.
К 25 неделям маркеры асептического воспаления плацентарного происхождения у женщин с ПВ, вероятно, не достигают значений, характерных для ФБ. По-видимому, резервные возможности плаценты при ПВ и УВ определяются более узким диапазоном адаптивного ответа при неосложненной беременности. Провоспалительное состояние, соответствующее ФБ в сроке 25 недель, было описано в предыдущих исследованиях. Так, содержание NK-клеток с фенотипом CD3-CD16+ у женщин с ФБ в 25 недель было достоверно выше, чем у беременных с ПВ, как и уровни CD200+-клеток [29]. Не вполне ясно, какая эволюционная задача продиктовала необходимость провоспалительных изменений именно в данном гестационном сроке – 25 недель. Мы предполагаем, что в это время происходят обусловленные началом интенсивного роста плода структурные изменения плаценты, сопровождающиеся повышением порога качества и функционального состояния митохондрий, что приводит к селективному отбору и разрушению значительной части митохондрий и к выбросам в системный кровоток митохондриальных белков OРА1. Дисрегуляция описанных процессов и повышение порога отсечки приводит к критично высокому уровню селекции и элиминации митохондрий при низком уровне ОРА1. При ПВ это способствует снижению массы митохондрий и резкому падению энергообеспеченности плаценты, что создает условия формирования плацентарной недостаточности. Именно поэтому, как мы полагаем, зарегистрированы статистически значимые различия в уровнях ОРА1 при ФБ, УВ и ПВ.
Заключение
Разнонаправленность уровней ПФМП уже на ранних сроках гестации отражает различное состояние формирующейся плаценты при физиологической и осложненной беременности, что создает предпосылки для развития плацентарной недостаточности у женщин с УВ и ПВ. Дальнейшие исследования в данной области позволят разработать неинвазивные методы оценки состояния плаценты, измерять интенсивность провоспалительного ответа, прогнозировать осложнения беременности и проводить мониторинг эффективности терапии.



