Вспомогательные репродуктивные технологии (ВРТ) в лечении как мужского, так и женского бесплодия занимают важное место, к 2022 г. в мире рождены более 6,5 млн детей после экстракорпорального оплодотворения и переноса эмбриона в полость матки [1–3]. Такое увеличение темпов применения ВРТ вызвано социально-экономическими и экологическими причинами, которые часто связаны с развитием бесплодия в позднем репродуктивном возрасте. При этом эффективность лечения во всех странах за последние десятилетия кардинально не изменилась, частота наступления беременности составляет 30–35% на перенос эмбрионов в полость матки. Решение проблемы бесплодного брака путем повышения частоты наступления беременности и имплантации возможно только с помощью фундаментальных научных проектов, изучающих особенности репродукции человека и влияние на фертильность различных эндогенных и экзогенных факторов. Одним из таких факторов, как было установлено, является окислительный стресс (ОС), который негативно влияет на результаты программ лечения бесплодия методами ВРТ.
Недавние исследования показывают, что повышенная продукция активных форм кислорода (АФК) – фактор, который влияет на женскую репродуктивную функцию [4]. Избыток в организме АФК или дефицит антиоксидантов приводит к возникновению ОС. Известно, что АФК являются побочными продуктами нормального метаболизма, при этом доказано, что при физиологических концентрациях они оказывают положительное воздействие на различные процессы в организме, в том числе на нормальное развитие и функционирование половых клеток [5]. Повышенное содержание АФК в организме обладает повреждающим действием, приводя к ухудшению качества клеточного материала и, как следствие, снижению частоты оплодотворения при дисбалансе АФК и общей антиоксидантной способности (ОАС) [6].
Роль ОС продемонстрирована в патогенезе различных заболеваний, при этом его влияние на процессы фолликулогенеза и оогенеза на сегодняшний день изучены недостаточно [7]. Имеется ряд исследований с противоречивыми результатами, посвященных влиянию ОС на репродуктивную функцию женщин, в основном сосредоточенных на микросреде развивающихся ооцитов, а именно на уровнях АФК и антиоксидантов в фолликулярной жидкости [8–12].
Фолликулярная жидкость представляет собой жидкость, окружающую ооцит в фолликуле яичника. В состав фолликулярной жидкости входят стероидные гормоны, цитокины, ферменты, электролиты, различные аминокислоты, липиды, факторы роста, активные формы кислорода и антиоксиданты (супероксиддисмутаза, каталаза, глутатионпероксидаза и глутатионредуктаза, а также жиро- и водорастворимые антиоксиданты, такие как витамины A, C, E и глутатион). Исследование фолликулярной жидкости является доступным субстратом для оценки различных биохимических показателей качества ооцита.
Целью настоящей работы являлась оценка уровня АФК и ОАС в периферической крови и фолликулярной жидкости у пациенток с различными типами бесплодия.
Материалы и методы
В проспективное исследование были включены 65 пациенток в возрасте 21–38 лет с сохраненным овариальным резервом по данным гормонального профиля (уровень антимюллерова гормона (АМГ) >1,2 нг/мл) и ультразвукового исследования, обратившихся для лечения бесплодия в период с 2020 по 2021 гг. в отделение вспомогательных технологий в лечении бесплодия им. проф. Б.В. Леонова ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России. У всех пациенток отсутствовали противопоказания для начала овариальной стимуляции и программы ВРТ, также от каждой супружеской пары было получено письменное информированное добровольное согласие на участие в исследовании. Все включенные в работу пациентки были обследованы в соответствии с Приказом Минздрава России №803н от 31 июля 2020 г. «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению». Овариальная стимуляция проводилась по протоколу с антагοнистами гонадοтропин-рилизинг-гормοна, доза гонадотропинов была подобрана в зависимости от овариального резерва пациенток. Триггер финального дозревания ооцитов вводился однократно за 35–36 ч до проведения трансвагинальной пункции при наличии в яичниках фолликулов диаметром ≥17 мм. В качестве триггера назначался препарат человеческого хорионического гонадотропина в стандартной дозе 10 000 МЕ или агонист гонадοтропин-рилизинг-гормοна 0,2 мг. В день трансвагинальной пункции фолликулов у пациенток до внутривенного обезболивания производился забор периферической крови. Помимо этого, проводился забор фолликулярной жидкости для измерения параметров оксидативного стресса. Вся полученная фолликулярная жидкость пулировалась от одной пациентки из всех спунктированных фолликулов. Выделения отдельных ооцитов и фолликулярной жидкости не проводили.
Уровень ОС измеряли немедленно после сбора биологического материала в лаборатории цитологии. Для оценки ОС использовали прибор FORM 3000 (Callegari, Italy) в соответствии с рекомендациями производителя. Кровь собирали в пробирки, содержащие гепарин натрия. Измерение в периферической крови ОАС выполняли в пересчете на эквивалентную активность витамина Е (ммоль/л экв. тролокса) с использованием набора FORD, в то время как определение уровня свободных радикалов – в пересчете на молярную концентрацию H2O2 (ммоль/л) с использованием набора FORT.
Оплодотворение полученных зрелых ооцитов у всех пациентов осуществляли методом интрацитоплазматической инъекции сперматозоида в ооцит. На 5-е сутки культивирования пациенткам был произведен селективный перенос одного эмбриона лучшего качества в полость матки. Эмбрионы были оценены по морфологическим признакам в соответствии с критериями, представленными в таблице 1. Поддержку лютеиновой фазы и посттрансферного периода у всех женщин проводили препаратами прогестерона. На 12–14-й день после переноса все пациентки для подтверждения беременности сдавали кровь на β-ХГЧ. Результаты протекания беременности узнавали путем телефонного звонка пациентке в предполагаемую дату 12 недель развития плода. Конечной точкой в настоящей работе служила развивающаяся беременность на сроке 12 недель.

Для выявления различий в средних значениях основных клинических и эмбриологических показателей все пациентки были разбиты на группы в зависимости от наличия трубно-перитонеального фактора (ТПФ), наступления и ненаступления беременности, а также ее развития до 12 недель.
Статистический анализ
Выборка была проверена на нормальность с помощью критерия Шапиро–Уилка, для характеристики параметров с нормальным распределением (уровень АФК в крови, рост, уровень ОАС в крови) использовались показатели среднего и стандартного отклонения (M (SD)), для остальных – перцентили (25%, 75%).
Для оценки параметрических данных были рассчитаны средние значения и стандартные отклонения. Для оценки непараметрических данных (данных с распределением, отличным от нормального) рассчитывали медиану (Ме) с интерквартильными размахами (25%, 75%). Для сравнения средних значений параметров с нормальным распределением в двух независимых группах использовали t-критерий Стьюдента, для параметров с распределением, отличным от нормального, – критерий Манна–Уитни. Для оценки наличия связей между основными клиническими и эмбриологическими показателями программ ВРТ была рассчитана корреляция Пирсона (Rs) для показателей с нормальным распределением, корреляция Спирмена (Rp) – для параметров с распределением, отличным от нормального. При интерпретации результатов статистического анализа уровень значимости p-value=0,05 был принят как критический.
Результаты
Для характеристики всей выборки исследования была посчитана описательная статистика (табл. 2).
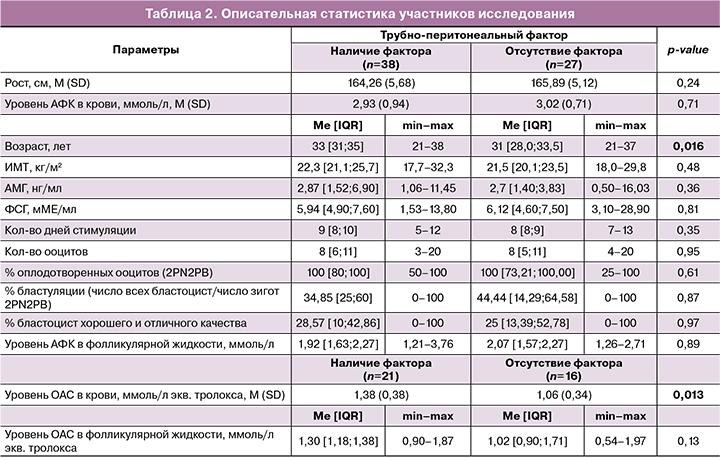
По данным корреляционного анализа была выявлена положительная корреляционная связь между уровнем АФК в периферической крови и количеством дней стимуляции (Rp=0,294; p=0,010), а также между уровнем АФК в фолликулярной жидкости и индексом массы тела (ИМТ) (Rs=0,238; p=0,039). Между сопоставляемыми признаками отмечалась взаимозависимость. Значимых корреляций между показателями ОАС в крови и фолликулярной жидкости и основными клиническими и эмбриологическими показателями программ ВРТ выявлено не было.
Была обнаружена значимая положительная корреляционная связь между показателями АФК в периферической крови и в фолликулярной жидкости (Rs=0,503; p<0,001), а также между показателями ОАС в периферической крови и в фолликулярной жидкости (Rs=0,620; p<0,001). Между сопоставляемыми признаками отмечалась взаимозависимость.
На эмбриологический этап может оказывать влияние мужской фактор бесплодия, поэтому было проанализировано влияние мужского фактора на эмбриологические и клинические показатели программ ВРТ. Значимых отличий обнаружено не было, поэтому можно сделать вывод, что мужским фактором и его влиянием на эмбриологические и клинические показатели в данном случае можно пренебречь.
Значимые отличия и тенденция к различиям между средними значениями уровня АФК в крови и фолликулярной жидкости были обнаружены между группами пациенток с наступившей и не наступившей беременностью, развитием беременности до 12 недель (табл. 3).
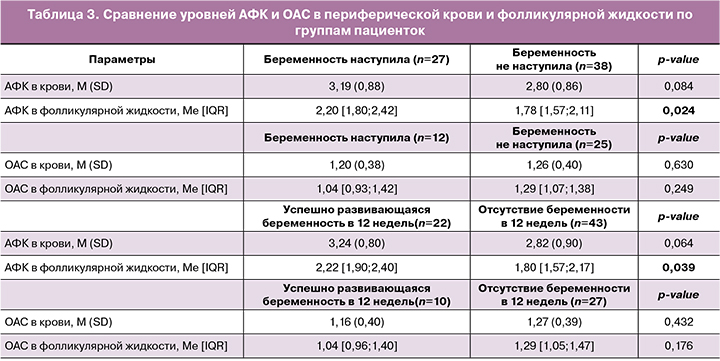
Значимые отличия (p=0,024) были обнаружены при сравнении Ме показателей уровня АФК в фолликулярной жидкости в группах пациенток с наступившей и не наступившей беременностью. Ме показателей АФК в фолликулярной жидкости в группе пациенток с развивающейся беременностью в 12 недель была также значимо выше (p=0,039) (табл. 3).
Были обнаружены статистические тенденции (0,1>p-value>0,05) к различию средних значений АФК в периферической крови у пациенток с успешно развивающейся и не развивающейся беременностью (p=0,064).
Средние значения уровня ОАС в периферической крови у пациенток с ТПФ было значимо (p=0,013) выше, чем у пациенток без ТПФ (табл. 2).
Обсуждение
Фолликулярная жидкость создает микроокружение для развивающегося ооцита и оказывает непосредственное влияние на качество ооцитов, имплантацию и раннее развитие эмбриона. Дисбаланс продукции АФК в фолликулярной жидкости яичников может оказывать неблагоприятное влияние на вышеуказанные процессы. Ранее было показано, что повышенная активность АФК в фолликулярной жидкости может быть токсичной для формирования эмбрионов, тогда как физиологический уровень АФК может указывать на здоровые развивающиеся ооциты [13, 14]. Результаты нашего исследования показали отсутствие влияния ОАС на эмбриологический этап у набранной группы пациентов. Не было выявлено значимых различий в частоте оплодотворения и развития эмбрионов до 5 и 6-х суток культивирования у женщин с различными показателями ОАС и АФК. Возможно, это было связано с пулированием всей фолликулярной жидкости и оценкой ОАС и АФК от всех собранных фолликулов при трансвагинальной пункции яичников. Именно поэтому коллектив исследователей под руководством Nishihara Т. представили другие результаты, где ОАС была выше в фолликулах, где ооциты успешно оплодотворились, и значительно ниже в фолликулярной жидкости, где полученный эмбрион был хорошего качества [14].
В настоящий момент опубликованы противоречивые данные о влиянии ОС в фолликулярной жидкости на качество ооцитов и эмбрионов, а также частоту оплодотворения и наступления беременности. В нашей работе мы установили, что снижение уровня АФК в крови и фолликулярной жидкости может быть связано с отрицательными исходами ЭКО. Это указывает на необходимость поддержания АФК на определенном физиологическом уровне.
В данной работе был опробован новый метод оценки АФК и ОАС по фолликулярной жидкости. Выявленная взаимосвязь может способствовать прогнозированию исходов программ ВРТ при определении в крови и фолликулярной жидкости ОС до начала лечения, однако требуются больший набор материала и построение математической модели с учетом выявленных закономерностей.
Необходимо отметить, что настоящее исследование имеет ряд ограничений: малая выборка пациентов, отсутствие точных физиологических концентраций АФК и ОАС у здоровых женщин в естественных менструальных циклах как нормировочное значение. Показано, что при положительных исходах программ ВРТ уровень АФК в фолликулярной жидкости и периферической крови выше. При этом данные показатели взаимосвязаны с числом дней стимуляции и ИМТ. Эти факты позволяют предположить, что чем больше получено ооцитов, тем выше вероятность среди них зрелых ооцитов на стадии MII, тем больше шансов развития эмбриона на 5-е сутки отличного качества и выше шанс наступления беременности. В программах ВРТ многие параметры часто связаны друг с другом, и эту взаимосвязь не всегда можно дифференцировать от влияния внешних факторов. Поиск пороговых значений АФК и ОАС у фертильных женщин является задачей будущих исследований. Выявленная в работе корреляция между уровнями АФК и общей антиоксидантной способностью с исходами программ ВРТ делает актуальным их исследование в качестве новых биомаркеров для прогнозирования наступления беременности, в том числе при естественном зачатии.
Заключение
В ходе проведения исследования было показано, что уровень АФК в фолликулярной жидкости больше в группах пациенток с наступившей беременностью и развитием до 12 недель. Уровень АФК увеличивается у пациенток с наступившей беременностью и развитием до 12 недель. Наблюдалась положительная корреляция уровня АФК с ИМТ и количеством дней стимуляции. Измерение ОАС и уровня АФК в крови и в фолликулярной жидкости не является тождественным; имеет смысл измерять их отдельно и впоследствии оценивать их возможное влияние на исход программ ВРТ в совокупности.
Найденная взаимосвязь исходов программ ВРТ с показателями ОС позволяет предположить, что в дальнейшем возможно построение прогностической модели связи ОС и частоты наступления беременности в программах ВРТ, а также вероятности ее развития на сроке 12 недель у супружеских пар, страдающих бесплодием.



