По данным ВОЗ ежегодно рождается около 15 миллионов недоношенных детей [1]. Преждевременными считаются роды, наступившие в сроки беременности от 22 до 37 недель. С преждевременными родами (ПР) связано около 75% случаев перинатальной смертности. Причины спонтанных ПР до конца не изучены. К факторам риска относятся: акушерско-гинекологический анамнез (гинекологические заболевания, исходы предыдущих беременностей и родов), осложнения текущей беременности (гестозы, многоплодие, многоводие, предлежание плаценты), социальные причины (возраст, вредные привычки, условия жизни), сопутствующие заболевания (пороки сердца, заболевания почек, острые инфекционные заболевания). Частота ПР в разных странах составляет от 5 до 18% [1]. Около 30% спонтанных ПР обусловлено наличием инфекции, причем у 80% детей, родившихся в сроке до 30-й недели беременности, диагностируется гистологически верифицированный хориоамнионит [2, 3].
Воспалительные процессы играют значимую роль в развитии многих заболеваний. К настоящему времени идентифицировано достаточно большое количество генов, продукты которых могут считаться маркерами воспаления, либо которые напрямую связаны с реализацией инфекционных процессов в организме [4–9]. К ним относятся более 200 цитокинов (интерлейкины (IL), факторы некроза опухолей (TNF-α), интерфероны, факторы роста), С-реактивный белок, трансформирующий ростовой фактор (TGF-β) и многие другие.
Активное изучение полиморфизмов генов интерлейкинов позволило установить взаимосвязь между различными аллельными вариантами этих генов с развитием ПР, астмы, онкологических заболеваний, вирусного гепатита, ревматоидного артрита и ряда других заболеваний [6, 10–13]. В настоящее время накоплено большое количество данных о роли воспаления в развитии ПР. Например, выявлена корреляция полиморфизма генов IL-1β, толл-подобных рецепторов (TLR) с невынашиванием беременности и ПР [4, 10].
Существует также особый класс белков – селенопротеины, содержащих один или несколько остатков селеносодержащей аминокислоты селеноцистеина. В семействе селенопротеинов особым нестандартным протеином является селенопротеин S. Он вовлечен в иммунные и воспалительные сигнальные пути [7]. Селенопротеин S может быть классифицирован как новый мембранный протеин, предотвращающий стрессовый ответ на активацию воспалительного каскада. В гене SEPS1 обнаружено несколько полиморфизмов, на настоящий момент практически не изученных. Для полиморфизма SEPS1 G-105A (rs28665122) показана корреляция с риском возникновения ПР у женщин в китайской популяции [5], риском развития рака желудка у японцев и китайцев [14, 15], риском развития рака легких у норвежцев [12]. В то же время, есть данные, что в зависимости от этничеcкой принадлежности и различного влияния факторов окружающей среды генетические проявления могут различаться.
Ген CRP кодирует С-реактивный белок, являющийся маркером системного воспалительного ответа [16]. С-реактивный белок относится к факторам врожденного иммунного ответа. Особенностью продукции этого белка является неспецифичность и высокая корреляция между его концентрацией в крови, причиной, тяжестью и стадией заболевания. Известно большое количество полиморфизмов гена CRP [17]. Полиморфизм С3872Т гена СRP в России изучен у пациентов с кардиоваскулярными заболеваниями, заболеваниями печени, при первичном рожистом воспалении [13, 18, 19]. На сегодняшний день существуют спорные данные о связи С-реактивного белка и интраамниотической инфекции [8, 9]. В клинической практике уже накоплен опыт определения уровня С-реактивного белка у пациенток с ПР с прогностической целью, но полиморфизмы гена CRP не изучены.
В связи с вышесказанным, представляется весьма актуальным изучение ассоциации полиморфизмов G-105A (rs28665122) гена SEPS1 и С3872Т гена СRP с ПР у женщин европеоидной расы, что и явилось целью данного исследования.
Материал и методы исследования
В данное исследование были включены 65 женщин с ПР (исследуемая группа) на сроках от 23,5 до 37 недель беременности. В качестве контрольной группы выступали 65 женщин с доношенной беременностью. Кровь для исследования набирали у пациенток родильных домов №29 и №8 г. Москвы. Кровь собирали в пробирки с EDTA и хранили при температуре -20°С.
ДНК выделяли из лейкоцитов крови наборами «ДНК-экспресс-кровь» производства ООО «Синтол». Для амплификации участка, содержащего полиморфный вариант G-105A гена SEPS1, были использованы следующие праймеры [5]:
5’-TCCTTGGCTTCAGTGTCCAAT-3’
5’-CGCGGACAGAGACTCCTCTT-3’
Полимеразную цепную реакцию (ПЦР) проводили в 25 мкл реакционной смеси, содержащей 20 нг ДНК, 0,2 мкм каждого праймера, 0,2 µМ дезоксинуклеозидтрифосфата и 0,5 ед Tag-полимеразы в буфере 1× (ООО «Синтол»). Условия реакции: 95°C – 2 мин, далее 35 циклов: 94°C – 30 сек, 57°C – 30 сек, 72°C – 30 сек, финальная элонгация – 72°C – 7 мин.
В результате ПЦР образуется фрагмент ДНК длиной 370 н.п. После амплификации ДНК переосаждали 3 объемами этилового спирта и инкубировали в течение 12 часов при t –20°С. Затем ампликоны обрабатывали эндонуклеазой Mox 20I (НПО «Сибэнзим») (работа проводилась по методике, описанной Wang Y. et al.) [5]. Для анализа полученных результатов проводили электрофорез в 3% агарозном геле.
После рестрикции образуются фрагменты следующего размера: 370, 233 и 137 н.п. Гомозиготам GG соответствует полоса 370 н.п., гомозиготам АА – полосы 233 и 137 н.п. У гетерозигот обнаруживаются все три фрагмента.
Полиморфный вариант С3872Т гена CRP определяли методом аллель-специфической ПЦР с использованием набора реагентов фирмы «Литех». Детекцию результатов проводили при помощи электрофореза в 3% агарозном геле.
Для статистической обработки полученных данных применяли программы R-language [20]. Статистически достоверными считались различия при уровне значимости р≤0,05. Для сравнения частот генотипов и аллелей в выборках использовали критерий χ2 [21].
Работа выполнена на базе межкафедральной учебно-научной лаборатории молекулярных методов исследования медицинского института РУДН. Выделение ДНК проводили на базе ЦКП (НОЦ) РУДН.
Результаты и обсуждение
Возраст обследованных женщин в исследуемой группе с ПР находился в диапазоне от 21 до 43 лет, средний возраст составил 32,2±5,8 года, в контрольной группе (доношенная беременность) возраст находился в диапазоне от 19 до 41 лет, средний возраст составил 29,2±5,2 года (p=0,007). Индекс массы тела составил 26,9±6,4 и 25,5±4,4 кг/м2 соответственно (р=0,187). При сравнительной характеристике групп были выявлены статистически значимые различия в отношении числа беременностей в анамнезе: в исследуемой группе в среднем – 2,6±1,6 и в контрольной – 1,7±1,1 (р=0,001). Сравнительная характеристика социального и семейного статуса достоверных различий не выявила (р=0,312, р=0,931 соответственно).
Так как при ранних и поздних сроках ПР причины могут быть различными, то для более глубокого изучения пациентки с ПР (исследуемая группа) были разделены на две подгруппы: первую подгруппу составили 21 человек, пациентки с ПР с 22 по 28 неделю беременности, вторую подгруппу составили 44 человека, пациентки с ПР с 29 по 37 неделю беременности.
При оценке микробного пейзажа вагинального содержимого пациенток в группе с ПР у 35 из 65 (53,8%) были выявлены явления неспецифического вульвовагинита с повышением в мазках на флору лейкоцитов до 40–80 в поле зрения, преобладанием кокковой и коккобациллярной флоры. У пациенток с доношенной беременностью результат микроскопии влагалищного отделяемого соответствовал неспецифическому вагиниту в 21 случаях из 65 (32,3%). Сравнивая полученные данные по критерию χ2 получены достоверные различия между данными группами (χ2=6,149 р=0,0132). Отмечена тенденция к увеличению неспецифического вульвовагинита у беременных первой подгруппы, по сравнению со второй (52,4 и 31,8%) (р=0,1177).
При анализе данных бактериологического исследования мазков из цервикального канала пациенток с ПР выявлен выраженный рост условно-патогенных микроорганизмов у 42 пациенток из 65 (64,6%). Из микроорганизмов преобладали: Candida albicans – у 24 (57,1%), Enterococcus faecalis – у 18 (42,9%), Streptococcus agalactiae B – у 15(35,7%), Escherichia coli – у 9 (21,4%). В группе с доношенной беременностью рост условно-патогенной флоры встречался у 30 пациентов из 65 (46,2%). Выявлено преобладание условно-патогенной флоры в группе с ПР, по сравнению с контрольной группой (χ2=4,483; р=0,0342). Относительный риск ПР при наличии условно-патогенных микроорганизмов ОР= 1,4, 95% д.и. (1,02–1,92), ОШ = 2,13 95% д.и. (1,05–4,31).
Большинство женщин занималось профессиональной трудовой деятельностью: в исследуемой группе – 44 (67,7%), в контрольной группе – 50 (76,9%). Статистически значимых различий между группами выявлено не было (χ2 =1,383 р=0,2396).
Беременные в обеих группах были соматически отягощенными (56 и 56%) (р>0,05). Хроническая артериальная гипертензия диагностирована примерно с одинаковой частотой (3 и 4%) (р>0,05). Анемия диагностирована примерно с одинаковой частотой у каждой второй – третьей пациентки в обеих группах (44 и 40%) (χ2 =0,284 р=0,5943).
Заболевания мочеполовой системы в группе с ПР встречаются у 12 пациенток (18,5%), в группе с доношенной беременностью – у 8 (12,3%). Достоверных различий между группами не выявлено (χ2=0,945 р=0,3309). Заболевания желудочно-кишечного тракта встречаются у 12% пациентов в обеих группах (р>0,05). Болезни органов дыхания и болезни щитовидной железы встречались у обследованных примерно с одинаковой частотой – у каждой двенадцатой-тринадцатой пациентки (χ2 = 0,050 р=0,8239).
Опрос респонденток в отношении особенностей половой жизни выявил, что более чем каждая вторая (53,8%) указала, что первый опыт сексуального общения состоялся до 17 лет в группе с ПР и примерно с такой же частотой – в группе с доношенной беременностью (46,2%) (χ2=0,769 р=0,3805). В возрасте 18 лет и старше первый опыт сексуального общения состоялся у каждой третьей пациентки (37 и 39%) (χ2=0,130 р=0,7184).
 Частота аллелей гена SEPS1 в разных популяциях изучена недостаточно. По данным Wang Y. с соавт. средне-популяционная частота аллеля А гена SEPS1 в китайской популяции составляет 6%, при этом встречаемость гетерозигот – 11,1%, гомозигот АА – 0,2%. В данной работе показана корреляция полиморфного варианта G-105A (rs28665122) гена SEPS1 с риском возникновения ПР [5].
Частота аллелей гена SEPS1 в разных популяциях изучена недостаточно. По данным Wang Y. с соавт. средне-популяционная частота аллеля А гена SEPS1 в китайской популяции составляет 6%, при этом встречаемость гетерозигот – 11,1%, гомозигот АА – 0,2%. В данной работе показана корреляция полиморфного варианта G-105A (rs28665122) гена SEPS1 с риском возникновения ПР [5].
Результаты, полученные нами при изучении распределения генотипов и аллелей по полиморфному варианту G-105A гена SEPS1 в исследуемых выборках, представлены в таблице 1.
В группе женщин с ПР частота аллеля А по полиморфному варианту G-105A гена SEPS1 составляет 20%, что достоверно выше, чем в контрольной группе (7,7%) (χ2=8,254; р=0,0041). Встречаемость гетерозигот AG также достоверно выше в группе женщин с ПР и составляет 40%, по сравнению с 15,4% в группе женщин с доношенной беременностью (χ2=9,835; р=0,0017). Гомозиготы АА не выявлены ни в одной из групп.
 Достоверных различий встречаемости полиморфного варианта G105A гена SEPS1 между подгруппами не выявлено (у 10 человек из 21 (47,6%) и 16 человек из 44 (36,4%) (р=0,3932)
Достоверных различий встречаемости полиморфного варианта G105A гена SEPS1 между подгруппами не выявлено (у 10 человек из 21 (47,6%) и 16 человек из 44 (36,4%) (р=0,3932)
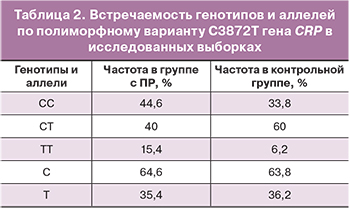
Результаты, полученные нами при изучении распределения генотипов и аллелей по полиморфному варианту С3872Т гена СRP в исследуемых выборках, представлены в таблице 2.
Ассоциация аллеля T по полиморфному варианту С3872Т гена СRP с ПР не выявлена (χ2=0,017, р=0,8971). Вместе с тем, наблюдается тенденция к увеличению частоты гомозигот TT в группе женщин с ПР (χ2=2,882; р=0,088). Возможно, что наличие гомозиготного генотипа по аллелю T может предрасполагать к ПР. Данная гипотеза требует дальнейших исследований в выборках большего объема.
При проведении сравнительного анализа между группами в отношении роста условно-патогенной флоры и встречаемостью полиморфного варианта G-105A (rs28665122) гена SEPS1 корреляции не выявлено (χ2 =0,833 р=0,361).
Заключение
Результаты проведенного исследования выявили достоверные различия по частоте гетерозигот и аллеля А гена SEPS1 (G-105A) у женщин европеоидной расы с ПР и с доношенной беременностью. Таким образом, аллель А по полиморфному варианту G-105A гена SEPS1 может выступать в качестве одного из предикторов ПР.
Статистически значимых различий при анализе встречаемости аллелей и генотипов по полиморфному варианту C3872T гена CRP у европейских женщин с ПР и с доношенной беременностью не обнаружено.



