Важнейшим этапом программы экстракорпорального оплодотворения (ЭКО) является гонадотропная стимуляция яичников, направленная на получение адекватного количества ооцитов и эмбрионов при минимизации рисков осложнений. Одной из главных задач при этом является выбор оптимальной дозы гонадотропинов, что достигается корректной оценкой индивидуальных особенностей каждой пациентки, в частности овариального резерва. Одним из осложнений программ вспомогательных репродуктивных технологий (ВРТ) является синдром гиперстимуляции яичников (СГЯ) — состояние, в основе которого лежит гиперэргический неконтролируемый ответ яичников на введение гонадотропинов. СГЯ характеризуется широким спектром клинических и лабораторных проявлений: от легких биохимических изменений до выраженного увеличения размеров яичников с формированием в них фолликулярных и лютеиновых кист на фоне выраженного отека стромы; увеличением сосудистой проницаемости, массивным переходом жидкой части крови из внутрисосудистого в «третье пространство». Эти процессы приводят к гиповолемии, гемоконцентрации, гипопротеинемии, электролитному дисбалансу, развитию асцита, гидроторакса, гидроперикарда, олигурии, острой почечной недостаточности, тромбоэмболическим осложнениям, респираторному дистресс-синдрому взрослых [1, 2]. Частота СГЯ варьирует от 0,5 до 33% при различных схемах стимуляции овуляции и не имеет тенденции к снижению [2, 3]. Крайне важно своевременно выявлять пациенток группы риска на этапе планирования программ ВРТ. Для этой цели разработан ряд клинико-лабораторных параметров, служащих предикторами развития СГЯ, к которым относятся возраст, индекс массы тела (ИМТ), базальный уровень ФСГ, уровень антимюллерова гормона (АМГ), ингибина В, число антральных фолликулов. Данные маркеры позволяют во-время применить действенные клинически значимые меры профилактики, которые заключаются в выборе «мягких» протоколов стимуляции, замене триггера овуляции, использовании агонистов допаминовых рецепторов 2-го типа, отмене переноса эмбрионов и их криоконсервации для переноса в следующих циклах. Однако, несмотря на использование объективных клинико-лабораторных параметров и проведение вышеперечисленных мер профилактики, у части пациенток СГЯ развивается, что предполагает участие в его развитии других факторов, в том числе и генетических [4, 5].
В настоящее время бурно развивается фармакогенетика – наука о прогнозировании эффектов лекарственных препаратов на основании индивидуального генотипа пациента. Как известно, особенности реакции на гормоны зависят не только от вариаций в последовательности гена лиганда, но и от полиморфизма генов соответствующих рецепторов [6]. Наиболее часто встречаются генные вариации, заключающиеся в замене или делеции 1-2 нуклеотидных оснований, называемые одиночными нуклеотидными полиморфизмами (SNP – от Single Nucleotide Polymorphism) [7]. Полагают, что, несмотря на то, что на реакцию пациента на лекарственный препарат могут влиять сотни генов, даже небольшое количество ключевых SNPs могут надежно прогнозировать безопасность и эффективность применения данного препарата у конкретного пациента.
С выявлением генетической природы развития спонтанных форм СГЯ положено начало углубленному изучению полиморфизмов ряда генов-кандидатов, так как до внедрения в практику информативных молекулярно-генетических маркеров все имеющиеся на сегодняшний день клинико-лабораторные предикторы не способны в полной мере прогнозировать развитие СГЯ.
Говоря о роли различных генов-кандидатов в формировании СГЯ можно условно выделить две группы: гены, ответственные за особенности фолликулогенеза, и гены, участвующие в ключевых звеньях патогенеза СГЯ. К первой группе относятся, в первую очередь, гены гормонов, таких как ФСГ, ЛГ, ЛГ/ХГ, АМГ, эстрадиола, прогестерона, ТТГ, и их рецепторов.
Ко второй группе можно отнести компоненты ренин-ангиотензиновой и иммунной систем с вовлечением различных цитокинов (интерлейкины (IL)-1, IL-6, IL-8, IL-18, фактор некроза опухоли (TNF)-α), семейство генов сосудисто-эндотелиального фактора роста (VEGF), молекулы адгезии (sVCAM-1, sICAM-1, Е-селектин), эндотелин 1, фактор Виллебранда (vWF) и др. Однако исследования, посвященные данной теме, единичны.
Цель исследования – оценка вклада молекулярно-генетических маркеров как предикторов СГЯ в программе ЭКО.
Материал и методы исследования
В исследование включены 152 пациентки, обратившиеся для проведения программы ЭКО в отделение сохранения и восстановления репродуктивной функции ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Основную группу составили 30 пациенток с развившимся СГЯ, группу контроля – 122 пациентки, у которых СГЯ не развился.
Критериями постановки диагноза СГЯ явились: увеличение размеров яичников d>6 см, гемоконцентрация (гематокрит ≥40%, гемоглобин >14 г/л), ультразвуковые/клинические признаки асцита и/или гидроторакса, гастроинтестинальные явления (тошнота, рвота и/или диарея), гиперкоагуляция, лейкоцитоз >10×109/л, явления абдоминального дискомфорта [3, 8, 9].
Критерии включения в контрольную группу: 6 и более антральных и созревающих (>11 мм) фолликулов; уровень АМГ >1,0 нг/мл; базальная концентрация ФСГ <12 21="" 35="" 18="" 38="" 18="" 29="" p="">
Критериями исключения послужили состояния, являющиеся противопоказаниями для проведения программы ЭКО, а также эндокринный фактор бесплодия и СПКЯ.
У всех пациенток было получено письменное информированное согласие. Стимуляция функции яичников проводилась по фиксированному протоколу с антагонистом гонадотропин рилизинг гормона (антГнРГ) и стимуляцией яичников препаратами рекомбинантного ФСГ (рФСГ) со 2–3-го дня менструального цикла. Подбор стартовой дозы индуктора осуществляли исходя из параметров овариального резерва пациенток (возраст, уровень ФСГ, АМГ, количество антральных фолликулов и ответ на предыдущую стимуляцию). Для пациентов с высоким риском СГЯ (>14 антральных фолликулов [10], уровень АМГ >3 нг/мл [11, 12], >13 созревающих фолликулов диаметром >11 мм [12], стартовая доза рФСГ не превышала 200 МЕ.
На втором этапе проведено исследование широкой панели генетических маркеров, потенциально участвующих в развитии и клинических проявлениях СГЯ: IL18: -137 G>C, ICAM1 721 G>A (Gly241Arg), IL18 -656 C>A, VEGFA -2578(-2595) A>C, BSG: 3800 C>T, AMH 146 G>T (Ile49Ser), VEGFA 936 C>T, IL2 166 G>T (Leu38Leu), LHCGR 935 A>G (Asn312Ser), EDN1 G>T (Lys198Asn), VEGFA -634 G>C, IL6 174 C>G, AMHR2 (-482 A>G), EDNRAC>T (H323H), FSHR 2039 G>A (Ser680Asn), IL1R1 1970 C>T [Pst1], INHA -16 C>T, ESR1–351 A>G [XBaI], LHCGR 872 A>G (Asn291Ser), TNF -308 G>A, SERPINE1 (PAI-1) -675(5G>4G), IL1B -598(-1552) T>C, ESR1 –397 T>C [PvuII], IL2 -330 T>G, TNF -238 G>A, IL1B -31 T>C, ESR2 G>A, IL18 -607 G>T, TCHR 2181 C>G (Asp727Glu), IL8 -251 A>T, ACE 287bp Ins>Del. Генотипирование проводили методом полимеразной цепной реакции с анализом кривых плавления модифицированным методом «примыкающих проб» (adjacent probes, kissing probes) с помощью коммерческих тест-систем ООО «НПО ДНК-Технология», Россия. ДНК для генотипирования выделяли из образцов периферической крови, взятой с ЭДТА в качестве антикоагулянта, с помощью комплекта реагентов «Проба-ГС-генетика» ООО «НПО ДНК-Технология», Россия. Определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия).
Статистическая обработка данных выполнена на персональном компьютере с использованием программы IPM SРSS Statistics, версия 22.
Все полученные количественные анамнестические, клинические, лабораторные и инструментальные данные обработаны методом вариационной статистики.
 При нормальном характере распределения данных результаты представлены как среднее ± стандартная ошибка среднего (М±m). При распределении данных, отличных от нормального (значение теста Колмогорова–Смирнова менее 0,05), исследованные количественные показатели представлены в виде Ме (L–H), где Ме–медиана, L–25 (нижний) квартиль, H – 75 (верхний) квартиль, 95% доверительный интервал, качественные данные – в виде частот (%). Для сравнения количественных данных, имеющих распределение, отличное от нормального, применяли метод Манна–Уитни (для 2 групп) для несвязанных совокупностей; критерий χ2 для таблиц сопряженности признаков 2*2 (для сравнения частот встречаемости признаков в анализируемых группах). Статистически значимыми считали отличия при р<0,05 (95% уровень значимости).
При нормальном характере распределения данных результаты представлены как среднее ± стандартная ошибка среднего (М±m). При распределении данных, отличных от нормального (значение теста Колмогорова–Смирнова менее 0,05), исследованные количественные показатели представлены в виде Ме (L–H), где Ме–медиана, L–25 (нижний) квартиль, H – 75 (верхний) квартиль, 95% доверительный интервал, качественные данные – в виде частот (%). Для сравнения количественных данных, имеющих распределение, отличное от нормального, применяли метод Манна–Уитни (для 2 групп) для несвязанных совокупностей; критерий χ2 для таблиц сопряженности признаков 2*2 (для сравнения частот встречаемости признаков в анализируемых группах). Статистически значимыми считали отличия при р<0,05 (95% уровень значимости).
Результаты исследования
На первом этапе проведена оценка клинико-анамнестических данных и анатомо-функционального состояния репродуктивной системы пациенток.
Анализ клинико-анамнестических характеристик включенных в исследование пациенток двух групп не выявил статистически значимых различий в возрасте (медиана составила 31 год, интерквартильный интервал 28,0–34,0 года; р=0,991), ИМТ (медиана – 21,4 и 22,0; р=0,734), среднем возрасте менархе пациенток (13,4±0,23 года и 13,2±0,12 года; р=0,376).
Все пациентки, включенные в данное исследование, имели регулярный менструальный цикл. Сред-няя длительность менструального цикла у пациенток основной группы составила 30,4±0,67 дня, минимум – 23,0 дня, максимум – 40,0 дня; в контрольной группе – 30,2±0,3 дня, минимум – 24,0 дня, максимум – 40,0 дня, то есть не было выявлено статистически значимых различий (р=0,737) между группами.
Первичное бесплодие было выявлено у 60% женщин основной группы и 61,5% контрольной. Вторичное бесплодие отмечено у 40 и 38,5% пациенток соответственно. Оценка репродуктивного анамнеза показала, что в основной группе у женщин с вторичным бесплодием у 30% в анамнезе была 1 беременность, у 6,7% – 2 беременности, у 3,3% – 3 и более. У пациенток основной группы исследования в 6,7% случаев беременность закончилась родами, в 10% – искусственным прерыванием беременности на раннем сроке, в 3,3% случаев произошло самопроизвольное прерывание беременности, в 20% была диагностирована внематочная беременность, у 6,7% пациенток – неразвивающаяся беременность.
Среди пациенток группы контроля с вторичным бесплодием у 20,5% в анамнезе была 1 беременность, у 8,2% – 2 беременности, у 9,8% – 3 и более. У пациенток в группе контроля роды имели место в 13,1% случаев, у 10,6% беременность завершилась абортом на раннем сроке, в 7,3% случаев произошло самопроизвольное прерывание беременности, в 10,6% была диагностирована внематочная беременность, у 8% пациенток – неразвивающаяся беременность. Статистически значимых различий по данным показателям в двух исследуемых группах выявлено не было.
Средний показатель длительности бесплодия в основной группе составил 5,2±0,6 года, в контрольной группе –5,2±0,3 года; р=0,900.
Бесплодие было обусловлено трубно–перитонеальным фактором у 40% пациенток основной группы и у 36,1% пациенток контрольной группы (р=0,690), мужским – у 60% пациенток основной и 59,8% пациенток контрольной группы (р=0,987), наружный генитальный эндометриоз выявлен у 10% пациенток основной группы и у 8,2% пациенток группы контроля (р=0,752), сочетание факторов наблюдалось у 23,3 и 20,5% женщин (р=0,733), идиопатическое бесплодие отмечались у 16,7 и 16,4% пациенток соответственно (р=0,971).
Аллергические реакции в анамнезе отмечены у 6 пациенток (20%) группы развившегося СГЯ и 15 пациенток (12,3%) без СГЯ (р=0,275).
Базальные уровни ФСГ, ЛГ и эстрадиола на 2–3-й день менструального цикла были сопоставимы в двух группах: ФСГ – медиана 5,8 и 4,5 МЕ/л, р=0,509, ЛГ – медиана 5,6 и 5,4 МЕ/л, р=0,792, и эстрадиол – медиана 129,5 и 129,0 пмоль/л, р=0,917.
Уровень АМГ был выше в группе развившегося СГЯ (медиана 6,35, интерквартильный интервал 3,8–8,0 нг/мл) по сравнению с группой, где СГЯ не развился (4,7 нг/мл, интерквартильный интервал 3,0–7,7 нг/мл), однако статистически значимых различий в концентрации АМГ между двумя группами выявлено не было; р=0,232.
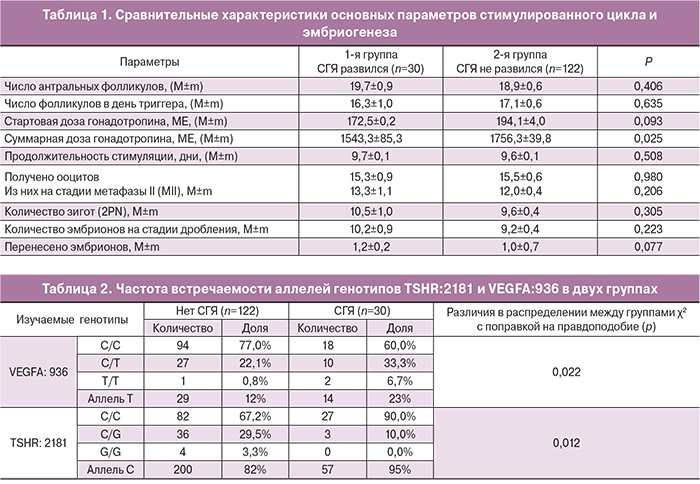
Параметры стимулированного цикла и эмбриогенеза в обеих группах представлены в табл. 1.
Суммарная доза гонадотропина была существенно ниже в основной группе (1543,3±85,3 и 1756,3±39,8; р=0,025). Выявленные различия можно объяснить тщательным выбором стартовых доз гонадотропинов для пациенток группы риска развития СГЯ; однако, несмотря на подбор адекватных доз препаратов рФСГ и применение «мягких» протоколов стимуляции, у пациенток данной группы СГЯ развился.
Проведенный анализ эмбриологических показателей продемонстрировал, что обе группы были сопоставимы по всем параметрам (по количеству полученных ооцитов, зрелых ооцитов (МII), частоте дробления, количеству перенесенных эмбрионов).
С целью анализа прогностической значимости общепринятых клинико-функциональных параметров, 152 пациентки, включенные в настоящее исследование, были распределены по двум группам: 1-я группа – пациентки с «нормальным» ответом яичников на стимуляцию (n=36), 2-я группа – пациентки с «гиперответом» (n=116). В 1-ю группу были включены пациентки с числом антральных и созревающих (>11 мм) фолликулов от 6 до 13 включительно; уровнем АМГ от 1,0 до 3 нг/мл; во 2-ю группу – пациентки, имеющие >14 антральных фолликулов и >13 созревающих фолликулов диаметром >11 мм, уровень АМГ >3 нг/мл. Проанализирована частота развития СГЯ в двух группах.
Всем пациенткам, исходно составлявшим группу риска (n=116), проводились профилактические мероприятия, направленные на предотвращение СГЯ: в 44 случаях (37,9%) произведена замена триггера овуляции на агонист ГнРГ, в 56 (48,3%) – пациенткам назначены препараты агонистов допаминовых рецепторов 2-го типа после трансвагинальной пункции, в 44 (37,9%) случаях отменен перенос эмбрионов; у 39 (33,6%) пациенток с отменой переноса в день трансвагинальной пункции использовали 0,75 мг антГнРГ с целью блокирования гипоталамо-гипофизарно-яичниковой системы.
Из 30 пациенток с развившимся клинически значимым СГЯ 86,7% пациенток исходно входили в группу риска, в связи с чем им были проведены профилактические мероприятия, тогда как 13,3% пациенток, исходно имели «нормальные» показатели овариального резерва (по АМГ, числу антральных и растущих фолликулов), в связи с чем профилактика СГЯ не проводилась в виду отсутствия риска развития данного осложнения.
Таким образом, чувствительность общепринятых клинико-лабораторных параметров составила 86%, тогда как специфичность – 26%, что может свидетельствовать об ограниченных возможностях использования вышеперечисленных маркеров в клинической практике. Прогностическая ценность положительного результата составила 22,4%; отрицательного – 88,9%, что подтверждает недостаточно высокую эффективность использования рутинных клинических методов прогнозирования риска СГЯ и обуславливает необходимость поиска маркеров, способных дополнить имеющуюся панель клинико-функциональных параметров.
Было проанализировано распределение аллелей и генотипов исследуемых генетических маркеров у пациенток с развившимся СГЯ и в группе контроля. В ходе проведенного анализа выявлена статистически значимая ассоциация полиморфизмов TSHR:2181 С>G (Asp727Glu) [rs1991517] и VEGFA:936 C>T [rs3025039] с развитием СГЯ (табл. 2). По остальным исследованным маркерам не было получено статистически значимых различий в распределении аллелей и генотипов между группами (данные не приводятся).
Согласно аутосомно-рецессивной модели, наличие генотипа TSHR:2181C/C (р=0,012; ОШ=4,18 (95% (1,25-13,96)) или аллеля VEGFA:936Т по аутосомно-доминантной модели (р=0,022; ОШ=2,26 (95% (1,11–4,60)) предрасполагает к реализации риска СГЯ.
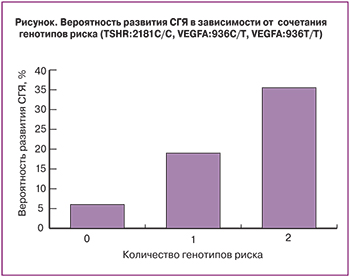
По результатам проведенного анализа выявлено, что при наличии благоприятного генотипа по обоим маркерам, риск СГЯ составляет 5%; присутствие у пациентки одного из двух генотипов риска повышает вероятность развития клинически значимого СГЯ до 20%, тогда как при сочетании неблагоприятных генотипов TSHR и VEGFA риск развития СГЯ достигает 35% (рисунок).
Согласно проведенному анализу, чувствительность метода при наличии одного генотипа риска составила 93,3%, тогда как специфичность – 26,2%, при наличии обоих генотипов риска – 36,7 и 83,6% соответственно. Прогностическая ценность положительного результата в первом случае составила 23,7%; отрицательного – 94,1%; во втором – 35,5 и 84,3% соответственно.
Обсуждение
Существует вариабельность генов, которая может быть ответственна за развитие того или иного состояния, различающаяся для каждой конкретной пациентки. В настоящее время выделен ряд генов-кандидатов, предположительно ответственных за развитие СГЯ [13–16]. Ряд авторов считает, что до внедрения молекулярно-генетических методов в рутинный алгоритм обследования пациенток программ ВРТ, прогнозирование риска развития СГЯ не будет полным, достаточно специфичным и персонифицированным [17]. Согласно нашим данным, выявленные полиморфизмы генов TSHR и VEGFA статистически значимо ассоциированы с развитием СГЯ.
Повышение внутрисосудистой проницаемости, являющееся одним из ключевых звеньев патогенеза СГЯ, опосредовано воздействием сосудистого эндотелиального фактора роста (VEGF). Существует большое количество работ, посвященных VEGF, также полиморфизмам его гена и рецептора. В ряде работ было показано, что концентрация VEGF была достоверно повышена в фолликулярной жидкости (но не в крови) у пациенток, получивших препараты хорионического гонадотропина в качестве триггера овуляции по сравнению с пациентками, у которых была произведена замена триггера овуляции на препараты агониста ГнРГ [18, 19]. Основную роль в трансдукции проангиогенного сигнала играют рецепторы фактора роста сосудов I и II типов VEGFR1 (Flt1) и VEGFR2 (Flk-1 или KDR). Считается, что основной функцией VEGFR1 может быть не столько передача митотического сигнала, сколько негативная регуляция действия VEGFA на клетки эндотелия сосудов [20].
Существует значительная генетическая вариабельность в сигнальной системе VEGF/VEGFR. В работе H.I. Hanevik и соавт. (2012) продемонстрирована связь между полиморфизмом генов, кодирующих сигнальную систему VEGF/R2 и СГЯ после овариальной стимуляции. Авторами впервые была выявлена ассоциация между генотипом 405C/C гена VEGF и СГЯ (OR=3.4, 95% (1.01–11.7)) [21]. В исследовании K. Nouri и соавт. (2014) было обнаружено значительное преобладание -962(-519) Т-аллеля гена VEGFR1 среди пациенток с развившимся СГЯ (p=0,02, OR: 3,62 (1,16–11,27)). При проведении математического моделирования авторами были выявлены значимые различия по полиморфным локусам VEGFR1:-519 и VEGFA: 405 пациенток с СГЯ и пациенток контрольной группы (p=0,02, OR: 3,79 (1,98–11,97); p=0,000005, OR: 0,29, (0,17–0,50) соответственно). Авторы пришли к выводу, что полиморфизм гена VEGFA и его рецептора (VEGFR1) ассоциированы с развитием СГЯ [22].
Связь гена рецептора ТТГ с развитием СГЯ в литературе освещена мало. В ряде работ отмечалась связь гипотиреоза со случаями спонтанного СГЯ. Так, по данным S. Borna и A. Nasery (2007) повышенные уровни ТТГ способны стимулировать развитие СГЯ ввиду наличия тиреоидных рецепторов в клетках гранулезы [23, 24]. ТТГ обладает слабой ФСГ-подобной активностью, воздействуя на ФСГ-рецептор и стимулируя функцию яичников [25].
По данным ряда авторов также выявлена связь СГЯ с повышенным уровнем ТТГ, однако точно не описаны механизмы реализации этой связи [26, 27]; вероятно, она обусловлена структурной гомологией ТТГ, ФСГ, ЛГ и ХГ [28]. В исследовании M. Ashrafi и соавт. была создана математическая модель прогноза СГЯ с высокой предсказательной способностью, включающая 4 независимых предиктора, одним из которых был гипотиреоз. В исследовании показано, что у пациенток с гипотиреозом риск СГЯ повышен в 5 раз [29]. В настоящем пилотном исследовании впервые выявлена взаимосвязь генотипов TSHR:2181C/C и VEGFA:936Т с развитием СГЯ.
Полученные нами данные подтверждают, что общепринятые клинико-функциональные маркеры, используемые в клинической практике для оценки риска СГЯ, такие как ИМТ, базальный уровень ФСГ, АМГ, число антральных и растущих фолликулов, являются не достаточно специфичными [30, 31]. Обладая высокой чувствительностью, вышеперечисленные параметры могут использоваться в качестве скрининга на выявление группы риска развития СГЯ, однако требуют обязательного подтверждения более специфичными методами. Потенциальными маркерами риска развития СГЯ могут стать генетические предикторы. По результатам проведенного анализа генотипирование обладает высокой клинической специфичностью при прогнозировании развития СГЯ в группе риска. Определение генотипа по двум выявленным маркерам: TSHR:2181 С>G (Asp727Glu) [rs1991517] и VEGFA:936 C>T [rs3025039] является высокоспецифичным тестом, способным дополнить панель привычных методик прогнозирования овариального ответа. Учитывая высокую специфичность генетического тестирования, перспективной представляется разработка алгоритма двухэтапного скрининга, включающего генотипирование пациенток при выявлении клинических предикторов СГЯ.
Заключение
Полученные в работе данные свидетельствуют о целесообразности поиска новых персонифицированных маркеров развития СГЯ. Молекулярно-генетические предикторы, такие как TSHR и VEGFA, могут дополнить ряд существующих клинико-лабораторных маркеров, используемых в рутинной практике ВРТ. Комплексная оценка клинико-лабораторных и молекулярно-генетических предикторов позволит индивидуально подобрать оптимальный протокол стимуляции яичников и минимизировать риски, связанные с развитием СГЯ.



