Женская сексуальная дисфункция (ЖСД) включает различные состояния, которые характеризуются нарушениями в одной или нескольких из следующих областей: желание, возбуждение, оргазм или боль. ЖСД включает множественные перекрывающиеся сексуальные расстройства с многогранной причиной в рамках биопсихосоциальной модели и оказывает негативное влияние на качество жизни женщин, их самооценку, физическое и репродуктивное здоровье [1–3].
В основе ЖСД лежат как физиологические (нейрогенные, эндокринные, сосудистые, анатомические проблемы), так и психологические проблемы [4].
По мнению Prabhu S.S. et al., причинами ЖСД могут быть нарушения обмена нейротрансмиттеров (допамина, эпинефрина, норэпинефрина, серотонина), хронические экстрагенитальные заболевания, дисфункция тазового дна, психосоциальные факторы (стрес, тревога, сексуальное и физическое насилие в анамнезе, психические заболевания) [5].
По данным различных авторов, частота ЖСД составляет от 40 до 81% в различных возрастных группах женщин [6–9]. Пандемия новой коронавирусной инфекции оказала существенное влияние на развитие нарушений сексуальной функции женщин. Женщины более старшего возраста до пандемии имели проблемы с желанием и возбуждением, во время пандемии и карантина добавились нарушения, связанные с оргазмом, удовлетворенностью и желанием уже в более молодых группах женщин [10]. У женщин через 12 недель после родов сексуальная дисфункция регистрируется в 81% случаев [9].
Известно, что наличие бесплодия негативно влияет на сексуальность бесплодной пары. Так, по данным Starc A. et al., сексуальная дисфункция регистрируется у 43–90% бесплодных женщин и у 48–58% бесплодных мужчин. Неспособность зачатия, реакция общества на отсутствие детей, процедуры, ассоциированные с бесплодием, провоцируют у женщины состояние паники, отчаяния, гнева, депрессии, что способствует формированию «порочного круга» и еще более снижает вероятность наступления желанной беременности [11].
По данным Okobi O.E. et al., индекс женской сексуальности у бесплодных женщин существенно ниже, чем у фертильных [12]. В исследовании Facchin F. et al. указывали также, что стресс, связанный с бесплодием, может влиять на формирование сексуальной дисфункции и более высокую ее частоту у инфертильных женщин (отношение шансов 1,02 на балл; 95% ДИ 1,01–1,03; P=0,001) [13].
Для лечения ЖСД могут применяться медикаментозные, немедикаментозные и дополнительные методы [5].
Метаанализ, проведенный Weinberger J.M. et al., включал 42 опции и 26 различных классов лекарств для лечения ЖСД. Наибольшее количество исследований было посвящено гормональной терапии (25 исследований), ингибиторам фосфодиэстеразы-5 (9 исследований), ботулотоксину A (5 исследований), флибансерину (5 исследований). В 36 исследованиях проводился анализ эффективности физиотерапии, в 3 – гомеопатических средств. Установлено, что лечение ЖСД должно быть многофакторным, и изолированная медикаментозная терапия не может решить всех проблем; необходим комплексный подход в соответствии со всеми четырьмя доменами сексуальной дисфункции [14].
При лечении ЖСД крайне высока эффективность плацебо. Так, в метаанализе, проведенном Weinberger J.M. et al., который включал 605 публикаций с участием 1723 женщин, которые получали плацебо, а также 2236 женщин, которым назначались различные препараты (флибансерин, бупропион, онаботулинума токсин A, прастерон вагинально, окситоцин интраназально, оспемифен, бремеланотид), было продемонстрировано, что общая сексуальная функция, согласно опроснику «Индекс сексуальной функции женщин» (Female Sexual Function Index, FSFI), в группе плацебо увеличилась с 3,62 (95% CI 3,29–3,94) до 5,35 (95% CI 4,13–6,57) балла. При этом эффективность плацебо составила 67,7% [15].
В гинекологической практике много лет используются растительные лекарственные средства, созданные на основе экстракта плодов Vitex аgnus-castus (VAC, витекс священный, прутняк обыкновенный), и накоплен большой опыт использования лекарственного растительного препарата «Циклодинон» («Бионорика СЕ», Германия) у разных категорий пациенток [16].
Рандомизированное двойное-слепое плацебо-контролируемое клиническое исследование, проведенное Heirati S. et al. в 2021 г. в Иране на 112 пациентках репродуктивного возраста, продемонстрировало достоверную эффективность 4-месячной терапии растительным препаратом витекса священного сексуальной дисфункции женщин [17]. Эффективность лечения оценивали по баллам опросника FSFI в начале исследования и через 4, 8, 12 и 16 недель. В результате отмечена статистически значимая разница (p<0,05) в среднем балле общей сексуальной функции среди женщин, принимавших препарат, по сравнению с пациентками из группы плацебо.
Таким образом, вышеизложенные данные послужили основанием для исследования витекса священного у пациенток с целью коррекции имеющихся нарушений и оценки влияния на сексуальную функцию.
Цель исследования: провести сравнительную оценку влияния приема препарата на основе стандартизированного экстракта плодов VAC и циклической витаминотерапии на сексуальную функцию у пациенток с нарушениями менструального цикла и бесплодием.
Материалы и методы
Исследование проводилось на клинической базе ФГОУ ВО «Кемеровский государственный медицинский университет» Минздрава России в отделении вспомогательных репродуктивных технологий ГАУЗ «Кузбасская областная клиническая больница» им. С.В. Беляева в 2022–2023 гг.
Дизайн – открытое сравнительное контролируемое клиническое исследование, направленное на установление «превосходства».
С учетом этого, проверяемые гипотезы следующие:
H0: μI = μII (два метода лечения не отличаются по среднему ответу);
H1: μI - μII = d (два метода лечения отличаются по среднему ответу на некую величину d),
где μI, μII – средний ответ на лечение, соответствующий лечению в 1-й и 2-й группах.
Объем выборки в каждой группе рассчитывался по формуле:
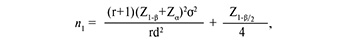
где r – пропорция рандомизированных групп, d – величина клинического эффекта (индекса FSFI), σ – дисперсия выборки. Принимаем уровень статистической мощности 90% и двустороннюю частоту ошибок 1-го типа за 5%.
В случае рандомизации 1:1, d=9,24, σ=14,5 получаем необходимое минимальное число лиц в каждой группе – 51 человек. Итого, в двух группах количество пациенток должно быть не менее 102.
Из 356 пациенток, обратившихся в клинику по поводу бесплодия, в исследование включены 104 женщины в возрасте от 23 до 36 лет, которые соответствовали критериям включения/невключения.
Процедуру простой рандомизации проводили с использованием листа случайных чисел, полученных при помощи библиотеки randomizeBE в R. В качестве параметров генерируемой псевдо-случайной последовательности был случайным образом указан параметр «seed», пропорция 1:1. Тест на случайность выполнялся по методу Уалда–Вольфовица.
Полученный список из 104 чисел позволил рандомизировать пациентов из общего списка с соответствующими листу рандомизационными номерами амбулаторных карт для приема лекарственного препарата «Циклодинон» в группу 1 и в группу 2 для приема БАД «Цикловита».
1-ю группу составили 52 пациентки, которым были назначены препарат на основе экстракта плодов VAC (лекарственный препарат «Циклодинон», таблетки, покрытые пленочной оболочкой, «Бионорика СЕ», Германия) в дозировке 4 мг 1 р/сут в течение 4 месяцев и индивидуальная психотерапия.
Во 2-ю группу вошли 52 пациентки, которым были назначены циклическая витаминотерапия (БАД «Цикловита», «Фармстандарт-УфаВИТА», Россия) по 1 таблетке 1 р/сут в фолликулярную фазу цикла и по 2 таблетки 1 р/сут в лютеиновую фазу цикла на протяжении 4 месяцев и индивидуальная психотерапия.
Критериями включения в исследование являлись репродуктивный возраст, бесплодие, ассоциированное с отсутствием овуляции (N97.0), нарушение менструального цикла, наличие информированного согласия на участие в исследовании.
Критерии невключения: прием эстроген-гестагенных и дофаминомиметических препаратов в течение 3 месяцев до включения и на момент включения в исследование, мужской и трубный факторы бесплодия, беременность и лактация, алкогольная и наркотическая зависимости, наличие экстрагенитальных заболеваний и психических расстройств, препятствующих планированию беременности, отказ от участия в исследовании.
Оценивали первичные и вторичные исходы. Первичными исходами считали динамику частоты сексуальной дисфункции и индекса женской сексуальности (по шкале FSFI); вторичными исходами: динамику частоты тревоги и депрессии (по шкале HADS).
Блок-схема дизайна исследования представлена на рисунке.

Для оценки сексуального здоровья женщин использовали структурированное клиническое интервью, опросник «Индекс женской сексуальной функции» (Female Sexual Function Index, FSFI) [18] на русском языке и опросник госпитальной шкалы тревоги и депрессии (Hospital Anxiety and Depression Scale, HADS) [19]. Опросник FSFI включал 19 вопросов, сгруппированных по шести доменам: «желание», «возбуждение», «лубрикация», «оргазм», «удовлетворенность», «боль». Пациентки оценивали свое состояние, присваивая соответствующий балл в ответ на каждый вопрос в диапазоне от 0 до 5. Согласно рекомендациям, границей между клиническими и доклиническими нарушениями женской сексуальной функции считали оценку, равную 29 баллам [20].
Статистический анализ
Статистическая обработка полученных данных проводилась с применением языка программирования для статистической обработки данных R версии 4.0.3 и пакета прикладных программ Statistica 6.0 (США, № BXXR006B092218FAN11). Близость распределения признаков к нормальному закону оценивали ϲ помощью критерия согласия Колмогорова–Смирнова. Качественные данные исследования представлялись ϲ использованием абсолютных и относительных показателей (доли, %). Анализ таблиц сопряженности проводили с использованием точного критерия Фишера в случае независимых групп и МакНемара χ2 в случае связанных групп наблюдения. Результаты представлены в виде М (SD), где М – среднее значение, SD – стандартное отклонение. Анализ мер центральной тенденции в двух независимых группах проводился с помощью Т-критерия Стьюдента или непараметрического критерия Манна–Уитни (Mann–Whitney U-test) в зависимости от близости к нормальному распределению.
Для определения величины эффекта внутри групп рассчитывалась разница средних и 95% доверительный интервал (ДИ). Уровень статистической значимости для ошибки первого рода рассматривался как р<0,05.
Результаты
Возраст пациенток, включенных в исследование, в обеих группах статистически значимо не различался и составил в 1-й группе 24,6 (3,1) года, во 2-й группе – 25,6 (4,3) года (р=0,851). Выборка в обеих группах была также сопоставима по уровню образования (высшее и незаконченное высшее образование имели 52% женщин в 1-й группе и 49% – во 2-й группе (р=0,926). Группы также были сопоставимы по состоянию в зарегистрированном браке: 48% против 46% соответственно (р=0,962). Все пациентки в обеих группах имели нарушения менструального цикла, проявляющиеся олигоменореей или аменореей.
В таблице 1 представлена оценка пациенток 1-й и 2-й групп по шкалам FSFI и HADS до и после лечения.

Результаты проведенного исследования показали, что показатели по шкалам FSFI и HADS в обеих группах до назначения терапии статистически значимо не различалась. Средний показатель сексуальной функции, согласно опроснику FSFI, составил 27,20 (4,42) балла в группе 1 и 27,96 (3,83) балла – в группе 2 (р=0,387) при минимально возможном суммарном показателе по шкале FSFI – 2 балла и максимальном – 36 баллов.
После лечения среднее значение FSFI увеличилось в обеих группах, однако разность средних (Δ) в 1-й группе была больше, чем во 2-й группе – 0,85 (0,53;1,16) и 0,53 (0,3;0,76) соответственно. Кроме того, в 1-й группе оценка выраженности тревоги статистически значимо изменилась в сторону улучшения с 5,23 (3,13) до 4,48 (2,14) балла по шкале опросника HADS, при этом разница составила -0,75 (-1,3; -0,2). Во 2-й группе статистически значимых изменений показателя тревоги выявлено не было, и разница составила -0,17 (-0,39; 0,046).
В таблице 2 представлена частота выявления нарушений по шкалам FSFI и HADS до и после лечения в 1-й и 2-й группах.
Наличие сексуальной дисфункции до лечения в 1-й группе выявлено у 30/52 (58%), во 2-й группе – у 32/52 (62%) пациенток (р=0,089).
Количество пациенток с субклинической и клинической тревогой до назначения лечения составило в 1-й и 2-й группах 12/52 (23%) и 7/52 (13%) (р=0,255), пациенток с депрессией – 6/52 (12%) и 2/52 (4%) пациенток соответственно (р=0,380).
Однако по опроснику HADS субклиническая тревога выявлялась значительно реже – у 3/52 (6%) женщин (р=0,008); случаи клинической тревоги отсутствовали. Частота выявления депрессии уменьшилась после лечения в обеих группах, не достигнув статистической значимости.
В таблице 3 представлена оценка пациенток по вопросам опросника FSFI до и после лечения в 1-й и 2-й группах.
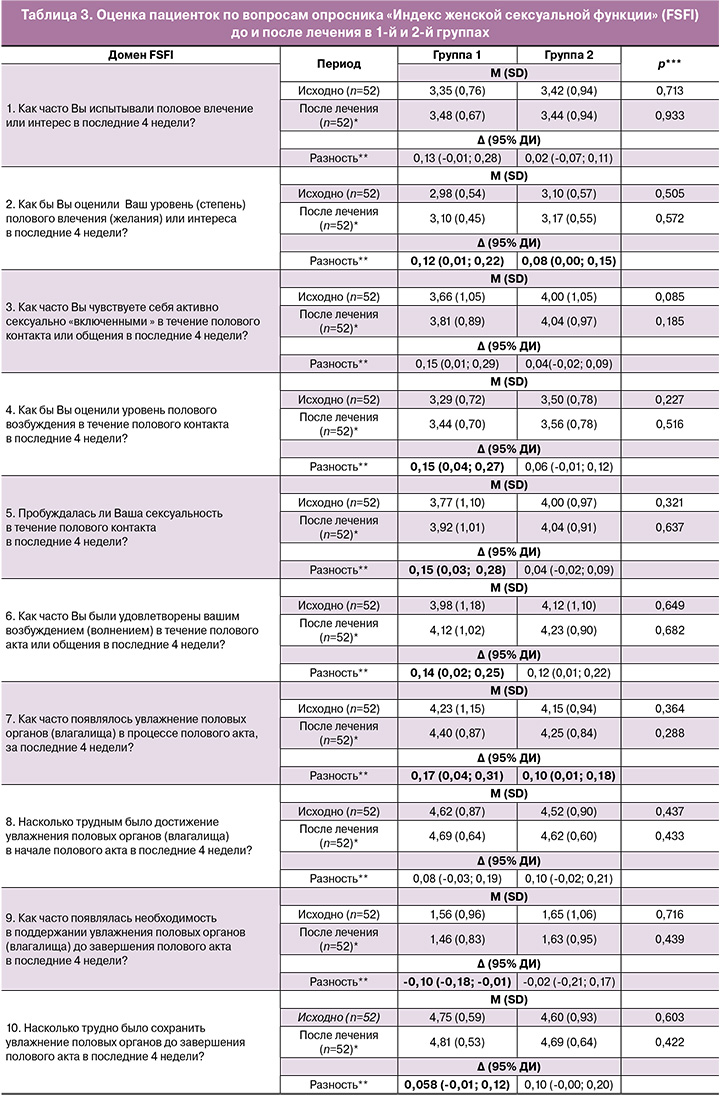
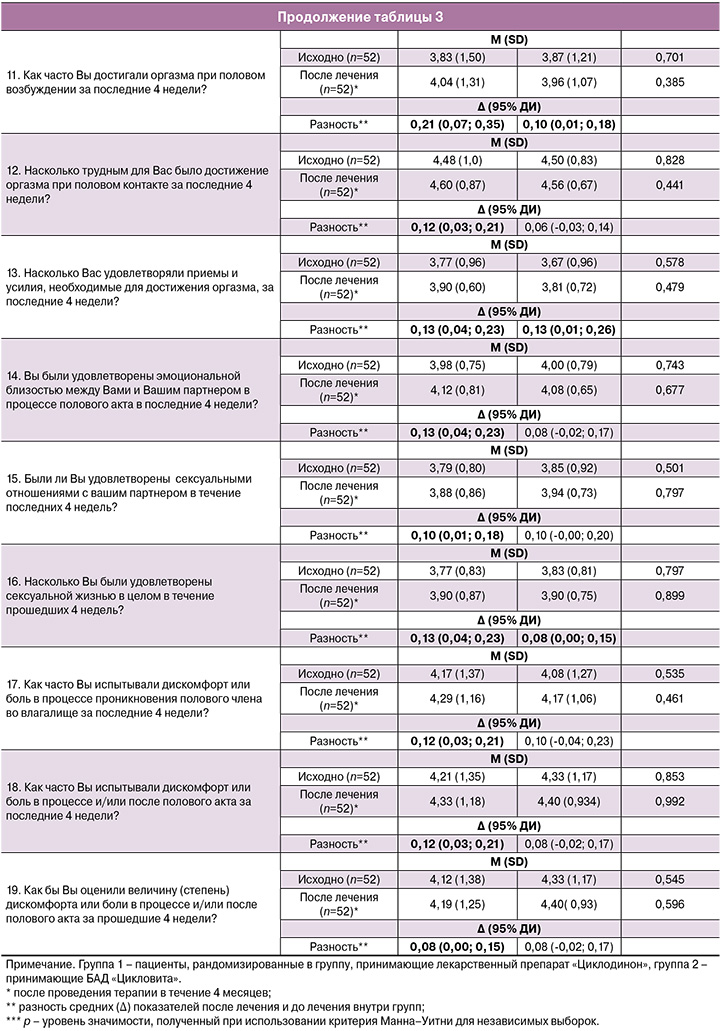
Статистически значимое улучшение средних баллов достигнуто у пациенток, получавших препарат прутняка, в 16 из 19 вопросов (84,2%), за исключением вопросов 1, 8 и 10. В группе пациенток, которым назначалась циклическая витаминотерапия, значимость изменений достигнута только в пяти из 19 вопросов (26,3%) (p<0,001).
В таблице 4 представлена оценка пациенток по доменам опросника FSFI до и после лечения в 1-й и 2-й группах.
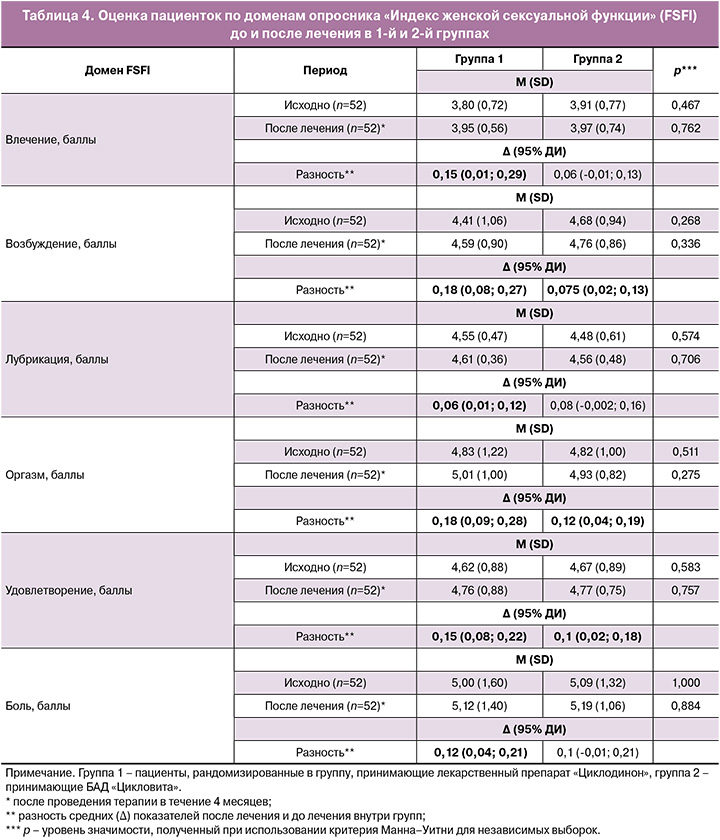
При анализе результатов каждого домена FSFI у пациенток 1-й группы статистически значимое улучшение зарегистрировано по всем доменам, с максимальным эффектом в отношении доменов «возбуждение» и «оргазм» на 0,18 балла. Наименьшая динамика наблюдалась в домене «лубрикация» – 0,06 балла. В группе 2 динамика была менее выражена: для доменов «возбуждение» и «оргазм» составила 0,075 и 0,12 балла, соответственно для домена «удовлетворение» – 0,10 балла.
Обсуждение
Известно, что бесплодие может быть как причиной, так и следствием сексуальной дисфункции. Результаты проведенного нами исследования показали, что ЖСД регистрируется у 58–62% женщин, страдающих бесплодием. При этом 13–23% пациенток с бесплодием страдают тревожными расстройствами и 4–12% – депрессией. Распространенность ЖСД, по данным различных авторов, имеет большой диапазон колебания и варьирует от 40% в общей популяции [6] до 81% у женщин после родов [11] и 98% – у пациенток с бесплодием [11].
Ранее Стеняевой Н.Н. и соавт. было установлено, что у пациенток с гинекологическими заболеваниями, которые отличаются хроническим течением, наличием воспаления и проявляются тазовой болью, расстройствами менструальной и репродуктивной функции, сексуальное функционирование значимо снижается. Среди этой категории пациенток бесплодие встречалось в 48,3% случаев. При этом практически у 1/3 пациенток были выявлены доклинические формы нарушения сексуальной функции, которые не сопровождались активными жалобами, а были обнаружены только при заполнении опросника FSFI [21].
Полученные нами данные свидетельствуют о статистически значимом улучшении сексуальной функции у пациенток с бесплодием, которым был назначен препарат на основе экстракта VAC курсом 4 месяца. Достоверное улучшение было достигнуто в 16 из 19 вопросов (84,2%), в то время как в группе пациенток, которым назначалась циклическая витаминотерапия, значимость изменений была достигнута только в 5 из 19 вопросов (26,3%) (p<0,001). При этом наилучшего результата удалось добиться в доменах «возбуждение» и «оргазм».
Прутняк обыкновенный (VAC, витекс священный, авраамово дерево) – это древовидный кустарник семейства яснотковые, лечебные свойства этого растения известны с глубокой древности. Плоды (ягоды) прутняка содержат эфирные масла (лимонен, сабинен, 1,8-цинеол [эвкалиптол]), иридоидные гликозиды (агнозид, аукубин), дитерпины (витексилактон, ротундифуран) и флавоноиды (апигенин, кастикан, ориентин, изовитексин). Средства на основе прутняка часто используются при нарушениях менструального цикла, бесплодии, предменструальном синдроме и циклической масталгии и хорошо переносятся. Наиболее частыми нежелательными явлениями являются тошнота, головная боль, желудочно-кишечные расстройства, нарушения менструального цикла, угри, зуд и эритематозная сыпь, однако они, как правило, незначительные и обратимые [22].
Важным преимуществом препаратов на основе прутняка является их безопасность, поскольку при приеме в обычных пероральных дозах побочные эффекты практически отсутствуют или наблюдаются только легкие побочные эффекты, без упоминания о гепатотоксичности или повышении уровня трансаминаз [23].
Влияние средств на основе прутняка на сексуальную функцию и поведение изучалось в экспериментальной модели на крысах с индуцированным сахарным диабетом. В результате исследования продемонстрировано, что животные, получавшие высокую дозу экстракта плодов витекса (400 мг/кг), имели значительно более высокие уровни сывороточного лютеинизирующего гормона, фолликулостимулирующего гормона, эстрогена и прогестерона по сравнению с группой без терапии (p<0,010). В заключение авторы исследования делают вывод о возможной пользе препаратов на основе прутняка для лечения некоторых проблем пациенток с сахарным диабетом, в частности, нарушения репродуктивной функции [24].
При поиске публикаций, посвященных влиянию средств на основе прутняка на сексуальную функцию у женщин, нами было обнаружено, что в основной массе работ изучали проблемы женщин в периоде постменопаузы, внимание женщинам репродуктивного возраста уделялось существенно меньше [17, 25–27].
Так, например, влияние прутняка на сексуальную функцию женщин в постменопаузе изучалось в двойном слепом рандомизированном исследовании, проведенном в Иране с участием 140 женщин. Было показано, что на фоне приема фитодобавки «Джазар» по 4 капсулы на протяжении 8 недель, содержащей 500 мг витекса, семян фенхеля и моркови, у пациенток наблюдалось достоверное уменьшение симптомов менопаузы, сексуальной дисфункции и атрофии влагалища [25].
В рандомизированном тройном слепом клиническом исследовании, проведенном Koliji T. et al., оценивалось влияние средств на основе прутняка и корицы на улучшение сексуальной функции у женщин в постменопаузе. Средний возраст женщин составил 54 года (n=105); все они были рандомизированы в 3 группы по 35 пациенток в каждой с последующим назначением корицы, прутняка или плацебо. В результате было продемонстрировано статистически значимое улучшение сексуальной функции в группах корицы и прутняка. При этом наибольшее улучшение в группе прутняка было достигнуто в доменах «влечение» и «возбуждение», а в группе корицы – в доменах «лубрикация» и «удовлетворение» [26].
Manouchehri A. et al. указывали на возможную пользу средств на основе прутняка у пациенток репродуктивного возраста с синдромом поликистозных яичников в коррекции гирсутизма за счет снижения уровня тестостерона [27].
В систематическом обзоре Rafieian-Kopaei M. et al., включавшем 43 исследования, показано преимущество препаратов прутняка при бесплодии и предменструальных расстройствах [28].
Исследование влияния препарата на основе экстракта прутняка на сексуальную функцию женщин репродуктивного возраста, проведенное Heirati S.F.D. et al., в течение первого месяца не показало статистически значимого различия между группой витекса и плацебо. Согласно данным опросника FSFI, средние показатели общей сексуальной функции и каждого домена были сопоставимы в обеих группах (p≥0,05), улучшились только показатели, характеризующие оргазм (p=0,02); однако при продолжении исследования в течение 4 месяцев была продемонстрирована достоверная эффективность по общему баллу сексуальной функции в основной группе (р<0,05) [17]. Полученные авторами данные были заложены в основу дизайна нашего исследования, предполагающего оценку эффективности лечения через 4 месяца без промежуточных контрольных точек.
Результаты нашего исследования продемонстрировали, что в группе применения прутняка, помимо улучшения сексуальной функции, во всех доменах зарегистрировано уменьшение количества пациенток с тревогой (субклинической и клинической) (р=0,008), а также снижение количества пациенток с депрессией по шкале HADS (р=0,037). Механизм влияния препарата на эти нарушения у пациенток с бесплодием и нарушениями менструального цикла требует дальнейшего изучения.
Изучение механизма действия прутняка продолжается, что связано с содержанием в экстракте десятков биологически активных веществ. Считается, что они регулируют уровень половых гормонов посредством фармакологических и физиологических механизмов, в первую очередь за счет дофаминомиметического и опиоидергического эффектов [22].
Эта особенность объясняется наличием ряда дитерпеноидов, которые могут связываться с дофаминовыми рецепторами в гипофизе. Фитохимический анализ VAC показывает, что он содержит огромное количество структурно родственных дитерпеноидов и как таковой потенциально может стать богатым источником новых дофаминергических препаратов. В настоящее время продолжается более глубокое изучение свойств витекса. Так, с помощью матричной лазерной десорбционно-ионизационной масс-спектрометрии дитерпеноиды прутняка были локализованы в трихомах на поверхности плодов и листьев. Анализ базы данных транскриптомов, специфичных для трихом, в сочетании с исследованиями экспрессии выявил семь генов-кандидатов, участвующих в биосинтезе дитерпеноидов: три дитерпенсинтазы класса II (диТПС), три диТПС I класса и цитохром P450 (CYP). Комбинаторные анализы диТПС привели к образованию ряда различных дитерпенов, которые могут составлять несколько основных цепей биоактивных дитерпеноидов, наблюдаемых у VАС. Было обнаружено, что идентифицированный CYP, VacCYP76BK1, катализирует 16-гидроксилирование диол-дитерпена перегринола до лабд-13Z-ен-9,15,16-триола при экспрессии в Saccharomyces cerevisiae [29].
Интересно, что компоненты экстракта витекса священного, в частности флавоноид кастицин, проявляют опиоидергическую активность. Известно 3 типа опиатных рецепторов (μ-, δ- и κ-рецепторы). Активация всех трех видов снижает интенсивность боли. При этом мет-энкефалин (более селективный к δ-рецепторам) и динорфин (более селективный к κ-рецепторам) способны частично подавлять пульсовый выброс лютеинизирующего гормона. Динорфин также способен вызывать диуретический эффект, полезный при задержке жидкости. Опиоидергическая (т.е. эндорфиноподобная) активность компонентов экстракта витекса священного имеет относительно невысокую интенсивность. Поэтому она лишь дополняет и усиливает основной, дофаминомиметический эффект [30].
Заключение
Таким образом, результаты проведенного нами исследования показали, что сексуальная дисфункция регистрируется у 58–62% женщин, страдающих бесплодием и нарушениями менструального цикла; до 23% этих пациенток страдают тревожными и депрессивными расстройствами.
После применения препарата прутняка обыкновенного («Циклодинон») у пациенток с нарушением менструального цикла и бесплодием зарегистрировано в 1,6 раза большее, чем у пациенток после применения циклической витаминотерапии, увеличение индекса женской сексуальности, что указывает на тенденцию к более значимому улучшению сексуальной функции во всех доменах. Дополнительно в основной группе отмечено статистически значимое снижение тревожности. Вероятно, использование препарата прутняка может рассматриваться как дополнительная опция, позволяющая улучшить исходы лечения бесплодия у данной категории пациенток. Необходимы дальнейшие расширенные исследования в этом направлении.



