Гипоксически-ишемическая энцефалопатия (ГИЭ) является основной причиной неврологических нарушений у доношенных новорожденных. Частота ГИЭ колеблется от 1 до 8 на 1000 новорожденных в развитых странах и достигает 26 на 1000 новорожденных – в слаборазвитых [1].
Для прогнозирования последствий гипоксической травмы изучается широкая панель биомаркеров, однако достоверный метод прогнозирования все еще не разработан [2]. В пользу диагноза ГИЭ свидетельствует неврологическая симптоматика, низкая оценка новорожденного по шкале Апгар, метаболический ацидоз, сопутствующее повреждение почек, печени и/или сердца плода [1, 3]. Наиболее распространенными инструментальными методами диагностики на сегодняшний день являются электроэнцефалография (ЭЭГ), нейросонография (НСГ) и магнитно-резонансная томография (МРТ) структур головного мозга, однако использование данных методик для оценки риска и прогнозирования отдаленных последствий гипоксической травмы головного мозга у детей ограничено в связи с недостаточным объемом накопленных научных данных [4].
Единственным методом, позволяющим снизить влияние гипоксической травмы головного мозга на отдаленные исходы, является терапевтическая гипотермия. Однако, по данным систематического обзора Douglas-Escobar M. и соавт. [3], применение терапевтической гипотермии приводит к снижению отдаленных неврологический последствий ГИЭ только у 1 из 8 новорожденных. Таким образом, несмотря на современные достижения в области диагностики и лечения ГИЭ, основные усилия должны быть направлены на предикцию ГИЭ с целью ее профилактики.
Кардиотокография (КТГ) в родах позволяет косвенно оценить насыщение кислородом крови плода. Нормальный тип КТГ указывает на отсутствие гипоксии плода в родах; персистирующий патологический тип кривой – на снижение оксигенации и развитие метаболического ацидоза, что приводит к повреждению структур головного мозга и развитию ГИЭ у новорожденного. В зависимости от течения (острая, подострая, нарастающая) и продолжительности гипоксии плода по данным КТГ имеется взаимосвязь с характером повреждения головного мозга по данным МРТ. При постепенном или умеренном снижении кровотока головного мозга происходит перераспределение кровотока от коры, полушарий и водопровода головного мозга к стволу, мозжечку и базальным ганглиям (зонам с высоким метаболизмом). Однако при остром возникновении гипоксии компенсаторного перераспределения кровотока не происходит, что приводит к повреждению структур головного мозга. При нормальном типе КТГ в родах причинами ГИЭ могут быть метаболические нарушения, инфекционный процесс или гипотензия у плода вследствие компрессии сосудов пуповины [5, 6].
Вместе с тем, КТГ является недостаточно специфичным методом, и, по данным Кокрановского исследования, непрерывная электронная регистрация сердцебиения плода в родах не имеет преимуществ в снижении частоты церебрального паралича и перинатальной смертности, но ведет к увеличению частоты оперативного родоразрешения [7]. Избежать неоправданного оперативного вмешательства и, в то же время, не пропустить прогрессирующую гипоксию, возможно только при правильной интерпретация параметров КТГ [5, 6]. Однако, несмотря на разработку новой классификации FIGO, остается дискуссионным значение изменений сердечного ритма на КТГ-кривой (базальный ритм, вариабельность, акцелерации, децелерации) в прогнозировании ГИЭ [8].
В связи с этим, целью данного исследования стало определение КТГ критериев риска развития ГИЭ различной степени тяжести.
Материалы и методы
Исследование проведено на базе ФГБУ НМИЦ АГП им. В.И. Кулакова Минздрава России. В исследование случай–контроль были включены 180 пациенток и их новорожденных детей. Из них 36 детей с ГИЭ вошли в основную группу. Основная группа была дополнительно разделена в соответствии с тяжестью ГИЭ на подгруппы: I (22 пациентки), II (8), III (6). Контрольная группа с отсутствием ГИЭ у новорожденных была подобрана случайным образом в соотношении 4:1.
Интерпретацию КТГ-кривых после рождения ребенка проводил один специалист. При интерпретации КТГ-кривых исход родов не был доступен для специалиста (слепая интерпретация). Анализировали 90 мин КТГ-кривой, предшествующие рождению ребенка. Оценивали базальный ритм, вариабельность, наличие акцелераций, наличие и характер децелераций, их число и продолжительность КТГ-кривой с децелерациями. Подсчитывали число сокращений матки за 10 мин. Характеристику показателей КТГ-кривой осуществляли согласно рекомендациям FIGO от 2015 г. [5, 6]. Состояние новорожденного на 1-й и 5-й минутах жизни оценивали по шкале Апгар.
Для статистического анализа и построения графиков использовали пакет статистических программ GraphPad Prism (GraphPad Software, США) с применением t-теста для сравнения параметрических количественных данных в двух независимых группах по одному признаку, критерия Манна–Уитни для непараметрических количественных данных в двух независимых группах по одному признаку и точного теста Фишера для оценки качественных данных.
При множественном сравнении использовали one-way ANOVA с проверкой наличия тренда для сравнения параметрических количественных данных в трех независимых группах по одному признаку, критерий Крускала–Уоллиса для сравнения непараметрических количественных данных в трех независимых группах по одному признаку и теста χ2 для сравнения качественных данных. Для оценки нормальности распределения использовали обобщенный тест Д'Агостино–Пирсона на нормальность распределения.
Параметрические количественные данные представлены как среднее значение и стандартное отклонение, непараметрические количественные данные – как медиана и интерквартильный размах, качественные – как абсолютное значение и процент. Различия считали статистически значимыми при p<0,05.
Исследование было одобрено комиссией по этике ФГБУ НМИЦ АГП им. В.И. Кулакова Минздрава России.
Результаты
Средний возраст пациенток основной и контрольной групп совпадал и составил 30,1 (5,7) года. Индекс массы тела (ИМТ) пациенток составил 27,0 (4,9) и 26,9 (3,4) кг/м2 соответственно (p=0,89). Первородящими были 32 (88,9%) пациентки группы ГИЭ и 138 (95,8%) пациентки контрольной группы (p=0,12).
Все пациентки, включенные в исследование, были родоразрешены в доношенном сроке беременности. Срок беременности на момент родов в основной группе был несколько ниже и составил 39,3 (1,12) недели против 39,6 (1,12) недель в группе контроля (p=0,09).
Были родоразрешены путем операции кесарева сечения (КС) до начала родовой деятельности 1 (2,8%) пациентка группы наблюдения и 3 (2,1%) пациентки контрольной группы (p=0,59). Из пациенток, вступивших в роды, преиндукция родов была применена у 10 (31,6%) пациенток основной группы и 48 (33,3%) пациенток контрольной группы (p=0,53). Экстренное завершение родов путем операции КС потребовалось 9 (25%) пациенткам основной группы и 62 (43,1%) пациенткам группы контроля (p=0,04); вакуум-экстракция плода в основной группе встречалась чаще и составила 14 (39,0%) против 33 (22,9%) соответственно (p=0,04).
Общая частота оперативного родоразрешения не различалась между группами (p=0,7): в основной группе составила 24 (66,7%), в контрольной – 97 (67,4%).
Масса тела новорожденных не различались в группах сравнения, и в группе с ГИЭ составила 3279 (352) против 3350 (428) г – в контрольной группе (p=0,43). Длина тела новорожденных также не отличалась и в группе с ГИЭ составила 51,3 (1,8) см, в контрольной группе – 51,6 (2,3) см (p=0,59).
Оценка по шкале Апгар у новорожденных с ГИЭ была значимо ниже, чем в группе контроля. На 1-й минуте она составила 3 (2–4,25) против 7 (6–8) баллов (p<0,001), на 5-й минуте – 6 (4–6,25) против 8 (8–9) баллов соответственно (p<0,001).
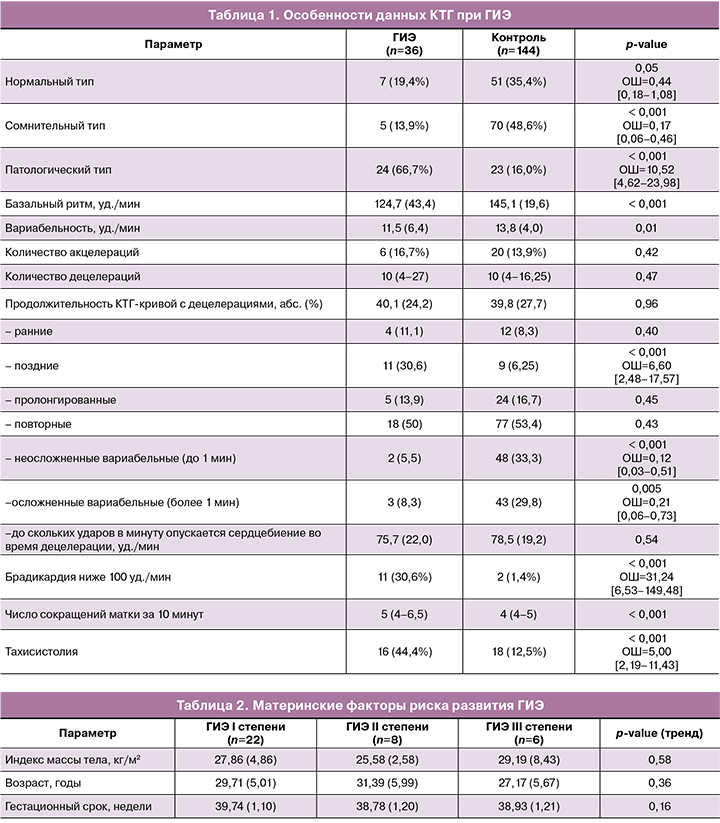
Тип КТГ-кривой был оценен как нормальный у 7 (19,4%) пациенток основной группы и 51 (35,4%) – группы контроля (p=0,05). Сомнительный тип КТГ-кривой преобладал у пациенток группы контроля – 70 (48,6%) и был отмечен у 5 (13,9%) пациенток основной группы (p<0,001; ОШ=0,17 [0,18–0,46]). Патологический тип КТГ-кривой, напротив, преобладал у пациенток основной группы 24 (66,7%) и был отмечен у 23 (16,0%) пациенток контрольной группы (p<0,001; ОШ=10,52 [4,62–23,98]).
Подробный анализ данных КТГ показал более высокую частоту поздних децелераций в основой группе (p<0,001; ОШ=6,60 [2,48–17,57]). Вариабельные неосложненные децелерации чаще встречались в контрольной группе (p< 0,001; ОШ=0,12 [0,03–0,51]), как и осложненные (p<0,005; ОШ=0,21 [0,06–0,73]) (табл. 1). Наличие брадикардии увеличивало риск развитие ГИЭ у новорожденного (p<0,001; ОШ=31,24 [6,53–149,48]). Частота маточных сокращений была выше в основной группе (p<0,001), а тахисистолия (более 5 схваток за 10 мин) была диагностирована у 16 (44,4%) пациенток основной группы и 18 (12,5%) пациенток группы контроля (p<0,001; ОШ=2,19–11,43).
Возраст и ИМТ пациенток и срок беременности на момент родоразрешения не были ассоциированы со степенью тяжести ГИЭ (табл. 2). Также не была выявлена связь между степенью ГИЭ и способом родоразрешения.
В I подгруппе (ГИЭ I степени) была родоразрешена путем операции КС до начала родовой деятельности 1 (4,5%) пациентка. Экстренное завершение родов путем операции КС потребовалось 6 (27,3%) пациенткам I подгруппы, 1 (12,5%) – II и 2 (33,3%) – III (p=0,50); путем вакуум-экстракции плода – 5 (22,7%), 4 (50%) и 3 (50%) пациенткам соответственно (p=0,06). Таким образом, 11 (33%) новорожденных с ГИЭ родились при самопроизвольных родах.
Масса и длина тела новорожденных детей не различались в группах сравнения. Так, масса новорожденных в I подгруппе составила 3156 (345,6) г, во II – 3341 (353,3) г, в III – 3379 (346,8) г (p=0,19). Длина тела новорожденных составила 51,6 (2,1), 51,1 (1,7) и 51,4 (1,7) см соответственно (p=0,86).
Оценка по шкале Апгар у новорожденных была обратно пропорциональна увеличению степени тяжести ГИЭ. На 1-й минуте она составила 4,5 (3–5), 3 (2–3,25) и 1 (1–3,25) баллов (p=0,001), на5-й минуте – 6,5 (5,75–7), 5 (4–6) и 3 (1–5,25) баллов в подгруппах I, II и III соответственно (p<0,001).
Не было выявлено связи между типом КТГ-кривой и степенью тяжести ГИЭ новорожденного. Базальный ритм, вариабельность и наличие акцелераций на КТГ-кривой не были связаны с тяжестью ГИЭ.
При подробном анализе данных КТГ (табл. 3) было показано, что степень тяжести ГИЭ связана с количеством повторных поздних децелераций, а также с продолжительностью КТГ-кривой с наличием децелераций. Так, среднее число децелераций было прямо пропорционально связано со степенью тяжести ГИЭ – в I подгруппе составило 10 (4–14,25), во II – 7 (1,75–25,25) в III – 45,0 (38–52), p=0,02. С увеличением количества поздних децелераций возрастала и степень тяжести ГИЭ (p=0,03). Продолжительность КТГ-кривой с наличием децелераций также была прямо пропорционально связана со степенью тяжести ГИЭ и составила 36,1 (20,4), 40,8 (24,9) и 59,0 (32,5) мин соответственно (p=0,05). Не было выявлено связи между степенью тяжести ГИЭ и базальным ритмом, вариабельностью, наличием акцелераций и числом маточных сокращений (табл. 3).

Особого внимания заслуживают новорожденные с ГИЭ и нормальным типом КТГ-кривой. У 5 новорожденных с нормальной КТГ-кривой в родах в раннем неонатальном периоде установлен диагноз ГИЭ легкой степени, у 2 – средней степени тяжести.
Обсуждение
В исследовании Martinez-Biarge M. и соавт. [9], единственным материнским фактором, ассоциированным с развитием ГИЭ, был срок беременности. В нашем исследовании не было выявлено связи основных антропометрических и демографических материнских факторов с риском развития гипоксии. Оценка по шкале Апгар была ожидаемо ниже в группе ГИЭ, чем у детей без ГИЭ, что подтверждает роль ишемии в развитии ГИЭ [3].
Согласно нашим данным, поздние децелерации являются единственным типом децелераций, увеличивающим риск развития ГИЭ. По мнению Graham E.M. и соавт. [10] единственным признаком КТГ-кривой, свидетельствующим о развитии ГИЭ является продолжительность КТГ-кривой с наличием поздних децелераций более 30 мин. В то же время, мы не обнаружили связи между типом КТГ-кривой и тяжестью ГИЭ. Возможно, это обусловлено относительной малочисленностью подгрупп, поскольку наличие децелераций обязательно учитывается при интерпретации данных КТГ.
Ater S.B. и соавт. [11] в своем комментарии данной статьи высказывают мнение о необходимости более тщательного анализа маточных сокращений при оценке и интерпретации КТГ-кривой. Авторы обращают внимание, что тахисистолия, сокращение времени между схватками (менее 60 с) и гипертонус матки (более 20–25 мм рт.ст. вне схватки) могут являться независимыми предикторами развития ГИЭ [12–14], в том числе – на фоне индукции родов окситоцином [13]. Мы также показали, что тахисистолия в 3,5 раза чаще встречается в группе ГИЭ.
Согласно полученным данным, наличие брадикардии значительно увеличивало риск развития ГИЭ. Хотя ни тип КТГ, ни наличие тахисистолии не были непосредственно ассоциированы со степенью тяжести ГИЭ, при более подробном анализе КТГ-кривой мы обнаружили, что продолжительность КТГ-кривой с наличием децелераций, абсолютное количество децелераций (с преобладанием поздних) повышает степень тяжести ГИЭ. При этом особого внимания заслуживает тот факт, что в 19,4% всех наблюдений группы ГИЭ тип КТГ-кривой являлся нормальным, а еще в 13,8% случаев – только сомнительным, что, вероятно, указывает на причины ГИЭ, не связанные с интранатальной гипоксией плода.
Заключение
В данной работе показана взаимосвязь между параметрами КТГ-кривой и риском развития ГИЭ. Факторами риска развития ГИЭ являются: патологический тип КТГ, снижение базального ритма и вариабельности, поздние децелерации, брадикардия и тахисистолия. Клинические проявления энцефалопатии у новорожденного при нормальном или сомнительном типе КТГ-кривой в родах позволяют предположить наличие причин, не связанных с интранатальной гипоксией плода.



