Асфиксия при рождении встречается в 6,8–20% наблюдений [1–3]. По данным ВОЗ перинатальная асфиксия занимает третье место среди причин неонатальной смертности [4]. Нарушение состояния плода встречается с частотой 15–20% всех родов; в 2–2,1% новорожденному требуется проведение реанимационных мероприятий, в 1,1–6% развивается гипоксически-ишемическая энцефалопатия [5, 6]. В Российской Федерации анте- и интранатальная гипоксия являются наиболее частой причиной мертворождения (до 80,5% и 5,0% всех случаев мертворождения в 2020 г.) [7].
Нарушение состояния новорожденного может иметь разные причины и для подтверждения гипоксии используют определение кислотно-основного состава артериальной крови пуповины, позволяющее диагностировать метаболический ацидоз. В 1999 г. Международная рабочая группа по церебральному параличу определила критерии метаболического ацидоза при рождении плода (pH<7,00 и дефицит оснований (ВЕ)≥12 ммоль/л), которые сочетаются с развитием тяжелой неврологической патологии у ребенка [8]. Некоторые исследователи используют уровень рН=7,05 как критическую границу, ниже которой диагностируется развитие метаболического ацидоза – состояния, угрожаемого по развитию тяжелых неврологический последствий для ребенка [9, 10].
Также к критериям тяжелой асфиксии при рождении относят оценку по шкале Апгар <7 на 5-й минуте [11] или ≤5 на 5-й и/или 10-й минуте и необходимость в реанимационных мероприятиях >10 минут [5, 12].
Несмотря на внедрение современных методов оценки состояния плода во время беременности и родов, на протяжении последних 30 лет частота гипоксически-ишемической энцефалопатии и церебрального паралича не снижается и даже демонстрирует тенденцию увеличения [13]. В связи с этим по-прежнему остается актуальным поиск предикторов гипоксии плода, которые позволят прогнозировать ее развитие для разработки мер профилактики и выработки соответствующей акушерской тактики.
Целью нашей работы явилось: определение факторов риска, связанных с развитием гипоксии плода в родах.
Материалы и методы
Проведено проспективное когортное исследование клинико-анамнестических данных, течения беременности и родов у 657 женщин, которые были родоразрешены в НМИЦ АГП им. академика В.И. Кулакова МЗ РФ в 2017–2020 гг. Критериями включения являлись: одноплодная беременность в доношенном сроке, возраст 18 лет и старше. Критерии не включения: врожденные пороки развития плода, недоношенный срок беременности, многоплодие, неправильные положения плода, рубец на матке, острая фаза или обострение хронических инфекционных заболеваний, тяжелая экстрагенитальная или генитальная патология у матери (декомпенсированные соматические заболевания, трансплантированные органы, онкологические заболевания). Исследование одобрено Комитетом по этике НМИЦ АГП им. академика В.И. Кулакова Минздрава России.
Диагноз гипоксии плода при рождении верифицировали путем определения кислотно-основного состава артериальной пуповинной крови. Критериями ацидоза служили уровень рН<7,12 и/или BE≥12,4 ммоль/л. Гипоксия плода при рождении имела место в 119 наблюдениях – они составили основную группу. 538 наблюдений без гипоксии плода составили контрольную группу. Для выявления факторов риска проведено сравнение возраста, антропометрических показателей пациенток, данных соматического анамнеза, осложнений беременности путем сбора анамнеза, изучения амбулаторных карт и физикального обследования, а также особенностей родового акта и методов родоразрешения в процессе ведения родов, оценки результатов мониторного контроля за состоянием плода и определения кислотно-основного состава крови.
Статистический анализ
Все результаты клинических наблюдений и лабораторно-инструментальных методов исследования были проанализированы при помощи программных пакетов статистической обработки GraphPad Prism 6 (GraphPad Software, USA). Для определения нормальности распределения использовали обобщенный тест Д'Агостино–Пирсона. Параметрические данные представлены как среднее значение (стандартное отклонение). Непараметрические данные представлены как медиана (интерквартильный размах). Качественные данные представлены как абсолютное значение (n) и доля (%). Для сравнения величин использовали t-test (для параметрических данных), критерий Манна–Уитни (для непараметрических данных) и точный тест Фишера с расчетом относительного риска (ОР) (для качественных данных). Различия считали статистически значимыми при р<0,05.
Результаты
Как показали полученные результаты, возрастной состав сравниваемых групп значимо не различался, за исключением группы до 20 лет, в которой гипоксия плода отмечена чаще (2 (0,37%) против 4 (3,36%), р=0,01). Несмотря на отсутствие различий в возрасте, исходный вес в среднем был выше и ожирение встречалось чаще при гипоксии плода (63,9 (0,4) кг против 70,8 (2,3) кг, р<0,015; 67 (12,5%) против 31 (26%), р<0,0001). Нами не обнаружено различий в частоте экстрагенитальных заболеваний между группами. Вместе с тем, полипы и гиперпластические процессы эндометрия в анамнезе чаще встречались у пациенток с гипоксией плода (15 (2,8%) против 8 (6,7%), р=0,04).
При оценке паритета родов обнаружено, что как в группе контроля, так и группе гипоксии плода преобладали первородящие женщины (470 (87,3%) и 94 (78,9%)). Не было различий в частоте внематочной беременности, искусственного и самопроизвольного прерывания беременности на ранних сроках, за исключением неразвивающейся беременности, которая чаще имела место в группе гипоксии плода (51 (9,5%) против 22 (18,5%), р<0,05).
В группе женщин, роды у которых осложнились гипоксией плода, чаще имела место анемия в первой половине беременности, гестационный сахарный диабет, инфекции экстрагенитальной локализации (ангина, ОРВИ, пневмония, пиелонефрит), отеки беременных, а также плацентарная недостаточность и задержка роста плода (таблица). В то же время угроза преждевременных родов, гипертензивные осложнения и инфекции нижнего отдела полового тракта во время беременности (аэробный или кандидозный вагинит, бактериальный вагиноз) не были ассоциированы с последующим развитием гипоксии плода во время родов.
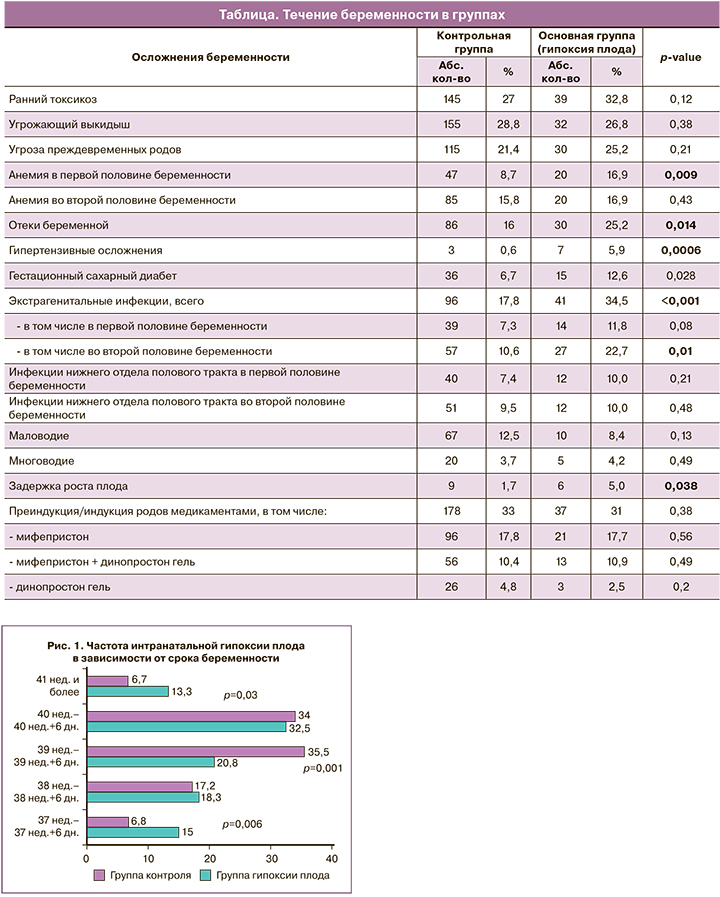
Индукция родов встречалась с одинаковой частотой в обеих группах (178 (33%) и 37 (31%)). Гипертензивные осложнения беременности, как показание к индукции родов, чаще отмечены в группе гипоксии плода (3 (0,6%) против 7 (5,9%,) р=0,0006), по другим показаниям различий не было. Также не было обнаружено связи между медикаментозными методами подготовки шейки матки к родам и гипоксией плода (таблица).
Срок родов 37–38 недель и 41 неделя и более значимо чаще встречался в группе гипоксии плода, тогда как срок 39–40 недель – в контрольной группе (рис. 1). Отношение шансов интранатальной гипоксии плода в сроке 37–37 недель 6 дней составило ОР=1,98 (95% ДИ 1,18;3,38), р=0,009; в сроке 41 неделя и более – ОР=1,97 (95% ДИ 1,15;3,36), р=0,013; в сроке 39–39 недель 6 дней – ОР=0,52 (95% ДИ 0,36; 0,76), р<0,0006.
Среди интранатальных факторов не было различий в частоте несвоевременного излития вод (9,9 и 13,4%), амниотомии (15,1 и 9,2%), эпидуральной аналгезии (51,3 и 55,5%), средней длительности безводного промежутка (306 и 276 минут). Вместе с тем, слабость родовой деятельности и родостимуляция окситоцином значимо чаще имели место в группе гипоксии плода (рис. 2). Несмотря на более высокую частоту слабости родовой деятельности, средняя продолжительность родов была короче у женщин основной группы и составила 408 минут (336–504) против 438 минут (327–576) в контрольной группе, р=0,015. Избыточно высокая частота схваток (тахисистолия от 6 до 9 схваток за 10 минут) значительно чаще встречалась в группе гипоксии плода: ОР=7,12 (95% ДИ 4,8;10,5), р<0,0001 (рис. 2). Шансы развития гипоксии плода при наличии слабости родовой деятельности составляли ОР=3,17 (95% ДИ 2;5), р<0,0001, родостимуляции окситоцином – ОР=1,6 (95% ДИ 1,3;2), р<0,0001.

Следует отметить, что патологический тип кардиотокограммы (КТГ) (3 категория) отмечен в большинстве наблюдений гипоксии плода (79,0% по сравнению с 7,4% в группе контроля, р<0,001) (рис. 2). Подозрительный тип (2 категория) встречался с одинаковой частотой в 20,2%, нормальный тип имел место в 81,6 и 1,7% наблюдений.
Общая частота оперативного родоразрешения в группах не различалась, однако частота вакуум-экстракции плода была значимо выше в группе гипоксии плода (88 (16,4%) против 33 (27,7%), р=0,003) (рис. 2).
Все дети родились живыми. Не было различий в антропометрических показателях новорожденных. Вес составлял в среднем 3347,4 (414,8) и 3334,30 (381,65) г, р=0,90; рост – 51,7 (2,2) и 51,3 (2,04) см, р=0,06. Не было различий в частоте крупных (30 (5,5%) против 3 (2,5%), р=0,118) и маловесных плодов (12 (2,2%) против 4 (3,3%), р=0,47). Медиана оценки по шкале Апгар, закономерно была ниже в группе гипоксии плода и составляла на 1-й минуте 8 баллов (7–8) против 4 (3–6), р<0,001; на 5-й минуте 9 баллов (8–9) против 7 (5–8), р<0,001.
Построение моделей прогнозирования интранатальной гипоксии плода показало, что такие факторы, как возраст до 20 лет, ожирение, гиперпластические процессы эндометрия и неразвивающиеся беременности в анамнезе обладают высокой чувствительностью, но низкой специфичностью. Также низкая специфичность у модели на основе факторов осложненного течения беременности: анемии, гестационного сахарного диабета, перенесенных во время беременности инфекций, отеков и задержки роста плода. Такие клинические интранатальные факторы, как срок беременности на момент родоразрешения 41 неделя и более, слабость родовой деятельности, родостимуляция окситоцином и тахисистолия сочетаются с высокой чувствительностью и умеренной специфичностью. Дополнение этой модели наличием патологического характера КТГ-кривой показало как высокую чувствительность, так и высокую специфичность.
Обсуждение
Гипоксия плода развивается вследствие нарушения кровотока и газообмена в плодово-плацентарной системе и является триггером каскада изменений в функционировании его органов и систем. Гипоксическому повреждению наиболее подвержены клетки нервной системы. В зависимости от тяжести гипоксемии/гипоксии, на начальных этапах включаются компенсаторные реакции сердечно-сосудистой системы с перераспределением кровотока. Однако тяжелое и продолжительное нарушение газообмена приводит к необратимому повреждению клеток головного мозга, внутрижелудочковым кровоизлияниям, что проявляется гипоксически-ишемической энцефалопатией после рождения, развитием церебрального паралича и может завершиться летальным исходом [14].
Возраст, данные анамнеза и антропометрические показатели являются доступными средствами прогнозирования исхода при многих патологических состояниях, так как отражают функционирование систем организма и указывают на имевшиеся ранее нарушения, которые могут вновь проявиться на фоне повышенной нагрузки или стресса. В нашей серии наблюдений с гипоксией плода был ассоциирован слишком молодой возраст беременной, данные анамнеза, указывающие на перенесенные ранее гиперпластические процессы эндометрия, неразвивающуюся беременность и ожирение. Фактор молодого возраста имел ограниченное значение, так как подавляющее большинство женщин были в возрастной группе между 25 и 35 годами, и только 3% менее 20 лет. Ожирение является полиэтиологическим по природе, предрасполагает к развитию и сопровождает большое количество патологических состояний, что делает этот фактор низко специфичным. Неразвивающаяся беременность является фактором, который теоретически связан с гиперпластическими процессами эндометрия, так как ее причиной часто является исходная неполноценность эндометрия.
Несмотря на различия вышеуказанных факторов и разницу в их происхождении, тем не менее, именно незрелость и/или неполноценность эндометрия, которая часто встречается при этих состояниях, объединяет их в одну группу.
По нашим данным не было различий в группах в зависимости от паритета родов. В то же время по данным исследования Locatelli A. et al. (2020) [5], первые роды являются наиболее распространенным фактором риска асфиксии при рождении, что авторы связывают с более высокой частотой нарушений плацентации, а также более длительным течением родов и связанным с этим повышением количества наблюдений инфицирования плода, оперативного родоразрешения. Вместе с тем, они указывают на результаты исследования Liljestrom L. et al. (2018) [15], которые показали более высокую частоту гипоксически-ишемической энцефалопатии у повторнородящих женщин, что, по их мнению, свидетельствует, что интранатальные осложнения могут являться причиной тяжелых осложнений также у женщин группы низкого риска.
Логично предположить, что осложненное течение беременности может быть причиной осложненного течения родов. По результатам нашего исследования, значимыми факторами риска оказались анемия, гестационный сахарный диабет, отеки беременных и экстрагенитальные инфекционные заболевания. Обращает внимание, что с гипоксией плода в родах сочеталась анемия, которая имела место в первой половине беременности, тогда как во второй половине такой связи не было. Сильную положительную связь имеет бактериальная или вирусная инфекция в любом сроке беременности, но наиболее четко зависимость проявляется во второй ее половине.
Несмотря на значимую связь вышеуказанных факторов и интранатальной гипоксии, тем не менее, они носят не прогностическое, а патогенетическое значение, объясняя возможные механизмы нарушения во время плацентации или повреждения плаценты в более поздние сроки беременности. Специфичность этих факторов в прогнозировании низкая, так как они могут сочетаться с широким спектром других осложнений. Так специфичность антенатальных факторов риска по данным анализа составила только 0,008–0,133. Таким образом, использовать эти факторы для прогнозирования гипоксии плода нецелесообразно. В то же время, если такие факторы, как возраст или ожирение являются не модифицируемыми, по крайней мере, на этапе беременности, то своевременное выявление и коррекция анемии и гестационного диабета, предупреждение инфекций имеет большое профилактическое значение для снижения частоты гипоксии плода.
В отличие от антенатальных факторов риска, интранатальные чаще всего можно рассматривать, как модифицируемые. К ним относятся: срок родов 41 неделя и более, слабость родовой деятельности, родостимуляция окситоцином, тахисистолия. Как свидетельствуют полученные нами результаты, шансы развития гипоксии плода в родах на сроке беременности 39 недель–39 недель 6 дней в 2–2,5 раза ниже, чем в 37 недель–37 недель 6 дней и 41 неделя и более.
Нами не выявлено связи между медикаментозными методами подготовки к родам (мифепристон, динопростон) и гипоксией плода. Кокрановский обзор 2020 г. показал, что по сравнению с выжидательной тактикой, индукция родов в доношенном сроке беременности сочетается со снижением перинатальной смертности, частоты кесарева сечения и госпитализаций новорожденных в отделение интенсивной терапии [16]. В связи с выше изложенным, и учитывая, что срок родоразрешения 39 недель–39 недель 6 дней имеет протективный эффект в отношении гипоксии плода, расширение показаний к индукции родов в данном сроке беременности будет способствовать уменьшению частоты данного осложнения.
Другими модифицируемыми факторами риска гипоксии плода являются взаимосвязанные слабость родовой деятельности, родостимуляция окситоцином и маточная тахисистолия. Регулирование этих факторов лежит в плоскости тактики ведения родов. Как известно, в момент схватки перфузия крови в межворсинчатое пространство снижается, и отток венозной крови замедляется. Вследствие повышения давления в межворсинчатом пространстве замедляется кровоток в капиллярах ворсин. Эти механизмы нарушают газообмен плода, который компенсирует недостаток кислорода высоким уровнем фетального гемоглобина, перераспределением кровообращения, а также замедлением сердечного ритма [17].
Неоправданно раннее установление диагноза слабости родовой деятельности и агрессивная родостимуляция высокими дозами окситоцина ведут к тахисистолии. При этом чрезмерно сильные, продолжительные и частые схватки не позволяют восстановить оксигенацию плода, развивается гипоксемия и гипоксия. Интересно, что до 40% наблюдений тахисистолии, могут приводить к гипоксии плода при отсутствии других типичных отклонений показателей КТГ [5]. Вышеперечисленные клинические интранатальные факторы риска гипоксии плода следует учитывать при ведении родов, так как они имеют не менее важное значение, чем патологический характер КТГ, который не столько является фактором риска гипоксии, сколько признаком ее развития. Так, добавление патологического типа КТГ в модель прогнозирования гипоксии плода повышает ее специфичность, тогда как чувствительность уже не меняется. Кроме этого, следует учитывать, что в каждом пятом наблюдении асфиксии при рождении на интранатальном этапе не было зарегистрировано патологического характера КТГ-кривой.
Заключение
Несмотря на наличие антенатальных факторов риска, их низкая специфичность не позволяет использовать для прогнозирования интранатальной гипоксии плода. К интранатальным факторам риска, ассоциированным с гипоксией плода, относятся срок беременности на момент родоразрешения 37–38 недель, 41 неделя и более, слабость родовой деятельности, родостимуляция окситоцином и тахисистолия. При наличии клинических интранатальных факторов риска отсутствие патологического типа КТГ не гарантирует рождение ребенка без асфиксии. В значительной части наблюдений интранатальные факторы риска являются модифицируемыми. Рациональный выбор срока и метода индукции родов, бережная тактика ведения родов являются резервом снижения частоты гипоксии плода в родах.



