Симптомы вульвовагинальной эпителиальной атрофии (ВВА) беспокоят более 50% женщин в постменопаузе. Наиболее частыми жалобами являются сухость влагалища, диспареуния и выделения, что оказывает негативное влияние на сексуальное здоровье и общее качество жизни женщин [1]. На сегодняшний день нет однозначных данных, что же является первопричиной этих жалоб: атрофические изменения слизистой влагалища или изменение микробиоты влагалища на фоне сниженного уровня эстрогенов. Флора влагалища с доминирующим количеством лактобацилл – залог вагинального и женского здоровья [2]. Lactobacillus spp. производят перекись водорода и молочную кислоту, которые обладают противомикробным эффектом и играют ключевую роль в предотвращении колонизации влагалища патогенными и условно-патогенными бактериями [3]. Гормональные изменения в организме женщины в различные возрастные периоды оказывают существенное влияние на микрофлору влагалища. Низкий уровень эстрогенов в постменопаузе индуцирует структурные и химические изменения урогенитального тракта, вызывая целый каскад событий, начиная с истончения влагалищного эпителия. Это приводит к уменьшению содержания гликогена – основного субстрата выработки молочной кислоты, обеспечивающей кислую среду влагалища в пределах рН от 3,8 до 4,4, в результате чего повышается уровень рН, среда становится щелочной, что препятствует росту лактобактерий [4]. Происходит колонизация не только условно-патогенными, но и патогенными микроорганизмами [2, 3, 5–7].
Микробиоценоз влагалища женщин в постменопаузе мало изучен: на сегодняшний день в литературе недостаточно информации о состоянии микробиоты влагалища у женщин в постменопаузе. Имеются лишь единичные работы по изучению состава микробиоценоза влагалища в постменопаузе [8]. Неоправданное назначение антибактериальной терапии женщинам в период постменопаузы приводит к потенциальному нарушению и без того очень хрупкой микробиоты.
Цель исследования – изучить микробиоту влагалища у женщин в постменопаузе и ее связь с симптомами ВВА.
Материалы и методы
Обследованы 187 женщин с длительностью постменопаузы 1–20 лет. Все пациентки подписали информированное согласие. Критериями включения явились отсутствие менопаузальной гормональной терапии (МГТ) в течение 6 месяцев и системной или местной антибактериальной терапии в течение 1 месяца до начала проведения исследования. Диагноз ВВА был верифицирован с помощью цитологического метода исследования и подсчета индекса созревания эпителия влагалища (ИСЭВ=0,5 × количество промежуточных клеток (%) + 1 × количество поверхностных клеток (%); норма – ≥65%; <65 – вагинальная атрофия).
Методом полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) с использованием комплекта реагентов ФЕМОФЛОР (ООО «НПО ДНК-Технология», Россия) проводили количественную оценку микроценоза влагалища. Учитывалась общая бактериальная масса (ОБМ), количество и доля Lactobacillus spp.; Enterobacteriaceae; Staphylococcus spp.; Enterococcus spp.; Prevotella bivia/Porphyromonas spp.; Eubacterium spp.; Sneathia spp./Leptotrichia spp./Fusobacterium spp; Megasphaera spp./Veillonella spp./Dialister spp.; Lachnobacterium spp./Clostridium spp.; Mobiluncus spp./ Corynebacterium spp.; Peptostreptococcus spp.; Atopobium vaginae; Mycoplasma hominis; Ureaplasma urealyticum; Streptococcus spp.; Streptococcus agalactiae; Gardnerella vaginalis; Mycoplasma genitalium; Ureaplasma parvum; Actinomycetes spp.; Bifidobacterium; Anaerococcus spp.; S. aureus; E. coli; Candida spp.; Candida albicans.
Амплификацию осуществляли в режиме реального времени на приборе «ДТ-964» («ДНК-Технология», Россия). Измерение уровня флуоресценции проводили на каждом цикле амплификации по каналам FAM, HEX и ROX. Обработка результатов осуществлялась автоматически с помощью программного обеспечения к приборам. В рамках данной работы бактериальная микрофлора влагалища по структуре была отнесена к одному из пяти типов бактериальных сообществ (ТБС, СST) [9, 10]. Для этого методом ПЦР-РВ дополнительно оценивали также структуру лактофлоры путем определения L. crispatus; L. acidophilus; L. iners; L. jensenii; L. gasseri; L. johnsonii; L. vaginalis.
Статистическую обработку данных проводили с помощью IBMSPSS STATISTICS 21 for Windows с вычислением средней арифметической и ее стандартной ошибки (M±m). Для оценки межгрупповых различий использовали непараметрический тест U Манна–Уитни для двух независимых выборок. Различия между величинами считали статистически значимыми при уровне достоверности p<0,05.
Результаты
В исследовании приняли участие 187 женщин в постменопаузе в возрасте от 40 до 75 лет (средний возраст – 55,6±5,9 года) с длительностью постменопаузы от 1 года до 20 лет (средняя длительность постменопаузы – 6,4±5,1 года). На основании оценки ИСЭВ пациентки были распределены на 2 группы. Группу А (основную) составили 120 (64,2%) женщин с ВВА, а группу сравнения (группу В) – 67 (35,8%) пациенток. Основные клинические характеристики пациенток представлены в табл. 1.

Согласно данным таблицы, рост у обследованных женщин в обеих группах не имел достоверных различий, однако масса тела и ИМТ у пациенток в основной группе А были достоверно ниже, чем в группе сравнения. Женщины в обследованных группах достоверно отличались по возрасту. Длительность постменопаузы была несколько меньше в группе В, и эти различия были погранично значимыми. Для учета этого потенциального конфаундера была проведена стратификация пациенток по длительности постменопаузы (табл. 2).
Представленные в табл. 2 данные подтверждают увеличение частоты встречаемости ВВА по мере прогрессирования постменопаузы.
Нами было проведено анкетирование респонденток; сравнительный анализ результатов представлен в табл. 3 с учетом распределения пациенток в группах наблюдения.
Как видно из представленных в таблице данных, преобладающими жалобами в группах наблюдения были: сухость (69,0%), жжение (45,5%), раздражние (35,8%) и зуд (36,9%) во влагалище. В меньшем проценте случаев женщины предъявляли жалобы на боль (26,7%), выделения из половых путей (29,4%) и неприятный запах выделений из половых путей (24,1%). Частота встречаемости жалоб была высокой в обеих группах, однако пациентки основной группы жаловались на сухость во влагалище достоверно чаще, чем в группе сравнения, что подтверждает специфичность атрофических изменений эпителия влагалища при ВВА.
Микрофлора влагалища у женщин в постменопаузе была представлена лактобациллами, факультативными анаэробами и аэробами: семейство Enterobacteriaceae; Staphylococcus spp.; Streptococcus spp. и облигатно-анаэробными микроорганизмами: Prevotella bivia/Porphyromonas spp., Eubacterium spp., Megasphaera spp./Veillonella spp./Dialister spp., Lachnobacterium spp./ Clostridium, Mobiluncus spp./Corynebacterium, Peptostreptococcus spp. ДНК Mycoplasma genitalium и Candida spp. не была обнаружена ни в одном из образцов.
ОБМ у женщин в постменопаузе составила106,3 (2,5–8,5) ГЭ/образец. В структуре ОБМ наиболее высоких значений достигало количество двух групп облигатно-анаэробных микроорганизмов – Eubacterium spp. (104,0 (0–7,7) ГЭ/образец) и Prevotella bivia/Porphyromonе spp. (102,7 (0–6,9) ГЭ/образец). Lactobacilli spp. были представлены в количестве 104,6 (0–8,5) ГЭ/образец и распределялись следующим образом: ТБС I был представлен преимущественно L. crispatus (107,5 (6,0–8,1) ГЭ/образец) и встречался у 10% женщин в постменопаузе; ТБС II был представлен у 6% женщин, где доминировали L. gasseri (106,6 (4,3–7,3) ГЭ/образец) и L. johnsonii (104,6 (2,5–5,4)ГЭ/образец); в ТБС III (14,9%) преобладали L. iners (107,2 (4,4–8,4) ГЭ/образец); ТБС IV (отсутствие лактобацилл) был диагностирован у 67,5% женщин в постменопаузе; ТБС V (1,6%) был представлен L. jensenii (106,5 ГЭ/образец). L. vaginalis присутствовала в ТБС I, ТБС II, ТБС III и ТБС V. L. acidophilus не была обнаружена ни в одном из типов сообществ микробиоты. Нами был исключен ТБС V в связи с его присутствием только у 3 женщин в обеих группах наблюдения.
 Важно отметить, что в постменопаузе, независимо от ее длительности, доминирующим сообществом микробиоты влагалища был ТБС IV с преобладанием облигатно-анаэробных микроорганизмов: Eubacterium spp. (105,2 (0–7,7) ГЭ/образец), Prevotella bivia/Porphyromonas spp. (104,9 (0–6,9) ГЭ/образец) и факультативно-анаэробного Streptococcus spp.(104,2 (0–6,5) ГЭ/образец ).
Важно отметить, что в постменопаузе, независимо от ее длительности, доминирующим сообществом микробиоты влагалища был ТБС IV с преобладанием облигатно-анаэробных микроорганизмов: Eubacterium spp. (105,2 (0–7,7) ГЭ/образец), Prevotella bivia/Porphyromonas spp. (104,9 (0–6,9) ГЭ/образец) и факультативно-анаэробного Streptococcus spp.(104,2 (0–6,5) ГЭ/образец ).
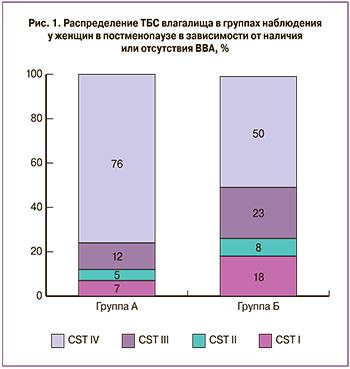
В ходе исследования нами было оценено распределение типов ТБС в группах наблюдения в зависимости от наличия или отсутствия атрофических изменений эпителия влагалища. Стоит отметить, что ТБС IV в основной группе наблюдения встречался в 76% случаев, а в группе без атрофии – у каждой второй пациентки (р=0,002). У 24% женщин в постменопаузе с ВВА микробиота влагалища была представлена L. crispatus, L. gasseri и L. iners (ТБС I–ТБС III) (рис. 1). По мере прогрессирования постменопаузы распределение ТБС внутри групп статистически значимо не менялось.
У женщин с ВВА в микробиоте влагалища доминировал ТБС IV (рис. 2).
При сравнении спектра сообществ микроорганизмов в группах исследования были выявлены статистически значимые различия состава микробиоценоза (табл. 4).

В ТБС IV в основной группе наблюдения ОБМ была значимо ниже (р<0,0001) по сравнению с женщинами без атрофии. При этом абсолютное количество некоторых представителей факультативно-анаэробной (аэробной) флоры влагалища также было существенно снижено: в ТБС III и ТБС IV Streptococcus spp. (р=0,009; р=0,048), и облигатно-анаэробных микроорганизмов в ТБС IV: Eubacterium spp. (р=0,012), Megasphaera spp./Veillonella spp./ Dialister spp.(р=0,020). У 50% пациенток в группе без атрофических изменений слизистой влагалища и с ТБС IV в микробиоте влагалища была выявлена Gardnerella vaginalis (105,7 (0,0–7,8)* ГЭ/образец) (р<0,0001).

При сравнении спектра микроорганизмов с учетом ТБС в группах исследования при атрофических изменениях эпителия влагалища и по мере увеличения длительности менопаузы прослеживалось снижение абсолютного количества лактобацилл (р<0,0001): L. crispatus (р=0,003), L. gasseri, L. iners, L. johnsonii (р=0,001) (табл. 5).

 В нашем исследовании было изучено кислотно-щелочное состояние вагинальной среды. Средний показатель рН составил 5,7±0,9 (диапазон от 4,2 до 7,5). При сравнении рН в обеих группах было выявлено увеличение данного показателя. В группе А показатель рН составил 6,0±0,8 по сравнению с группой без атрофии – 5,0±0,6 (р<0,0001). Нами был проведен ROC-анализ с целью определения его критического уровня, ассоциированного с ВВА. Площадь под ROC-кривой составила AUC=0,805 [95% ДИ 0,743–0,868]; р <0,0001, что позволило оценить ее как очень хорошую (рис. 3). Пороговое значение рН составило 6,0. Чувствительность и специфичность предложенной модели в области порогового значения составили 66 и 79% соответственно.
В нашем исследовании было изучено кислотно-щелочное состояние вагинальной среды. Средний показатель рН составил 5,7±0,9 (диапазон от 4,2 до 7,5). При сравнении рН в обеих группах было выявлено увеличение данного показателя. В группе А показатель рН составил 6,0±0,8 по сравнению с группой без атрофии – 5,0±0,6 (р<0,0001). Нами был проведен ROC-анализ с целью определения его критического уровня, ассоциированного с ВВА. Площадь под ROC-кривой составила AUC=0,805 [95% ДИ 0,743–0,868]; р <0,0001, что позволило оценить ее как очень хорошую (рис. 3). Пороговое значение рН составило 6,0. Чувствительность и специфичность предложенной модели в области порогового значения составили 66 и 79% соответственно.
Также был проведен анализ значения рН влагалища в зависимости от типа сообщества микробиоценоза влагалища. При ТБС I рН составил 5,0 (4,8–5,0). Для данного типа микробиоценоза характерно преобладание L. crispatus. В ТБС II (при доминировании L. gasseri и L. johnsonii) рН составил 4,8 (4,6–4,8), в ТБС III (L. iners) – 5,5 (5,0–6,0); в ТБС IV (отсутствие лактобацилл) рН был самым высоким – 6,0 (5,0–6,0) (рис. 3).
Нами также была изучена распространенность сухости влагалища и диспареунии при половых контактах в зависимости от ТБС. Как видно из таблицы, сухость влагалища была значимо ассоциирована с ТБС IV у женщин в постменопаузе (табл. 6).
Обсуждение
До настоящего времени отсутствуют единые критерии оценки микрофлоры влагалища в постменопаузе. Микробиота влагалища с доминирующим количеством лактобацилл – залог вагинального и женского здоровья [2]. Но вследствие гипоэстрогении на фоне атрофических изменений слизистой влагалища происходит нарушение количественного и качественного состава микробиоты и ощелачивание вагинальной среды [4], на фоне чего происходит перераспределение ТБС. Мало что известно о взаимосвязи влагалищной микрофлоры у женщин в постменопаузе с жалобами, возникающими в этом возрастном периоде. Видимо, атрофические изменения слизистой влагалища и перераспределение ТБС – это два взаимоотягощающих, параллельно протекающих процесса у женщин в постменопаузе. R. Hummelen и соавт. в своей работе [11] описали взаимосвязь сухости, количественного соотношения лактобацилл и ОБМ в постменопаузальном периоде. Авторами было установлено, что при отсутствии жалоб у женщин в группах исследования в микробиоте влагалища преобладали Lactobacillus spp., несмотря на снижение ОБМ (р=0,001), а у пациенток с жалобами на сухость во влагалище было выявлено снижение количества лактобактерий с преобладанием облигатно-анаэробных микроорганизмов (Prevotella bivia, Porphyromonas spp.). Brotman и соавт., выделив 5 ТБС, описали микробиоту влагалища 87 женщин в постменопаузе, ассоциированную с симптомами ВВА. В данной работе была установлена значимая взаимосвязь симптомов ВВА с ТБС IV–А [10]. Исследователи сравнивали взаимосвязь симптомов именно с подтипами ТБС IV, что не дало никаких различий. Они пришли к выводу, что боль и сухость во влагалище, диспареуния связаны с преобладанием анаэробной бактериальной микрофлоры на фоне низкого количества лактобактерий или их полного отсутствия. В нашей работе была изучена распространенность симптомов ВВА – сухости влагалища и диспареунии при половых контактах, в зависимости от преобладания ТБС. Сухость влагалища у женщин в постменопаузе с ВВА была значимо ассоциирована с преобладающим ТБС IV (р=0,005). У 50% женщин в постменопаузе, предъявляющих жалобы на сухость, без атрофических изменений слизистой влагалища наблюдался бактериальный вагиноз. ТБС IV у женщин в постменопаузе был значимо ассоциирован со значением рН влагалища 6,0 (р<0,0001). Каждая вторая пациентка без атрофических изменений на фоне преобладания условно-патогенной флоры предъявляла жалобы на неприятные выделения из половых путей с запахом. Важно отметить, что у 24% женщин в постменопаузе с ВВА сохранялась лактофлора.
Таким образом, мы предполагаем, что сухость влагалища не является специфичным симптомом для атрофических изменений слизистой влагалища. По-видимому, его наличие или отсутствие зависит также от композиционного состава микробиоты влагалища в период постменопаузы и ассоциировано с ТБС IV. Данная гипотеза согласуется с результатами исследования Hummelen R. и соавт., где сухость влагалища у женщин в постменопаузе имела обратную корреляционную связь с численностью лактобацилл в вагинальном биотопе (р=0,00141) [11].
Заключение
Сухость влагалища является специфическим симптомом для ТБС IV у женщин с ВВА, однако она также является частой жалобой у пациенток в постменопаузе без атрофических изменений слизистой влагалища на фоне дисбиоза влагалища. Полученные нами данные позволяют предположить возможную взаимосвязь вагинальных симптомов не только с атрофией слизистой влагалища, но и с особенностями микрофлоры. Это позволит персонализировать ведение женщин в постменопаузе с наличием вагинальных симптомов: женщин с ТБС IV без атрофических изменений слизистой влагалища – с позиций терапии бактериального вагиноза, а при наличии атрофических изменений первой линией выбора является локальная гормональная терапия эстриолом.



