Врастание плаценты (ВП) — серьезное осложнение беременности с потенциальным риском неблагоприятного исхода для матери и плода. Частота ВП в последние 10-летия неуклонно растет и в специализированных центрах достигает 9:1000 [1]. Стратегия по предотвращению неблагоприятных исходов ВП предусматривает заблаговременную дородовую госпитализацию беременных в центры 3-го уровня, раннее плановое оперативное родоразрешение с привлечением мультидисциплинарной команды специалистов и высокотехнологичного оборудования с учетом высокого риска массивной кровопотери, травмы смежных органов, гистерэктомии и неонатальных осложнений [2-9].
Антенатальная диагностика ВП основывается на учете факторов риска и данных визуализирующих методов исследования [3, 5, 10]. В то же время исследования последних лет обнаружили, что точность антенатальной лучевой диагностики (ультразвукового исследования (УЗИ), магнитно-резонансной томографии (МРТ)) оказалась ниже, чем предполагалось ранее, а ложноположительные заключения ведут к выполнению дополнительных инвазивных вмешательств и досрочному родораз- решению пациенток без ВП [5, 11]. Таким образом, актуально изучение диагностических возможностей дополнительных биологических маркеров аномальной инвазии плаценты [12—20].
Среди большого количества потенциальных сывороточных предикторов ВП особый интерес представляют маркеры ангиогенеза [12-14, 15, 19]. С одной стороны, локальный дисбаланс этих белков как фактора неконтролируемой инвазии трофобласта подтвержден рядом морфологических исследований [12, 15, 21]. С другой стороны, доказанная значимость диспропорции сывороточного уровня растворимой fms-подобной тирозинкина- зы-1 (soluble fms-like tyrosine kinase 1 — sFlt-1) и плацентарного фактора роста (placental growth factor, PlGF) в генезе преэклампсии и возможности раннего прогноза развития этого грозного осложнения беременности [22-24] повышают перспективы использования данной группы аналитов в рутинной клинической практике как мультимодального биомаркера. Это актуализирует изучение закономерностей изменения их концентрации в крови беременных при различной акушерской патологии.
Целью исследования явилось изучение прогностической значимости уровня маркеров ангиогенеза: сосудистого эндотелиального фактора роста (vascular endothelial growth factor, VEGF), PlGF, sFlt-1 в сыворотке крови в III триместре у беременных с предлежанием плаценты (ПП) для оценки вероятности ВП, глубины инвазии плаценты, прогноза экстренного родоразрешения.
Материалы и методы
Исследование «случай-контроль» на базе Перинатального центра ГБУЗ «ККБ №2» г. Краснодара в период с 01.12.2019 по 01.03.2021. Исследование одобрено Комитетом по этике ГБУЗ «ККБ №2» (протокол № 90 от 13.11.2019). Дизайн исследования выполнен в соответствии с этическими принципами Хельсинкской декларации и предусматривал анализ крови на сывороточные маркеры ангиогенеза (PlGF, sFlt-1, VEGF) в дополнение к стандартному обследованию в соответствии с Приложением 1 к Приказу МЗ РФ № 572Н 01.11.2012 г. беременных с ПП, госпитализированных в отделение патологии беременных Перинатального центра в III триместре. Забор материала проводился после получения письменного информированного согласия пациенток до введения стероидов и гемотрансфузии (в случае необходимости их применения).
Критерии включения: антенатальный диагноз О44.0-О44.1 с/без О43.2 (МКБ-10), согласно данным УЗИ и/без МРТ, срок беременности 26-38 недель, информированное письменное согласие пациентки на участие в исследовании.
Критерии исключения: многоплодная беременность, преэклампсия, антенатальная гибель плода, наличие врожденных пороков развития плода, явившихся показанием к досрочному прерыванию беременности.
Согласие на участие в исследовании получено у 93 пациенток, соответствовавших критериям включения. В последующем 5 пациенток исключены из исследования: с двумя была утрачена связь, исход беременности не отслежен; у двух при продолжающемся наблюдении до родов диагноз ПП был исключен, у одной развилась преэклампсия в послеродовом периоде. Всего в исследование были включены 88 пациенток.
Клинические группы
Пациентки были разделены на группы согласно клиническому диагнозу, верифицированному интраоперационно и по данным гистологического исследования операционного материала (при наличии). Глубина ВП определялась в соответствии с рекомендациями FIGO [25]. Специалисты, выполнявшие иммуноферментный анализ, не имели данных о клиническом диагнозе пациенток.
Методика
После забора образца крови из периферической вены в вакуумную пробирку с активатором свертывания и экспозиции при комнатной температуре в течение 30 минут проводилось центрифугирование образца в течение 15 минут при частоте оборотов 2,5 тыс/мин с центробежным ускорением RCF 1100 G (центрифуга Liston C2202 (www.liston.ru). Далее образцы сыворотки немедленно замораживались и хранились при температуре -80°С до выполнения анализа. Измерения и обработка результатов иммуноферментного анализа выполнялись с использованием автоматического фотометра для микропланшетов INVITROLOGIC (ООО «Медикобиологический Союз», Россия). Количественный анализ сывороточных маркеров ангиогенеза выполнялся с использованием иммуноферментного набора для количественного определения рецептора 1 человеческого VEGF (Bender MedSystems Австрия, BMS268/3 h VEGF-R1), кат. № BMS268/3; иммуноферментного набора для количественного определения человеческого PlGF в супернатантах клеточных культур, сыворотке, плазме и моче (R&D Systems, США, Inc., Quantikine Human PlGF Immunoassay), кат. № DPG00 и иммуноферментно- го набора для количественного определения человеческого VEGF-A (Bender MedSystems Австрия, BMS277/2 h VEGF-A), кат. № BMS277/2.
Предел измерений на фотометре INVITROLOGIC составлял для PlGF: 7-1000 пг/мл; для VEGF-A: 7,9-1000 пг/мл; для sFlt-1: 0,03-10,0 нг/мл. Коэффициент вариации воспроизводимости для sFlt-1 внутри одной серии составлял 5,5%, между сериями — 5,1%; для PlGF — 5,4 и 11,2%; для VEGF-A — 6,2 и 4,3% соответственно.
Группы пациенток с ПП и без ВП сравнивались по клиническим и демографическим характеристикам: расовой принадлежности, возрасту, количеству беременностей, паритету, числу кесаревых сечений (КС), индексу массы тела (ИМТ), соматической коморбид- ности (хроническая артериальная гипертензия, ожи
рение), акушерской коморбидности (гестационный сахарный диабет), никотиновой зависимости, сроку беременности на момент забора биоматериала для анализа. Также сравнивали исходы беременностей между группами: срок беременности на момент родоразрешения, экстренный порядок родоразрешения, объем интраоперационной кровопотери, наличие массивной кровопотери, потребность в гемотрансфузии, частота гистерэктомий, маловесность плода при рождении, асфиксия плода при рождении.
Анализировали абсолютные значения sFlt-1, PlGF, VeGf и отношение sFlt-1/PlGF в каждой группе в зависимости от срока гестации. Срок гестации определяли с учетом даты последней менструации и данных комбинированного скрининга I триместра. Результаты отношения sFlt-1/PlGF сравнивали с референсными значениями, рекомендованными к использованию в качестве «нормативов», полученных для отечественной популяции беременных женщин [22]. Оценивали возможную связь уровня маркеров ангиогенеза в III триместре с глубиной ВП, с вероятностью досрочного экстренного родоразрешения.
Критерием экстренного родоразрешения считали выполнение операции КС при наличии угрозы жизни женщины или плода. Кровопотерю в родах оценивали как визуально, так и гравиметрическим методом, использовали данные абсолютной кровопотери и в мл/кг веса роженицы, массивной считали кровопотерю не менее 1,5 л (25—30% объема циркулирующей крови) одномоментно либо не менее 2,5 л (50% объема циркулирующей крови) за 3 ч [26]. Для оценки соответствия массы плода при рождении гестационной норме использовали центильные таблицы Фонда Медицины плода [27].
Статистический анализ
Статистическое описание одномерных нормально распределенных данных производилось с использованием среднего арифметического и стандартного отклонения (mean±standard deviation), данных, не подчиняющихся нормальному закону, — с использованием медианы (Me), межквартильного (Q1; Q3) и перцентильного (P5%-P95%) диапазонов. Соответствие распределения нормальному закону проверялось тестом Колмогорова—Смирнова (Kolmogorov-Smirnov test). Статистическое сравнение средних осуществлялось с помощью непараметрических критериев ввиду несоответствия распределения данных критерию нормальности. Сравнение средних рангов между двумя независимыми выборками производилось с помощью U-теста Манна-Уитни (Mann-Whitney’s U-test), Качественные показатели представлены в абсолютных (n) и в относительных (%) величинах.
Расчет размера выборки для первичного результата вероятности ВП по сравнению с ПП был основан на данных, представленных в работе Schwickert А. et al. [19]. Подсчитано, что для выявления различий значений биомаркеров между двумя группами (i-критерий Стьюдента) при а=0,05, мощности критерия = 95% необходимо минимум 38 пациенток в обеих группах.
Для статистического сравнения частоты встречаемости факторов риска ВП у пациенток с ПП использовался точный критерий Фишера (Fisher's exact test). Для всех статистических тестов представлены двусторонние значения p-уровня, Критической величиной уровня значимости (p) принято 0,05 (р<0,05). Для определения пороговых значений изучаемых признаков использовался метод ROC- анализа.
Прогностическая значимость биомаркеров оценивалась с помощью логистического регрессионного анализа (использовалась программа SPSS Version 26 (IBM, Чикаго, США)). Для расчета оценок прогностических тестов использовалась программа MedCalc Version 20.011 (MedCalc Software Ltd., Бельгия): измерялись отношение шансов (ОШ), при включении в модель других предикторов — отношение скорректированных шансов (сОШ), чувствительность (sensitivity, Se), специфичность (specificity, Sp), предсказательная ценность теста (predictive value of positive and negative results, PPV, NPV), площадь под ROC- кривой (area under ROC-curve, AUC) с указанием 95% доверительного интервала (ДИ) для данных операциональных характеристик. Пороговые значения биомаркеров были рассчитаны с помощью индекса Йондена. В качестве зависимых выступали признаки, отражающие факт наличия/отсутствия ВП и экстренного родоразрешения. Предикторными признаками были определены изучаемые биомаркеры и факторы риска, имеющие статистическую значимость для оценки вероятности ВП и экстренного родоразреше- ния. На первом этапе был произведен расчет отношения шансов с 95% ДИ для каждого признака отдельно, ВП и экстренного родоразрешения (одномерный анализ). На втором этапе рассчитывались скорректированные ОШ с помощью многомерной бинарной логистической регрессии, включая признаки, показавшие статистическую значимость при одномерном анализе (р<0,05). Включение предикторов в логит- модель производилось пошагово методом прямого включения (Forward stepwise).
Для определения силы связи между клиническими признаками рассчитывался коэффициент корреляции Спирмена (Spearman correlation) с указанием доверительных интервалов для rho Спирмена и оценкой статистической значимости связи (р). Для определения взаимосвязи между признаками под контролем влияния срока гестации при заборе крови использовалась получастичная корреляция (Semipartial correlation).
Результаты
ВП верифицировано у 46 пациенток (1-я группа), исключено у 42 пациенток (2-я группа). Все пациентки относились к белой расе. При сравнении клинических и демографических характеристик обнаружена статистическая однородность групп (р>0,1) по комор- бидности, сроку беременности при заборе материала и родоразрешения (табл. 1), что обеспечило чистоту дальнейшего анализа вариативных признаков, включая уровень биомаркеров. Сравнительный анализ показал, что пациентки с ВП были достоверно старше, имели больше беременностей, родов и КС в анамнезе, а объем кровопотери при их родоразрешении был достоверно выше (табл. 1).
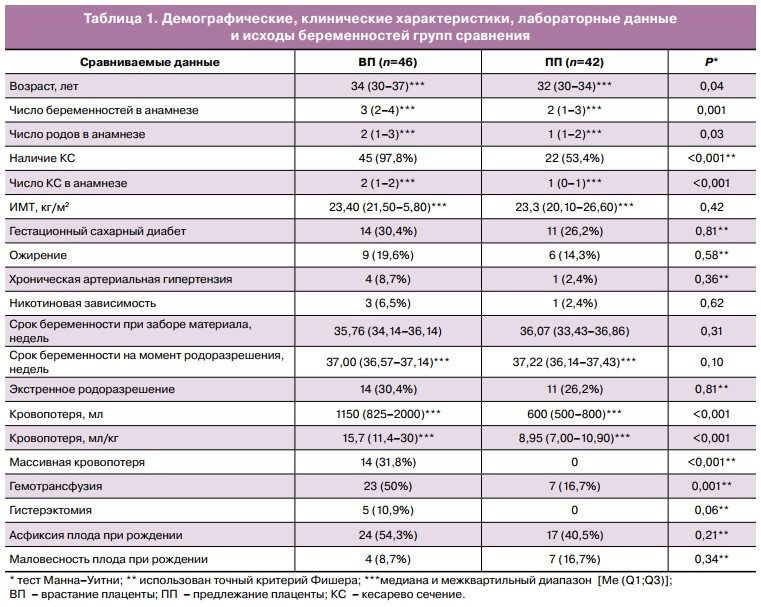
Из 88 пациенток, вошедших в исследование, в экстренном и неотложном порядке родоразрешены 25 (28,4%); из них без ВП — 11, с ВП — 14. Показаниями к экстренному/неотложному родо- разрешению явились: антенатальное кровотечение (и=21), дистресс плода (и=1), прочие (и=3).
Анализ потенциальных сывороточных биомаркеров ВП в III триместре не выявил статистически значимых различий между группами, за исключением уровня PlGF и отношения sFlt-1/PlGF (табл. 2). Учитывая, что при неосложненной беременности с увеличением срока гестации в III триместре концентрация проангиогенных факторов в сыворотке крови снижается [20], мы провели анализ возможных отличий между группами по уровню биомаркеров, принимая во внимание срок беременности, а также глубину инвазии плаценты в группе ВП (табл. 2).

При сравнении изменения концентрации биомаркеров в зависимости от срока беременности обнаружено, что у пациенток с ПП, но без ВП динамика показателей соответствует таковой при физиологической беременности: уровень PlGF к концу беременности снижается, а отношение sFlt- 1/PlGF растет. При ВП имеет место обратная тенденция: рост PlGF с достоверной разницей между группами, начиная с 34 недель, и снижение sFlt-1/ PlGF с достоверной разницей в доношенном сроке беременности (табл. 2).
Анализ вероятной связи глубины ВП с уровнем биомаркеров ангиогенеза обнаружил, что с увеличением глубины инвазии плаценты возрастает уровень PlGF и снижается уровень sFlt-1; а также отношения sFlt-1/PlGF (табл. 2). Статистически значимая прямая связь глубины ВП с концентрацией PIGF (пг/мл) подтверждена методом парной корреляции Спирмена (Spearman’s rho=0,29; p=0,01), а для sFlt-1/PlGF — на уровне статистической тенденции (Spearman’s rho=-0,20; p<0,1). Методом получастичной корреляции с учетом влияния срока гестации при заборе крови установлено, что связь глубины ВП с сывороточной концентрацией PIGF (пг/мл) сохраняется статистически значимой (^=0,01), а связь sFlt-1/PlGF полностью исчезает (табл. 2).
При сравнении сывороточного уровня биомаркеров ангиогенеза между подгруппами с плановым и экстренным родоразрешением обнаружена статистически значимая разница в концентрации sFlt-1/ PlGF в случаях родоразрешения ранее 37+0 недель беременности: уровень sFlt-1/PlGF при экстренном родоразрешении оказался ниже, чем при плано-
вом (0,9 против 4,2; р=0,017). При этом в случаях экстренного КС в группе ВП в доношенном сроке (>37+0 недель) содержание PlGF в сыворотке крови оказалось выше, чем в плановых случаях (Me, пг/ мл (Q1-Q3)) — 1028,7 (880,2-1190,5) против 482,9 (242,0-773,6); р=0,045).
Для определения прогностической ценности клинических предикторов и биомаркеров в диагностике ВП и прогнозе экстренности родоразрешения методом ROC-анализа были определены их пороговые значения посредством вычисления индекса Йондена (табл. 3). Для предиктора «возраст матери» определено пороговое значение «более 33 лет» (табл. 3). Установлено, что в качестве самостоятельных предикторов ВП клинические параметры (наличие КС в анамнезе, возраст матери) превышали информативность биомаркеров, но для прогноза экстренного родоразрешения sFlt-1/PlGF<2,5 и PlGF>254,0 пг/мл демонстрировали более высокие сочетания чувствительности и специфичности.

Учитывая зависимость абсолютных значений уровня PlGF от используемых аналитических тест- систем [13, 14, 22], мы расценили отношение sFlt- 1/PlGF как наиболее перспективный для применения в клинической практике серологический биомаркер III триместра и дополнительно оценили его значимость для прогноза вероятности как ВП, так и экстренного родоразрешения в модели бинарной логистической регрессии с клиническими предикторами, которые отбирались методом прямого включения (табл. 3). Включение в регрессионную модель дополнительных факторов (наличие КС; возраст матери >33 лет) позволило повысить прогностическую значимость маркера sFlt-1/PlGF для оценки вероятности ВП (AUC=0,886; р=0<0,001; PPV=81,6%; NPV=84,6%) (табл. 3).
При оценке вероятности экстренного родоразре- шения выявлено, что полученная модель, учитывающая, наряду с уровнем биомаркеров, возраст матери и наличие КС в анамнезе, в большей степени подходит для прогноза прогрессирования беременности до доношенного срока за счет высокой специфичности и прогностической ценности отрицательного теста, исключающего вероятность экстренного родоразрешения (AUC=0,789; р=0<0,001; Sp=92,1%; NPV=79,5%) (табл. 3).
Обсуждение
Анализ клинических характеристик пациенток подтвердил известные данные о том, что риск ВП повышается с увеличением числа КС в анамнезе, у женщин старшей возрастной группы, с большим количеством беременностей в анамнезе [3, 5, 8, 9, 19]. Особенностью работы явился выбор в качестве группы сравнения пациенток с ПП. Известно, что ПП является независимым фактором риска ВП [3, 5, 28], но различия в патогенезе развития этих состояний изучены недостаточно [13]. Таким образом, дифференциальная диагностика ВП в группе высокого риска особенно актуальна.
Известно, что с ранних сроков беременности инвазивный потенциал хориона контролируется дециду
альной оболочкой полости матки, в том числе посредством выработки и регуляции уровня ангиогенных факторов (VEGF, PlGF, sFlt-1) [13, 19, 29]. В исследовании Иванец Т.Ю. и др. [22] на когорте здоровых беременных было доказано, что при неосложненном течении беременности отношение sFlt-1/PlGF имеет максимальные значения в периодах 11—14 и 37—40 недель беременности. Вероятно, физиологическая целесообразность такого феномена связана с необходимостью предотвращения неконтролируемой инвазии хориона в периоде активной плацентации и при подготовке плаценты к отделению с перестройкой сосудов для предотвращения массивного кровотечения в родах. Минимальные значения sFlt-1/ PlGF при неосложненной беременности наблюдаются в 24—33 недели гестации. Работы, изучавшие особенности ангиогенного профиля сыворотки крови у пациенток с предлежанием и ВП, единичны, а результаты их разноречивы [12-14].
VEGF-A — стимулятор ангиогенеза, влияющий на пролиферацию и миграцию клеток эндотелия; его снижение ведет к регрессии кровеносных сосудов [30]. Учитывая точки приложения данного протеина, следует ожидать повышение его содержания в крови у пациенток с ВП. Однако в ранее выполненных работах [12, 14, 19] было обнаружено снижение сывороточного уровня VEGF в III триместре у пациенток с ВП в сравнении с контролем (0,8 (0,02—3,4) против 6,5 (2,7—10,5) пг/мл; />=0,02; 39,18+11,98 против 85,87+18,05 пг/мл;/<0,001; 285 (95% ДИ 248—322) против 391 (95% ДИ 356—426) пг/мл, /<0,01 соответственно). Согласно данным Schwickert А. et al. [19], сывороточный уровень VEGF-l коррелировал также с глубиной инвазии плаценты (r=-0,32; /<0,01). В то же время нами, как и Biberoglu E. et al. [13], не найдено статистически значимых различий по данному показателю у пациенток с ВП и в его отсутствие. С одной стороны, неоднозначность результатов можно объяснить различным дизайном исследования: в отличие от работ Schwickert А. et al. [19], Uyanikoglu H. et al. [14], сравнивавших концентрацию биомаркера между группами с ВП и нормальной плацентацией, мы в качестве группы сравнения выбрали пациенток с ПП. С другой стороны, значения показателя в разных исследованиях, несмотря на использование одних единиц изменения, отличались на порядки, что объясняется различиями в выполнении методики на различных диагностических панелях.
PlGF участвует в плацентарном ангиогенезе и в ремоделировании спиральных артерий [30]. При неосложненной беременности его уровень меняется волнообразно с пиком в 30—33 недели беременности и последующим снижением [22, 30]. Наши данные не совпали с результатами Biberoglu E. et al. [13], которые не обнаружили разницы между уровнем PlGF в III триместре, независимо от положения плаценты, наличия ВП, а также срока гестации, и Uyanikoglu H. et al. [14], обнаружившими статистически значимое снижение уровня PlGF у пациенток с /l. /ercreta в сравнении с пациентками с нормальной плацентацией, родоразрешенных в те же сроки беременности. Среди наших пациенток с ВП обнаружен парадоксальный прирост PlGF к сроку доношенной беременности. Повышенная сывороточная концентрация PlGF в сравнении с пациентками с ПП со статистически значимой разницей в сроке доношенной беременности (/=0,005) косвенным образом указывает на сохраняющийся проангиогенный фенотип врастающей плаценты в течение III триместра беременности.
sFlt-1 — вариант сплайсинга рецептора VEGF, реализуется как антагонист VEGF-A и PlGF, блокируя их связи с соответствующими рецепторами [21]. По нашим данным, различия в уровне sFlt-1 у пациенток с ПП при наличии и отсутствии ВП были менее выражены, и относительно более низкий уровень в группе с ВП обнаружил лишь тенденцию к стати- стичежой значимости в доношенном сроке (/=0,07). При сравнении полученных результатов с референсными интервалами, разработанными в качестве «нормативных параметров» для отечественной популяции [22], мы столкнулись со сложностью совместной интерпретации данных, полученных на разных аналитических диагностических комплексах. В настоящее время отсутствие стандартизации данных по уровню маркеров ангиогенеза в III триместре в крови матери, выраженных в кратном медианы (multiple of median, MoM), ограничивает их использование в широкой клинической практике. Именно поэтому наибольший интерес с точки зрения практического применения, по нашему мнению, представляет интерпретация показателя отношения sFlt-1/PlGF, который дает интегративную оценку уровня про- и антиангиогенного потенциала плаценты без привязки к абсолютным значениям показателей.
При сравнительном анализе отношение sFlt-1/ PlGF оказалось ниже «нормативов» для физиологической беременности [20] в сроки 34—36 недель, и особенно по достижении 37 недель беременности в обеих группах, что не позволяет согласиться с мнением Schwickert А. et al. [19] о том, что ПП не влияет на уровень проангиогенных факторов в сыворотке крови беременных. При этом перцентильные диапазоны группы ВП в нашем исследовании и данных, рассчитанных ранее для физиологической беременности в доношенном сроке [22], не перекрываются (0,4—1,7 против 4,4—49,2 соответственно), что указывает на статистическую значимость различий.
Однако нельзя не учитывать факт, что наши пациентки отличались по клинически различным типам течения беременности: пациентки, пролонгировавшие беременность до доношенного срока и родоразрешенные в плановом порядке, и те, кому КС было выполнено в экстренном порядке до срока доношенности. При этом из 6 гистерэктомий при родоразрешении пациенток с ВП 5 были выполнены именно при экстренном КС ранее полных 37 недель беременности, что указывает на важность точного прогноза вероятности антенатального кровотечения. Можно предположить, что повышение проангио- генного потенциала плаценты, следствием которого является обширная неоваскуляризация [15], связано с дополнительным риском антенатального кровотечения на фоне сокращений миометрия, не связанных с родовой деятельностью. При оценке возможной связи уровня проангиогенной активности плаценты с вероятностью экстренного родоразрешения мы обнаружили, что при экстренном родоразрешении среди пациенток, включенных в исследование, имело место сниженное значение отношения sFlt-1/PlGF в III триместре беременности. Точность прогноза повышается при включении в модель анамнестических факторов, что может быть использовано для индивидуализированного прогноза и выбора срока родоразрешения пациенток группы высокого риска по ВП. Хотя ранее выполненные исследования [28] показали, что возраст не является независимым фактором риска ВП, тем не менее, включение этого предиктора в нашу модель повысило ее прогностические возможности.
Заключение
Таким образом, проведенное исследование показало, что повышение уровней сывороточных маркеров ангиогенеза в III триместре беременности может быть использовано для прогноза ВП и экстренного родо- разрешения у беременных с ПП.
Сильные стороны исследования: наличие контрольной группы с ПП, что позволяет оценить возможности прогноза ВП с использованием биомаркеров у пациенток группы высокого риска; исследование динамики показателей в различных сроках беременности в пределах III триместра беременности; определение вероятности экстренного родоразрешения для возможности дифференцированного подхода к выбору срока родоразрешения.
Ограничения исследования: в данной работе нет сопоставления сывороточного уровня исследуемых маркеров с показателями локального содержания исследуемых белков в зоне плацентации у пациенток с ВП и без ВП; ограниченный объем выборки повышает вероятность статистической погрешности.



