Материнская смертность является интегральным показателем, отражающим не только состояние здоровья женщин в репродуктивном возрасте, но и эффективность системы охраны материнства и детства. Несмотря на колоссальные успехи человечества во всех сферах жизнедеятельности в XXI в., здравоохранение не смогло искоренить материнскую смертность, ежегодно приводящую к гибели 303 000 женщин [1]. В настоящее время не вызывает сомнения, что основной причиной материнской смертности во все времена являлось акушерское кровотечение (АК), доля которого, несмотря на оптимизацию тактики ведения пациенток, неуклонно растет: в 1990 г. оно составляло 68%, а в 2015 г. – уже 80% общего числа материнских смертей [2, 3]. По данным экспертов ВОЗ, раннее послеродовое кровотечение (ПРК) определяется как потеря крови, равная 500 мл и более при родах через естественные родовые пути или 1000 мл и более при абдоминальном родоразрешении, возникшая в течение 24 ч после рождения плода. Кровотечение, дебют которого произошел позднее 24 ч, но ранее 42 дней послеродового периода, относится к позднему (вторичному) ПРК. Кроме того, любой объем кровопотери, приводящий к гемодинамической нестабильности, также следует рассматривать в качестве основного критерия развития факта послеродового кровотечения [4–6]. В отечественной практике АК, произошедшее в течение 2 ч после родов, долгое время классифицировалось как кровотечение в раннем послеродовом периоде, позже 2 ч после отделения последа – кровотечение в позднем послеродовом периоде. Подавляющее большинство летальных исходов, развившихся вследствие массивной кровопотери, относится к ранним ПРК. По мнению экспертов, неукоснительное соблюдение клинических рекомендаций позволило бы избежать большинства случаев материнской смертности [2]. Между тем, несмотря на проводимые мероприятия по профилактике кровотечения, от 50 до 76,6% кровотечений обусловлены гипо- или атонией матки [7]. По данным В.Е. Радзинского (2015), нарушение тонуса матки определяет около 70% всех АК [8]. При этом во многих европейских странах, в частности во Франции, АК вследствие атонии матки находятся на первом месте по частоте причин материнской смертности (16%), при этом в 80% случаев кровотечения признаются предотвратимыми [9–11].
Сегодня усилия ведущих мировых организаций направлены в первую очередь на профилактику и лечение ПРК; вопросы диагностики, несмотря на множество существующих методик, остаются окончательно нерешенными. Для практикующего врача любого стационара на сегодня основными методами оценки ПРК остаются визуальная оценка объема кровопотери и определение тонуса матки методом пальпации для выявления гипо- и атонии матки, причем данные методы рекомендованы в послеродовом периоде для всех женщин [12–14]. Визуальная оценка кровопотери субъективна и всегда занижена на 30–50%, ошибки при подсчете кровопотери способны достигать 89% случаев. Разница в оценке объема кровопотери визуальным способом и при использовании специальных методов исследования колоссальна, составляя порой при развитии кровотечения 1000 мл и более [15].
Таким образом, основной проблемой акушерских гипо- и атонических кровотечений на современном этапе является отсутствие качественной диагностики начала кровотечения при депонировании сгустков крови в полости матки. Рекомендуемые методы объективизации кровопотери мониторированием гемодинамических, лабораторных и других показателей не всегда совершенны, так как диагностируют кровопотерю ретроспективно, когда кровотечение уже свершилось, что делает невозможным своевременное начало оказания необходимой помощи, усугубляя тяжесть состояния пациентки.
Особый интерес на сегодня представляют станции ультразвукового контроля и мониторинга объема депонированной крови в послеродовом периоде при гипотоническом кровотечении. В данных устройствах объединены функции эхографического мониторинга объема послеродовой матки и компьютерной программы, позволяющей в любой момент времени в непрерывном автоматическом режиме определить количество депонированной крови, с высокой точностью своевременно диагностировать начало кровотечения и оповестить медицинский персонал [16]. Кроме того, в настоящее время разработана методика математического расчета объема полости матки путем определения площади максимального и перекрестного сечения полости матки путем трассировки полученных изображений. Полученная информация обрабатывается компьютерной программой, которая путем комплексной оценки объема полости 3D-модели послеродовой матки и объема наружной кровопотери позволяет достаточно точно рассчитать объем общей кровопотери в раннем послеродовом периоде [17].
Цель исследования предполагала оценку возможностей 3D-моделирования полости послеродовой матки в диагностике раннего гипотонического кровотечения.
Материалы и методы
Исследование включало проспективный анализ 60 случаев родов, произошедших на базе перинатального центра ГУЗ «Краевая клиническая больница» (Чита) и ГБУЗ «Республиканская клиническая больница имени Г.Г. Куватова» (Уфа) в период 2018–2020 гг. Исследование предполагало 3D-моделирование полости матки в двух исследуемых группах: 1-я группа включала 40 пациенток, у которых в раннем послеродовом периоде отмечалась физиологическая кровопотеря; 2-я группа – 20 пациенток, послеродовый период которых осложнился ранним гипотоническим кровотечением. Критерии исключения: кровотечения, развившиеся вследствие травмы родовых путей, повреждения варикозно расширенных сосудов, задержки плацентарной ткани или коагулопатии, оперативное родоразрешение, многоплодие, наличие миоматозных узлов. Исследуемые группы сопоставимы как по возрасту, так и по экстрагенитальной патологии. Клиническое обследование пациенток проводилось в соответствии с существующими клиническими рекомендациями. При проведении исследования учтены требования Хельсинкской декларации Всемирной медицинской ассоциации (2013), у всех пациенток получено добровольное информированное согласие, с пациентками проведена беседа об алгоритме предстоящего исследования [16]. Оценка объема послеродовой кровопотери проводилась с помощью калиброванного пакета-приемника Brass-V и взвешивания салфеток, пропитанных кровью.
Эхографическое исследование послеродовой матки проводилось в динамическом режиме каждые 10 минут в течение 2 ч с момента рождения последа при помощи ультразвукового аппарата марки MySono U5 Samsung Medison (Samsung Medison Bldg, Корея). Для проведения исследования использовался конвексный датчик с частотой преобразователя, равной 3,5–5,0 МГц. Трансабдоминальный доступ датчика наряду с использованием «поискового режима» позволял получать изображения продольного и перекрестного сечений полости матки, площадь которых оценивали после фиксации изображений за счет трассировки контуров соответствующих сечений, которые наряду с максимальным переднезадним размером полости в последующем служили субстратом для создания графической модели послеродовой матки (рис. 1).
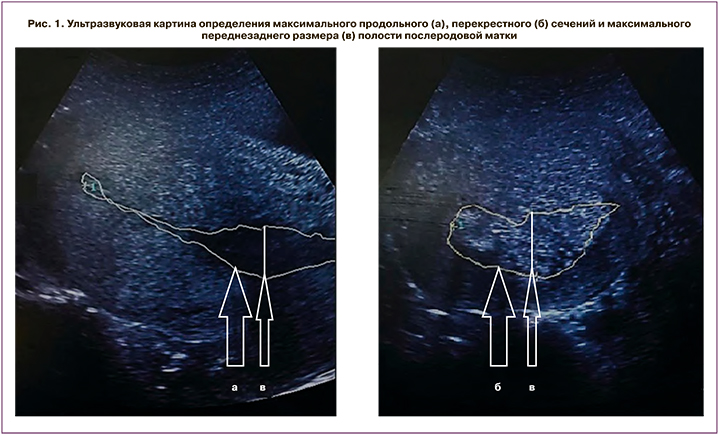
Ширину и длину полости матки определяли в соответствии со стандартной методикой [15].
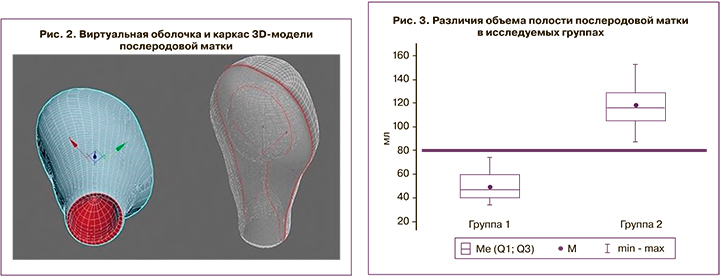
На основании полученных эхограмм в программе Autodesk 3ds Max (Autodesk, Inc. USA) создавался каркас 3D-модели послеродовой матки, включающий полость матки, детализация объема которой осуществлялась за счет «привязки» положений точек, линий и полигонов к значениям исследуемых эхографических параметров (рис. 2).
Изменение модели при введении исследуемых параметров происходит динамически, за счет прямой привязки переменных окна для ввода с соответствующими структурами окна проекции. Для построения модели, позволяющей оценить объем крови, депонированной в полости матки, требуется 0,5 (0,4; 0,7) минуты.
Статистический анализ
В основу статистического анализа результатов исследования положены принципы Международного комитета редакторов медицинских журналов (ICMJE) и рекомендации «Статистический анализ и методы в публикуемой литературе» (SAMPL) [18]. Исходя из численности групп, равной 40 и 20 человек, для оценки нормальности распределения признаков использовали критерий Шапиро–Уилка. Учитывая распределение признаков, отличное от нормального, полученные данные представлены в виде медианы, первого и третьего квартилей: Me (Q1;Q3). Статистическая значимость различий показателей между группами оценивалась путем определения критерия Манна–Уитни (U) и уровня значимости p. Номинальные данные описывались путем указания абсолютных значений и процентных долей. Для оценки статистической значимости различий номинальных показателей использовался критерий χ2 Пирсона. Во всех случаях р<0,05 считали статистически значимым. Степень параллелизма изменений исследуемых количественных параметров оценивалась с помощью коэффициента корреляции Спирмена, сила связи – за счет сопоставления коэффициента корреляции с соответствующими значениями шкалы Чеддока [18]. Для проведения статистического анализа использовалась программа IBM SPSS Statistics Version 25.0 (International Business Machines Corporation, license No. Z125-3301-14, США).
Результаты и обсуждение
В 1-й исследуемой группе роды наступили на сроке 39,0 (38,4;38,8) недели, во 2-й группе – на сроке 40,0 (39,5;40,1) недели (U=188,0; p=0,001). Частота родовозбуждения и родостимуляции окситоцином в 1-й группе составила 17,5% (7/40), во 2-й группе – 40% (8/20) случаев (χ2=5,74; p=0,02). У женщин 1-й исследуемой группы предстояли 1,0 (1,0;1,6) роды, 2-й группы – 2,0 (1,6;2,1) роды (U=288,0; p=0,049). Масса новорожденных в 1-й группе составила 3300,0 (3221,5;3380,1) г, во 2-й группе – 3450,0 (3369,4;3602,6) г (U=315,5; p=0,19). Частота родов крупным плодом в 1-й группе составила 7,5% (3/40), во 2-й группе – 20% (4/20) случаев (χ2=2,02; p=0,16). Общая длительность процесса родов в 1-й группе была равна 435,0 (397,1;455,1) минуты, во 2-й группе – 370,0 (373,2;440,8) минуты (U=374,0; p=0,68). Длительность второго периода родов в 1-й группе составила 40,0 (37,5;43,9) минуты, во 2-й группе – 35,0 (33,6;42,9) минуты (U=340,5; p=0,34). Объем общей кровопотери в 1-й группе составил 365,0 (353,5;394,5) мл, во 2-й группе – 1030,0 (1027,1; 1105,9) мл (U=0,0; p< 0,001).
Исследуемые группы, несмотря на малую численность, статистически значимо отличались по всем изучаемым ультразвуковым параметрам, за исключением длины полости матки (табл. 1).

Обращает на себя внимание не столько наличие статистически значимых различий между исследуемыми группами, сколько значение объема полости матки, которое при неосложненном течении раннего послеродового периода не превышало 80 см3 (рис. 3).
Для определения корреляции между значениями параметров эхографического исследования и объемом полости матки использовали коэффициент Спирмена (табл. 2).
Отсутствие статистической значимости длины полости матки в развитии гипотонического кровотечения, вероятно, связано с большей тропностью окситоцина к продольным мышечным волокнам и меньшей – к циркулярным и косым мышечным волокнам миометрия матки. Между тем, при оценке силы связи между исследуемыми ультразвуковыми параметрами и объемом полости матки, обращает на себя внимание наличие высокой тесноты связи между значением максимального переднезаднего размера, максимального продольного и перекрестного сечения и объемом полости матки. Следовательно, измерение ширины для оценки объема полости матки в данной ситуации также является нецелесообразным.
Определенный интерес, учитывая наличие ультразвуковых параметров с высокой теснотой связи, составляет вопрос о необходимости определения объема полости послеродовой матки для диагностики раннего гипотонического кровотечения. Поэтому для исключения или подтверждения данного гипотетического предположения с помощью критерия корреляции Спирмена определена фактическая степень параллелизма между всеми исследуемыми параметрами и объемом общей кровопотери (табл. 3).
Таким образом, между объемом полости матки и объемом общей кровопотери имеется связь, близкая к функциональной. Данный факт определяет наибольшую значимость объема полости матки в диагностике раннего гипотонического кровотечения по сравнению с другими исследуемыми параметрами.
При достижении объема полости матки более 80 см3 в раннем послеродовом периоде гипотоническое кровотечение развивалось в течение 3,0 (2,6; 3,4) минуты.
Заключение
Определение объема полости послеродовой матки с помощью 3D-моделирования имеет высокую диагностическую значимость в доклинической оценке факта развития раннего гипотонического кровотечения, что позволяет рекомендовать данную методику для применения в клинической практике.



