Профилактика инфекционно-воспалительных осложнений (ИВО) в послеродовом периоде является важной медицинской и социальной проблемой, так как ИВО остаются одной из основных причин материнской заболеваемости. В настоящее время частота послеродовых воспалительных осложнений составляет 5–26% и не имеет отчетливой тенденции к снижению [1–5]. Растущее число антибиотикорезистентных микроорганизмов, наряду с профилактическим применением антибиотиков (АБ) широкого спектра действия, приводит к необходимости поиска новых эффективных профилактических мероприятий для снижения частоты ИВО в послеродовом периоде [6–8]. В последние годы все большую популярность завоевывают низкоэнергетические лазеры неповреждающего действия, которые отличаются простотой применения, портативностью, широтой терапевтического диапазона [9–11]. В клинической практике достаточно широко используется методика внутривенного лазерного облучения крови (ВЛОК) [12]. Известные механизмы воздействия лазерного излучения позволяют предложить его как современный метод профилактики и лечения послеродовых воспалительных осложнений [13, 14], так как лазерное воздействие приводит к уменьшению интерстициального и внутриклеточного отека, улучшению кровотока в тканях, активации транспорта веществ через сосудистую стенку, а также интенсивному формированию сосудов, особенно капилляров [15, 16]. Кроме того, ВЛОК способствует улучшению реологических свойств, регуляции гемостатического потенциала крови и микроциркуляции, обладает противовоспалительным действием, нормализует протеолитическую активность крови [17, 18]. Известно, что в системе регуляции агрегатного состояния крови важную роль играют тромбоциты, отвечающие за начальный этап гемостаза. Широкий диапазон функциональной активности этих клеток предполагает их участие в обеспечении коагуляции, репарации сосудистой стенки, депонировании и транспорте биологически активных соединений, осуществлении защитных реакций организма [19]. Высокая реактивность тромбоцитов в ответ на изменения внутренней среды организма позволяет рассматривать их как один из наиболее удобных и информативных тест-объектов для оценки нарушений гомеостаза и эффективности его коррекции.
Цель исследования: оценить влияние ВЛОК как метода профилактики ИВО на морфофункциональные показатели тромбоцитов у родильниц после кесарева сечения.
Материал и методы исследования
Группу исследования составили 126 родильниц после операции кесарева сечения. Всем родильницам была проведена антибиотикопрофилактика амоксиклавом 1,2 г внутривенно за 15 минут до разреза на коже. Далее были выделены две группы исследования: I (основную) группу составили 65 родильниц, которым с первого дня послеоперационного периода проводили ВЛОК на аппарате «Соларис» (Россия) с гелий-неоновым излучением длиной волны 0,63 нм, с мощностью излучения на выходе 1,0 мвт, время экспозиции 15 минут, в течение 5 дней ежедневно. Вторую группу (сравнения) составила 61 родильница, которым проводили только антибиотикопрофилактику перед операцией. Распределение родильниц по группам проводили методом случайной выборки. Обследуемые обеих групп были сопоставимы по соматической и акушерско-гинекологической патологии. Критерии включения пациенток в исследование: родильницы после операции кесарева сечения, представляющие группу риска ИВО по акушерской патологии (безводный промежуток >12 часов, наложение швов на шейку матки при истмико-цервикальной недостаточности, затяжные роды) в сочетании с экстрагенитальной патологией (хронические воспалительные заболевания желудочно-кишечного тракта, гепатобилиарной и мочевыделительной систем, перенесенные острые инфекционные заболевания во время беременности). Критерия исключения: антибиотикотерапия; массивная кровопотеря; тяжелая акушерская патология (тяжелая преэклампсия, катастрофический антифосфолипидный синдром); заболевания, являющиеся противопоказанием для проведения ВЛОК (сердечно-легочная и сердечно-сосудистая патология в стадии декомпенсации; болезни крови; печеночная и почечная недостаточность в стадии декомпенсации; лихорадочные состояния; тяжелые формы тиреотоксикоза; психические заболевания; выраженная гипотония; непереносимость фактора).
С целью изучения влияния ВЛОК на морфофункциональное состояние тромбоцитов всем родильницам на 1-е и 6-е сутки проведены исследования периферической крови с целью подсчета тромбоцитов иммуноферментным методом с помощью тест-систем фирмы R&D Systems Quantikine. При исследовании системы гемостаза определяли концентрацию фибриногена (по методу Р. Рутберг, г/л); протромбиновый индекс (ПТИ) (по Квику, %). Тромбоэластографическое исследование крови проводили на тромбоэластографе фирмы Hellige (Германия). Агрегацию тромбоцитов оценивали фотометрическим методом Borne с использованием в качестве стимуляторов агрегации растворов аденозиндифосфата в концентрации 1×103 и в реакции коллаген-агрегации [20].
Морфофункциональное состояние тромбоцитов периферической крови исследовали в режиме реального времени методом когерентной фазовой микроскопии (КФМ) с использованием модуля когерентной фазовой микроскопии «Биони-КФМ» аппаратно-программного комплекса (АПК) для клинической и лабораторной диагностики с цифровой обработкой изображения (ООО «Весттрейд», Москва) [21]. В основе работы модуля – регистрация фазы света путем модуляции опорной волны, то есть аппаратный способ интерферометрии. Источник когерентного излучения – гелий-неоновый лазер с длиной волны l=630 нм. Прибор обеспечивает измерение интегральных параметров фазовых микрообъектов с большой чувствительностью, а применение метода автоматизированной расшифровки интерферограмм позволяет достигнуть разрешающей способности измерения ОРХ λ/150, где λ – длина волны излучения, при времени измерения 30 сек. [11]. Венозную кровь (2–3 мл) заготавливали в пробирку из ареактивного пластика («Sarstedt Monovette», Германия) с антикоагулянтом (ЭДТА). Для приготовления плазмы, обогащенной тромбоцитами, кровь центрифугировали при 1000 об/мин в течение 5–7 минут. Взвесью клеток заполняли камеру Горяева, рабочая поверхность которой имела зеркальное напыление. После 3–5-минутного интервала, необходимого для оседания клеток, производили сканирование изучаемых цитообъектов. Оптимальный объем выборки составлял 50–100 клеток. Время измерения одного интерференционного поля размером 10×10 мкм (m=n=128 пикселей), соответствующего изображению одной клетки – 12 секунд. Результат обратного преобразования цифрового массива в видимое изображение и восстановление фазового портрета объекта отображались на экране монитора компьютера. Результаты расчетов выводили на дисплей в виде таблицы параметров каждого объекта и серии графиков. Оценивали морфометрические (диаметр, периметр, высота, площадь, объем) показатели, особенности морфологии каждой клетки, а также гетерогенность циркулирующей популяции тромбоцитов по анализируемым параметрам.
Статистический анализ проводили с помощью алгоритмов среды MatLab, математических пакетов Statistica 6.0 и MedCalc Statistical. Стандартная обработка выборок включала подсчет значений средних арифметических величин, ошибок средних и среднего квадратичного отклонения. Для сравнительного анализа данных в исследуемых группах использовался U-тест по методу Манна–Уитни, Т-критерий Стьюдента и метод χ2.
Результаты и обсуждение
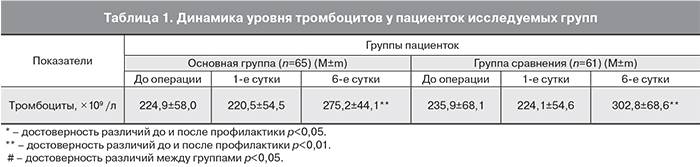
Возраст обследованных родильниц обеих групп был от 18 до 42 лет. Средний возраст родильниц основной группы составил 31,2±5,4 года, группы сравнения – 30,5±5,1 года (р>0,05). Анализ исходных данных соматического и акушерско-гинекологического статуса родильниц в обеих группах показал высокую частоту экстрагенитальной патологии и наличие хронических очагов инфекции, воспалительные осложнения после предыдущих родов и осложненное течение данной беременности и родов (перенесенные острые инфекционные заболевания, анемия, наложение швов при истмико-цервикальной недостаточности, безводный промежуток >12 часов, затяжные роды), что по совокупности факторов позволяет отнести исследуемых пациенток к группе риска по развитию воспалительных послеродовых осложнений [22]. Все пациентки исследуемой группы были сопоставимы и не имели достоверных различий по экстрагенитальной и гинекологической патологии. Все беременные были родоразрешены путем поперечного надлобкового чревосечения с разрезом матки в нижнем сегменте. Доля плановых операций кесарева сечения в I группе составила 58,5%, во II группе – 63,9%. В экстренном порядке родоразрешено 41,5 и 36,1% соответственно по группам. Основной группе родильниц в послеоперационном периоде начато проведение ВЛОК с целью профилактики ИВО. Показатели уровня тромбоцитов представлены в табл. 1.
Анализ динамики уровня тромбоцитов выявил их достоверное повышение к 6-м суткам как в I группе (с 220,5±54,5 до 275,2±44,1×109/л), так и во II (с 224,1±54,6 до 302,8±68,6×109/л) (р<0,05). В то же время отмечалась тенденция к тому, что на фоне проведения ВЛОК динамика нарастания тромбоцитов была менее выраженной, чем в группе стандартной антибиотикопрофилактики (р>0,05). Увеличение количества тромбоцитов можно рассматривать как компенсаторную реакцию на кровопотерю при оперативном родоразрешении.
При исследовании морфологических показателей тромбоцитов и их изменений при ВЛОК у родильниц после кесарева сечения выделяли 4 основных морфологических типа, характеризующих ту или иную степень их активации [23]. Основой для дискриминации структурно измененных клеток служили различные варианты их формы, характера рельефа поверхности, наличие псевдоподий, их количество и величина, что представлено на рис. 1 (см. на вклейке).
Плоские округлые клетки с гладкой или складчатой поверхностью ― «гладкие» и «рифленые» дискоциты соответствовали I типу. Ко II морфологическому типу тромбоцитов относили клетки округлой или неправильной формы с гладкой или складчатой поверхностью и 1–3 короткими (меньше диаметра клетки) отростками-псевдоподиями, являющимися выростами поверхностной мембраны. Клетки, имеющие около 2–5 длинных (больше диаметра клетки) отростков, представляли III тип и отличались большим многообразием форм: от плоских дисков до клеток неправильной формы. Тромбоциты неправильной формы с неровной бугристой поверхностью, большим количеством отростков различной длины и многочисленными вакуолями были отнесены к IV морфологическому типу – дегенеративно-измененным клеткам.
Гладкие и рифленые дискоциты являются так называемыми формами «покоя». Тромбоциты II–III типов, отличающиеся появлением отростков различного числа и длины, а также изменением их формы, связанной с перестройкой цитоскелета и структуры грануломера, проявляют внешние признаки функциональной активности. Клетки IV типа – тромбоциты, исчерпавшие свой функциональный потенциал.
Установлено, что в условиях физиологической нормы 63% тромбоцитов представлены клетками «покоя», 21% – тромбоцитами с низким уровнем активации (II тип). Количество высоко активированных клеток с длинными отростками-«антеннами» составляет 12% (III тип), а дегенеративно-измененных (IV тип) – 4%.
Изменения морфологической структуры циркулирующей популяции тромбоцитов периферической крови у родильниц двух групп в послеоперационном периоде представлены на рис. 2.
Анализ данных показал, что у обследованных родильниц после кесарева сечения по сравнению с нормативными показателями наблюдалось повышение функциональной активности тромбоцитов, о чем свидетельствовало уменьшение форм «покоя» (45,7 и 41,2% в основной группе и группе сравнения соответственно), увеличение тромбоцитов с низким (40,3 и 41,8% соответственно) и высоким (13,7 и 14,0% соответственно) уровнем активности, что можно классифицировать как «состояние напряжения» тромбоцитарного гемостаза.
После проведения ВЛОК у родильниц основной группы было зафиксировано увеличение клеток «покоя» от 45,6 до 50,6%, уменьшение процента активных тромбоцитов в циркулирующей популяции II (от 40 до 36%) и III типов (от 13,6 до 12%). Данный факт свидетельствует о снижении суммарной адгезивной и агрегационной способности тромбоцитов; в то время как в группе сравнения содержание клеток «покоя» оставалось практически неизменным (41,25 и 41%), на исходном уровне сохранялся процент тромбоцитов II типа (41,25 и 40%), а тромбоцитов III типа – повышался от 14 до 16,5%, то есть регистрировалась достаточно высокая активность тромбоцитов.
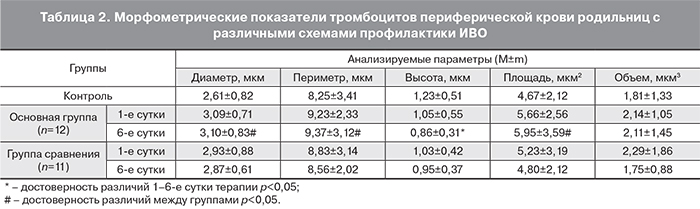
Морфометрические показатели тромбоцитов суммированы в табл. 2. Важно отметить, что по величине диаметра, периметра и площади можно косвенно судить о возрастном составе (молодые, зрелые и старые клетки) и функциональной активности клеточной популяции. Фазовая высота, как оптический показатель клетки, позволяет оценить полноценность гранулярного аппарата: снижение фазовой высоты клетки связано с реакцией выброса активированного тромбоцита.
Анализ витальных размерных параметров фазовых портретов тромбоцитов, представленных в табл. 2, продемонстрировал, что у родильниц после кесарева сечения на 1-е послеоперационные сутки средние в популяции диаметр, периметр, площадь и объем циркулирующих клеток превышали контрольные значения на 18,4 и 12,3%, 11,8 и 7,0%, 21,2% в основной группе и на 12,0, 18,2 и 26,5% в группе сравнения (р>0,05). Фазовая высота тромбоцитов, отражающая состояние тромбоцитарного грануломера, в обеих группах исходно была достоверно снижена на 14,7 и 16,3% по отношению к контрольным величинам.
К 6-м суткам наблюдения в группе сравнения наблюдалась нормализация клеточных параметров: средние в популяции диаметр, периметр, площадь и объем тромбоцитов имели тенденцию к уменьшению. В основной группе средние значения диаметра, периметра и площади тромбоцитов после проведения ВЛОК по-прежнему превышали контрольные величины. Однако следует признать, что реакция на лазерное облучение крови у пациенток была не однозначной. У 1 родильницы (8,3%) размерные показатели тромбоцитов до и после лазеротерапии оставались без изменений; у 2 (16,7%) было зарегистрировано увеличение морфометрических показателей по отношению к исходным величинам, в среднем на 10–12%; у остальных женщин (75%) размерные параметры (диаметр, периметр и площадь) циркулирующих тромбоцитов имели тенденцию к нормализации, снижаясь по сравнению с исходными значениями в среднем на 5–7%. Фазовая высота клеток у всех пациенток оставалась низкой. Учитывая особенности морфологической структуры тромбоцитов у пациенток основной группы после проведения ВЛОК, не исключено, что увеличенные размерные параметры клеток могут быть связаны с появлением в русле молодых тромбоцитов, обладающих большими морфометрическими показателями, но нормальным функциональным статусом.
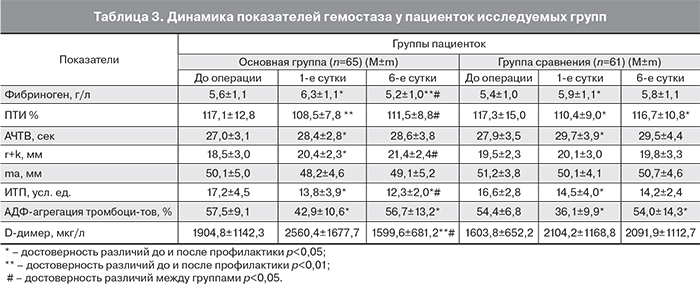
Динамика показателей системы гемостаза у родильниц исследуемых групп представлена в табл. 3.
Анализ полученных показателей гемостазиограммы показал, что в 1-е послеоперационные сутки у родильниц обеих групп отмечалась физиологическая гиперкоагуляция, при этом достоверных различий показателей между группами не выявлено (р>0,05). К 6-м суткам в основной группе пациенток с применением ВЛОК происходит достоверное снижение концентрации фибриногена с 6,3±1,1 г/л до 5,2±1,0 г/л. У пациенток группы сравнения, которым проводилась стандартная антибиотикопрофилактика, не выявлено значимых изменений в показателях концентрации фибриногена: 5,9±1,1 г/л и 5,8±1,1 г/л (р>0,05). В обеих исследуемых группах отмечен рост показателя ПТИ. Однако в основной группе отмечается лишь тенденция к увеличению ПТИ с 108,5±7,8% до 111,5±8,8% (р>0,05), а в группе сравнения выявлен достоверный рост с 110,4±9,0% до 116,7±10,8% (р<0,05).
Анализ тромбоэластограммы выявил, что при исходно сопоставимом уровне r+k в исследуемых группах (20,4±2,3 мм в I группе и 20,1±3,0 мм во II группе, р>0,05), к 6-м суткам в I группе отмечена тенденция к удлинению r+k до 21,4±2,4 мм (р>0,05), во II группе, напротив, к укорочению до 19,8±3,3 мм (р>0,05). Индекс тромбодинамического потенциала (ИТП) к 6-м суткам достоверно снижался в I группе с 13,8±3,9 усл. ед. до 12,3±2,0 усл. ед. (р<0,05), во II группе значимых изменений не было: 14,5±4,0 усл. ед. и 14,2±2,4 усл. ед. (р>0,05). Одним из показателей активности внутрисосудистого свертывания является уровень Д-димера. В результате проведения профилактических мероприятий с использованием ВЛОК к 6-м суткам отмечено достоверное снижение Д-димера с 2560,4±1677,7 мкг/л до 1599,6±681,2 мкг/л (р<0,01), в группе со стандартной антибиотикопрофилактикой имела место лишь тенденция к снижению Д-димера с 2104,2±1168,8 мкг/л до 2091,9±1112,7 мкг/л (р>0,05).
Таким образом, на фоне применения ВЛОК у родильниц наблюдается нормализация морфофункционального состояния циркулирующих тромбоцитов, снижаются показатели концентрации фибриногена и ИТП, отмечается тенденция к удлинению r+k, снижается уровень Д-димера, что свидетельствует о снижении коагуляционного потенциала крови и позволяет использовать ВЛОК в качестве профилактики послеоперационных тромботических осложнений.
Заключение
Несмотря на активное применение в клинике ВЛОК [24–26], интимные механизмы влияния лазерного облучения на морфофункциональное состояние клеток крови изучены недостаточно. В результате проведенного нами исследования установлен интегральный корригирующий эффект ВЛОК на функциональную активность циркулирующих тромбоцитов. Проведение ВЛОК у родильниц в послеоперационном периоде в комплексе профилактических мероприятий способствует увеличению числа тромбоцитов покоя, снижению уровня активных тромбоцитов, что приводит к подавлению суммарной адгезивной и агрегационной способности тромбоцитов. При этом средние значения диаметра, периметра и площади тромбоцитов несколько превышают контрольные величины. Полученные данные могут свидетельствовать о том, что увеличенные размерные параметры клеток у пациенток основной группы после проведения ВЛОК могут быть связаны с появлением в русле субпопуляции молодых тромбоцитов, обладающих большими морфометрическими показателями, но нормальным функциональным статусом [27]. Проведение курса ВЛОК способствует уменьшению коагуляционного потенциала крови, о чем свидетельствует снижение концентрации фибриногена и ИТП, удлинение показателя r+k, а также снижение активности внутрисосудистого свертывания, о чем свидетельствовало снижение уровня Д-димера. Все это, в свою очередь, приводит к увеличению скорости периферического кровотока, улучшению микроциркуляции и оксигенации тканей. Улучшение в системе микроциркуляции также обусловлено вазодилатацией и изменением реологических свойств крови за счет снижения ее вязкости, уменьшения агрегатной активности тромбоцитов и эритроцитов вследствие изменения их физико-химических свойств, в частности повышения отрицательного электрического заряда. В результате достигается активация микроциркуляции, раскрытие капилляров и коллатералей, что способствует быстрой репарации тканей [28–30].
Совокупность установленных эффектов позволяет рекомендовать ВЛОК в комплексе профилактических мероприятий развития ИВО у родильниц.



