Большая распространенность избыточной массы тела и ожирения в современный период становятся глобальной проблемой общества, которая требует рассмотрения и с позиций репродуктивного здоровья женщины. Согласно современным представлениям, ключевым фактором ожирения является энергетический дисбаланс. Генеративным нарушениям способствует биологическая активность жировой ткани. На сегодняшний день четверть населения экономически развитых стран мира имеют массу тела, которая на 15% превышает нормативные значения. По прогнозам экспертов ВОЗ, к 2025 году в мире будет насчитываться более 300 000 млн людей с ожирением [1−4].
Избыточная масса тела и ожирение – наиболее распространенные заболевания в индустриально развитых и развивающихся странах. Оно связано с высоким риском развития нарушений репродуктивного здоровья (дисфункцией яичников, бесплодием, различных гиперпластических процессов, некоторых разновидностей рака), гипертензии, сердечно-сосудистых заболеваний, сахарного диабета и др.
Эндокринно-метаболические аспекты избыточной массы тела и ожирения продолжают оставаться объектом пристального внимания исследователей разных специальностей в связи с их выраженным влиянием на качество жизни пациентов во все возрастные периоды [5, 6].
 Лептин регулирует энергетический баланс организма, воздействуя на липидный обмен [7, 8], репродуктивную функцию [9, 10] и проявляет другие важные биологические эффекты [11–13]. За счет вовлечения лептина в центральные механизмы регуляции массы тела он непосредственно влияет на энергетический гомеостаз всего организма [8, 14]. Воздействуя на гипоталамические структуры мозга, лептин способствует снижению потребления пищи и увеличению энергозатрат [9].
Лептин регулирует энергетический баланс организма, воздействуя на липидный обмен [7, 8], репродуктивную функцию [9, 10] и проявляет другие важные биологические эффекты [11–13]. За счет вовлечения лептина в центральные механизмы регуляции массы тела он непосредственно влияет на энергетический гомеостаз всего организма [8, 14]. Воздействуя на гипоталамические структуры мозга, лептин способствует снижению потребления пищи и увеличению энергозатрат [9].
Известно, что становление репродуктивной системы в организме подростков находится в тесной взаимосвязи с системой энергетического баланса [15]. Лептин и инсулин являются ключевыми гормонами, сигнализирующими в гипоталамус о пищевом статусе индивидуума [16]. Общепризнанно, что их физиологическая роль состоит в модуляции активности гипоталамических нейронов, секретирующих гонадолиберины [17, 18]. Наряду с этим доказано, что лептин играет важную роль в становлении начала пубертата у многих видов млекопитающих и человека [19, 20].
Имеются также сообщения о способности инсулина стимулировать экспрессию и секрецию гонадолиберина в культуре ткани нейронов гипоталамуса [21]. Долгое время в центре внимания исследователей были метаболические эффекты, связанные с регуляцией углеводного и жирового обмена, которые реализуются в чувствительных к инсулину тканях, таких как печень, мышцы, жировая ткань [22]. В то же время регулирующее влияние инсулина на систему гипоталамус-гипофиз-яичники и комплекс процессов, связанных с реализацией репродуктивной функции женщины, оказалось в поле зрения исследователей относительно недавно. Поэтому представляет интерес изучение роли базального уровня лептина и инсулина в формировании нарушений менструального цикла у девушек-подростков, а именно аномальных маточных кровотечений (АМК), через их влияние на продукцию гонадотропинов.
Целью настоящего исследования было изучение ассоциации ФСГ, ЛГ и пролактина с базальным уровнем лептина и инсулина при АМК у девушек-подростков с различной массой тела.
Материал и методы исследования
Обследовали 146 девушек-подростков с АМК в возрасте от 11 до 18 лет, которые находились на лечении в отделении детской гинекологии ГУ Институт охраны здоровья детей и подростков Национальной академии медицинских наук Украины. В зависимости от физического развития все больные были распределены на три группы: Ι группа – 58 подростков с физиологическими параметрами роста и веса (индекс массы тела (ИМТ) 19,3±0,16); ΙΙ группа – 57 девочек с избыточной массой тела (ИМТ 26,4±0,51); ІІІ группа – 31 подросток с дефицитом массы тела (ИМТ16,4±0,18). О функциональном состоянии гонадотропной функции судили по определению концентраций ЛГ, ФСГ иммуноферментным методом на фотометре Humareader (Германия) с помощью стандартных коммерческих наборов фирмы Human (Германия). Пролактин (ПРЛ) определяли в сыворотке крови радиоиммунологическим методом с использованием стандартных наборов фирмы Immunotech (Чехия), лептин – методом иммуноферментного анализа на фотометре Humareader (Германия) при помощи стандартних коммерческих наборов. Выраженность инсулинемии оценивали по уровню иммунореактивного инсулина (ИРИ) в плазме крови радиоиммунологическим методом.
Все медицинские мероприятия, осуществляемые в соответствии с регламентом обследования пациенток, прошли согласование в Комитете по медицинской биоэтике при институте, действующем в соответствии с рекомендациями Комитета по биоэтике Президиума НАМН Украины. От пациенток и их родителей получено информированное согласие. Данные хранятся в историях болезней, а также в компьютерной базе данных. Участники исследования и их родители проинформированы о результатах собственного обследования.
Статистическую обработку результатов проводили с помощью компьютерной программы Statgraphics plus for Windows 6,0 (Manugistic Inc., USA). Для характеристики вариационных рядов значений гормонов были использованы следующие параметры: M – среднее арифметическое, SE − ошибка среднего, 95% CI – 95% доверительный интервал, Min – минимальное значение, Max-максимальное значение.
Ассоциация гонадотропинов с лептином и инсулином анализировалась методом множественного регрессионного анализа. Данные представлены в виде таблиц набора независимых переменных (лептин и инсулин), дающих статистически значимый вклад в вариабельность зависимых переменных (ФСГ, ЛГ и ПРЛ). Статистической оценкой ассоциации является коэффициент детерминации (R2) и уровень значимости регрессионной модели (Р).
Результаты исследования и их обсуждение
Статистический анализ содержания гонадотропинов и ПРЛ в сыворотке показал высокую степень вариабельности этих гормонов у девушек с АМК (табл. 1). В связи с тем, что достоверных различий в их содержании в зависимости от паспортного и менструального возраста выявлено не было, мы привели средние значения по группам в целом.
Так как задачей данного исследования было выявление ассоциаций между гонадотропинами, ПРЛ с одной стороны, и лептином и инсулином с другой, то использованный нами множественный регрессионный анализ позволил оценить, в какой степени вариабельность гонадотропинов при АМК можно объяснить за счет вариабельности гормонов, регулирующих энергетический баланс.
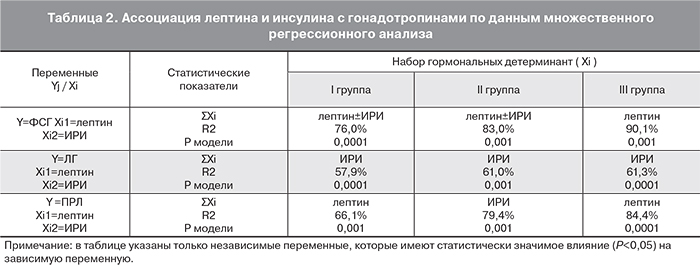
Несмотря на то что объектом непосредственного действия лептина и инсулина являются нейроны гипоталамуса, синтезирующие гонадолиберины, мы высказали предположение о том, что возможна ассоциация между этими гормонами и гонадотропинами. Так как девушки с различной массой тела имеют различный энергетический баланс, то мы предположили, что соотношение влияния лептина и инсулина на гонадотропины будет различным. Поэтому анализ ассоциации исследуемых гормонов проводился отдельно по группам. Результаты анализа влияния лептина и инсулина на гонадотропины представлены в табл. 2.
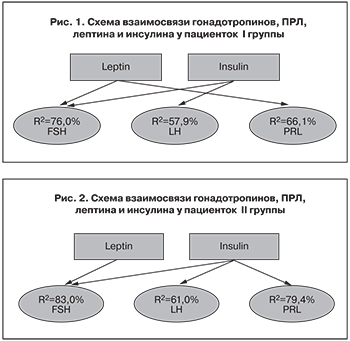
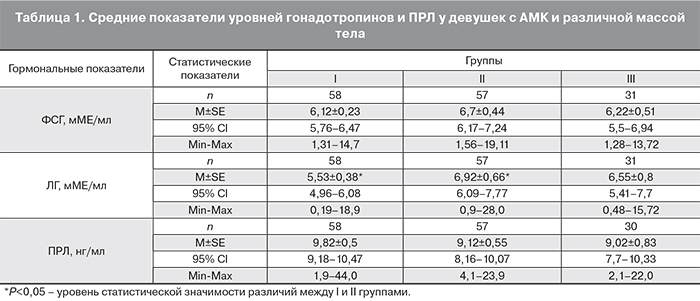
В результате множественного регрессионного анализа были выявлены различия влияния метаболических гормонов на ФСГ, которые зависели от энергетического статуса девушек с АМК. У пациенток со сбалансированным энергетическим метаболизмом (Ι группа) и со склонностью к накоплению энергетических запасов (ΙΙ группа) лептин и инсулин с высокой степенью статистической значимости (р=0,00001) детерминируют вариабельность продукции ФСГ гипофизом (RI2=76%, RII2=83% соответственно; рис. 1, 2).
 У девушек со сниженным уровнем энергетических ресурсов лептин имеет доминирующее влияние на продукцию ФСГ (R2=90% ; р=0,001; рис. 3).
У девушек со сниженным уровнем энергетических ресурсов лептин имеет доминирующее влияние на продукцию ФСГ (R2=90% ; р=0,001; рис. 3).
ФСГ производит трофическое воздействие на яичник, стимулирует рост, развитие и дозревание фолликулов, а это невозможно без необходимых энергетических ресурсов и определенного уровня обмена углеводов. Поэтому становится понятным значение в секреции ФСГ инсулина как реализующего фактора углеводного обмена, и лептина, информирующего об энергетических запасах. Можно предположить, что при сниженных энергетических резервах в организме доминирующей становится информация об их уровне, то есть основное влияние оказывает только лептин.
Далее было выявлено, что независимо от массы тела значимое влияние на продукцию ЛГ оказывает базальный уровень инсулина. Этот гормон детерминирует 57–61% вариабельности ЛГ у девушек с АМК (табл. 2). Хотя в литературе есть сведения о том, что у женщин репродуктивного возраста без нарушений менструальной функции колебания уровня ЛГ синхронны с колебаниями лептина, у пациенток с АМК более значимое влияние имел только уровень инсулина. Инсулин непосредственно влияет на функцию гипоталамических нейронов, его повышение усиливает синтез гонадолиберина гипоталамуса, что приводит к увеличению секреции ЛГ, а инсулиновая недостаточность вызывает снижение чувствительности гонадотрофов гипофиза к действию гонадолиберина, что приводит к снижению концентрации ЛГ [23]. Таким образом, можно предположить, что у пациенток с АМК для секреции ЛГ более важным является реальный уровень углеводов, источник энергетических ресурсов.
Были выявлены также различия влияния метаболических гормонов на уровень ПРЛ. Так лептин детерминирует 66,1% вариабельности ПРЛ у девушек с нормальной массой тела (І группа) и 84,4% − у пациенток с недостаточностью массы тела (ІІІ группа). У больных с избыточной массой тела (ІІ группа) инсулин детерминирует 79,4% вариабельности ПРЛ.
Таким образом, полученные нами данные позволяют утверждать, что лептин и инсулин оказывают избирательное влияние на продукцию гонадотропинов и ПРЛ у подростков с АМК, которое зависит от типа энергетического обмена. Действие лептина направлено на метаболические нейроэндокринные процессы. Он является модулятором, сигнальным гормоном, который в определенной мере руководит нейроэндокринной функцией и играет важную роль в регуляции репродуктивной системы. Инсулин – один из важнейших факторов, который через влияние на гипоталамус контролирует секрецию ЛГ и ФСГ.
Все вышесказанное свидетельствуют о значительном влиянии лептина и инсулина на продукцию гипофизарных гормонов у пациенток с АМК. Это дает основание говорить о существенной роли лептина и инсулина в возникновении маточных кровотечений в пубертатном возрасте и указывает на необходимость включения в алгоритм обследования пациенток с АМК содержания инсулина и лептина в сыворотке крови. Это будет способствовать оптимизации принятия решения о назначении патогенетической терапии данному контингенту больных.
Выводы
- Определены особенности взаимоотношений между гормонами регуляторами энергетического обмена (лептин, инсулин) и содержанием тропных гормонов (ФСГ, ЛГ, ПРЛ), зависящие от массы тела, на котором формируется АМК.
- При физиологических росто-весовых показателях пациенток с АМК прослеживаются связи лептина с ФСГ и ПРЛ, а инсулина – с ФСГ и ЛГ. При дефиците массы тела связи лептина с ФСГ и ПРЛ сохраняются, а инсулин детерминирует только ЛГ. У больных с избыточной массой тела лептин сохраняет связь только с ФСГ, а инсулин оказывает влияние на ФСГ, ЛГ, ПРЛ.
- Построена модель, которая доказывает влияние энергетических гормонов (лептин, инсулин) на продукцию тропных гормонов при АМК пубертатного периода.



