Функциональная гипоталамическая аменорея (ФГА) является распространенной и потенциально обратимой формой нарушений менструального цикла, возникающей за счет подавления гипоталамо-гипофизарно-яичниковой (ГГЯ) оси [1]. Гипоталамическая дизрегуляция репродуктивной системы сопровождается снижением секреции кисспептина, гонадотропин рилизинг гормона (ГнРГ) и уменьшением пульсационной секреции гонадотропинов [2]. Это приводит к нарушению роста фолликулов, снижению секреции эстрогенов, и в конечном итоге, проявляется отсутствием циклических изменений в эндометрии с формированием аменореи. Еще в 1946 г. Reifenstein EC определил ФГА как синдром, в основе которого лежит «явное или скрытое психологическое нарушение», оказывающее негативное влияние на циклическую функцию репродуктивной системы [3]. Это послужило поводом для формирования гипотезы о роли метаболического и психического стресса в развитии ФГА [4, 5] Было показано, что при нервной анорексии ограничение приема пищи, отрицательный энергетический баланс и уменьшение объема жировой ткани сопровождаются снижением уровня лептина, повышением уровня грелина, подавлением ГГЯ оси с формированием ФГА. [6–8]. Психический стресс также может нарушать функционирование ГнРГ-нейронов посредством чрезмерной активации гипоталамо-гипофизарно-надпочечниковой системы [6, 9, 10]. В 1972г. Russel G предложил классификацию стрессовых триггеров при психогенной аменорее: чрезвычайная опасность (война, голод), утрата (смерть родственника), тяжелые психические расстройства и даже такие переживания, как начало учебы, страх беременности т.д. [11]. Более поздние исследования подтвердили предположение о том, что ФГА часто ассоциируется с событиями, которые субъективно воспринимаются как стрессовые [12]. По данным Berga S. и соавт., женщины с ФГА имеют чрезмерный перфекционизм, озабоченность мнением других людей, низкую самооценку, эмоциональную лабильность и избыточную тревожность. Кроме того, у этих пациенток нередко отмечаются субсиндромальные проявления расстройств приема пищи [13–15]. Несмотря на то, что психический стресс является общепризнанным фактором развития ФГА, имеющиеся литературные данные о психических особенностях женщин, способствующих психосоциальной дезадаптации недостаточно изучены. В связи с этим зачастую пациентки с ФГА не получают необходимую психопрофилактическую помощь и адекватную коррекцию имеющихся нарушений.
Исходя из вышеизложенного, целью исследования явилась оценка психического состояния и психопатологических особенностей пациенток с ФГА и возможной взаимосвязи с эндокринно-метаболическим профилем.
Материал и методы
В данной статье представлены результаты обследования 104 пациенток с ФГА. Диагноз устанавливался на основании клинических данных (отсутствие самостоятельных менструаций более 6 месяцев), результатов гормонального обследования и отсутствия органических нарушений гипоталамо-гипофизарной области по данным магнитно-резонансной томографии.
В исследование были включены женщины в возрасте от 18 до 35 лет (средний возраст – 25,75±4,16 лет). Индекс массы тела (ИМТ) рассчитывался по формуле ИМТ = вес (кг)/рост (м2), варьировал от 16 до 34 кг/м2 и в среднем составил 20,05±1,9 кг/м2.
Для диагностики ФГА и дифференциации с другими эндокринопатиями проводили исследование гормонального (ЛГ, ФСГ, эстрадиол, АМГ, общий тестостерон, глобулин, связывающий половые стероиды, пролактин, ТТГ, свободный Т4, кортизол, лептин) и нейромедиаторного профиля (серотонин, адреналин, норадреналин, дофамин) иммунохемилюминесцентным методом на автоматическом анализаторе Immulite 2000 (Siemens, USА).
«Композиционный состав тела» оценивали с помощью двухфотонной рентгеновской абсорбциометрии по программе «Total Body Tissue Quantification» на денситометре «Prodigy» фирмы «Lunar» (США). Содержание жировой ткани менее 30% расценивали как дефицит.
Все пациентки дали добровольное информированное согласие на проведение клинико-лабораторного и психологического обследования, в рамках которого проводилось собеседование с психиатром в виде полуструктурированного клинического интервью MINI6 («Международное нейропсихиатрическое интервью»), а также сбор ряда дополнительных данных, касающихся анамнеза и личностных характеристик.
Для статистического анализа материала использовалась программа SPSS Statistics (IBM Версия 21). Все данные представлены как средние ± стандартное отклонение (SD). Сравнение групп проводилось с использованием критерия Манна-Уитни. Статистически значимыми считали результаты при достижении уровня ошибки р<0,05.
Результаты исследования
Средний возраст дебюта аменореи составил 22,1±5,5 лет, длительность аменореи – 3,2±3,1 лет, при этом у 72% больных длительность превышала 1 год. Оценка данных анамнеза показала, что стресс, как причина ФГА был отмечен у 13% больных, приверженность диете – у 22%, чрезмерные физические нагрузки – у 8%. Более чем в половине случаев (54%) отмечалась комбинация факторов, а 3% больных указали на отсутствие связи вышеуказанных факторов с развитием ФГА.
Дальнейшая оценка психического статуса позволила выявить различные психические расстройства у 97 (93,3%) пациенток с ФГА (таблица 1).
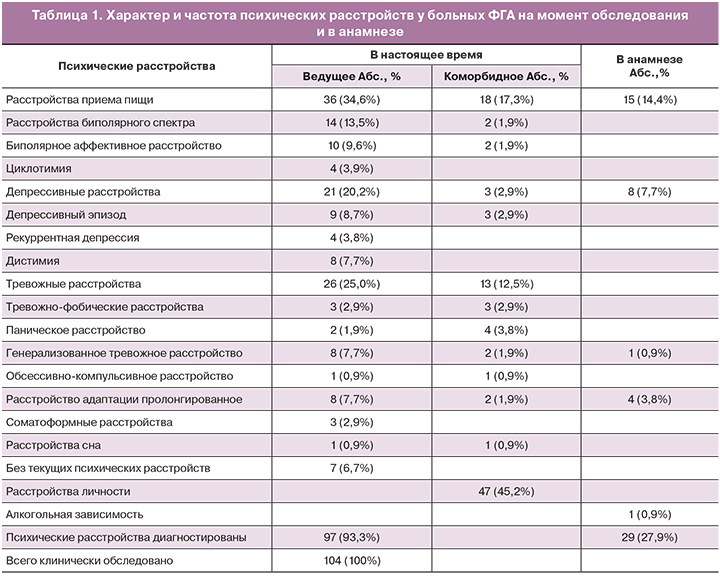
Все больные с ФГА были классифицированы на 4 группы в зависимости от ведущего психического расстройства: 36 (34,6%) больных с расстройством приема пищи (РПП), 14 (13,5%) – с расстройствами биполярного спектра (РБС), 21 (20,2%) – с диагнозом депрессивного эпизода или реккурентной депрессии (депрессия), 26 (25,0%) – с тревожными расстройствами (ТР). Пятую группу составили 7 (6,73%) женщин без текущих психических расстройств (БПР). У 4 из из них ранее отмечались психические расстройства и были признаки диссимулятивного поведения. Среди пациенток с РПП у 38,9% была диагностирована типичная форма нервной анорексии, у 44,4%– атипичная форма нервной анорексии, у 13,9%– типичная форма нервной булимии, у 2,8% – атипичная форма нервной булимии.
Необходимо отметить большое количество аномалий личности, которые выявлялись, по крайней мере, у 47 пациенток. В 63,8% случаев был установлен диагноз эмоционально неустойчивого расстройства личности. Однако, наряду с этим у 10,6% больных выявлялись тревожные, у 8,5% – шизоидные, у 10,6% –зависимые, у 6,4% – ананкастные личностные расстройства. При психопатологическом анализе состояния обследованных пациенток обращали на себя внимание присущие подавляющему большинству из них перфекционизм, гиперсоциальные установки и недостаточная поло-ролевая дифференцированность. В целом же ряде случаев отмечалась отчетливая психологическая маскулинизация.
Клинико-анамнестические данные пациенток с ФГА приведены в таблице 2.
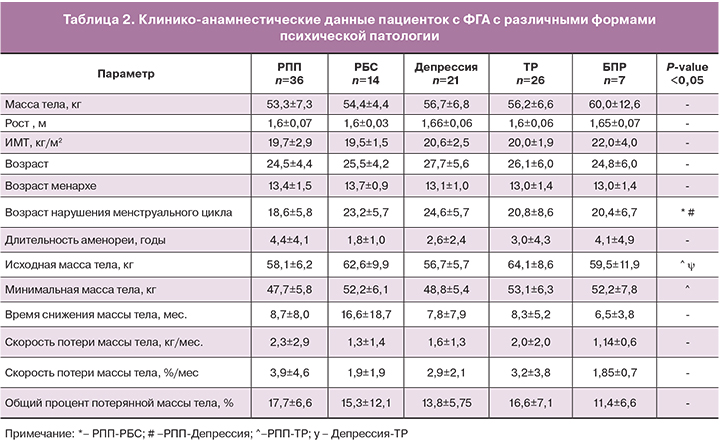
У пациенток с РПП было отмечено более раннее развитие ФГА и тенденция к большей потере массы тела, в сравнении с пациентками из других групп.
Снижение массы тела в анамнезе было отмечено у 75% обследованных больных и было характерно: для 83,3% больных с РПП, 85,7% – с депрессией, 57,1% – с РБС, 69,2% – с ТР, и 57,1% больных без выявленной психической патологии.
Как видно из таблицы 2, на момент включения в исследование не было выявлено различий в средних значениях роста, массы тела и ИМТ. ИМТ менее 18,5 кг/м2 был выявлен у 24% больных, среди которых доля пациенток с РПП составила 44%, с ТР – 24%, c депрессией – 16%, с РБС – 12%, без выявленной психопатологии – 4%.
Анализ гормонального профиля по уровням гонадотропинов, ТТГ, пролактина, эстрадиола не выявил существенных различий между больными с различной психической патологией. Уровень кортизола был выше в группах пациенток с РПП и РБС (р=0,002). Наименьшее значение уровня серотонина было характерно для пациенток с депрессией (р=0,003) (табл. 3).
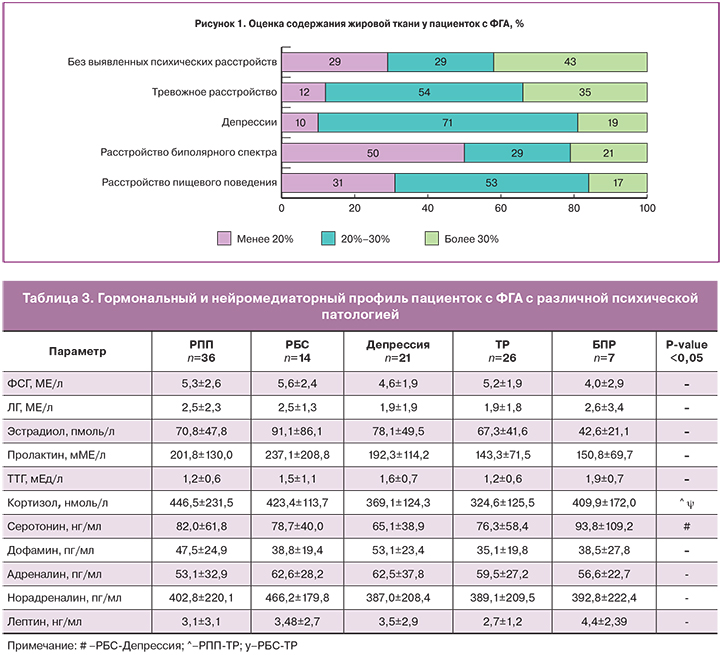
Несмотря на то, что средние уровни лептина достоверно не отличались между группами, гиполептинемия (менее 4,8 нг/мл) была выявлена у 79,8% больных c ФГА. Частота гиполептинемии значимо не различалась между группами (р=0,446), при РПП составила 83,3%, при РБС – 71,4%, при депрессии – 76,2%, при ТР – 88,5%, у пациенток без выявленной психической патологии – 57,1%.
Учитывая высокую частоту потери массы тела и гиполептинемию в анамнезе, была проведена оценка композиционного состава тела. Процентное содержание жировой ткани у пациенток с ФГА варьировало от 10,7 до 36,8% и в среднем составило 24,6±6,7 %. Нормальное содержание жировой ткани (более 30%) наблюдалось у 24% больных, незначительный дефицит (20–30%) – у 51,9% больных, умеренный дефицит (менее 20%) – у 24%, среди которых доля больных с РПП составила 44%, с РБС – 28% (р=0,03). Не было выявлено статистических различий по средним показателям процентного содержания жировой ткани между больными с различной психической патологией (р=0,226). Частота дефицита жировой ткани менее 20% в 5 раз чаще отмечалась при РБС и в 3 раза чаще – при РПП в сравнении с пациентками с депрессией или ТР (рис. 1).
Обсуждение
Анализ данных литературы показал, что основное внимание уделяется изучению нарушений менструального цикла на фоне нервной анорексии, тогда как данные о ФГА на фоне РБС, депрессии или ТР представлены лишь единичными исследованиями. Согласно данным Reynolds-May MF, у пациенток с РБС частота ФГА, связанной со стрессовыми событиями или с чрезмерными физическими нагрузками, составляет 22% и статистически не отличается от частоты ФГА у женщин без РБС [16]. В другом исследовании, проведенном на выборке женщин из Северной Кореи частота ФГА у женщин с депрессией в 2–4 раза выше, чем в популяции [17]. Авторы указывают, что даже при отсутствии ФГА частота олигоменореи среди пациенток с депрессией достигает 34,2%. Однако, ни в одном исследовании не оценивалась характеристика эндокринно-метаболического статуса пациенток с ФГА на фоне психической патологии.
Психиатрическое обследование в рамках проведенного исследования позволило выявить психические расстройства у 93,7% пациенток с ФГА. Согласно полученным результатам, у каждой третьей пациентки наблюдались РПП, у каждой четвертой – ТР, у каждой пятой – депрессивные расстройства. Реже встречались РБС. Эти данные частично согласуются с результатами Giovanni A. Fava, который еще в 1984 года показал, что среди пациенток с ФГА у 28% выявляется депрессивные расстройства, а у 22% – генерализованное ТР [18].
Учитывая гетерогенность выявленной психической патологии, представилось целесообразным оценить ее взаимосвязь с эндокринно-метаболическим статусом больных с ФГА. Как оказалось, уровень кортизола был достоверно выше в группах женщин с РПП и РБС. Уровень серотонина был достоверно ниже в группе пациенток с депрессией, что подтверждается многочисленными исследованиями и обуславливает высокую эффективность ингибиторов моноаминоксидазы у больных с ФГА и депрессией [19]. Не было выявлено достоверных отличий по уровням гонадотропинов и эстрадиола. Это свидетельствует о том, что степень супрессии гипоталамо-гипофизарной системы не зависит от типа психического расстройства и, вероятно, обусловлена иными механизмами. Учитывая это, представляется целесообразным рассмотреть ФГА с позиции теории метаболической адаптации организма в ответ на возникающий энергодефицит.
Результаты проведенного исследования показали, что снижение массы тела наблюдалось в анамнезе у 75% пациенток, при этом скорость потери массы тела, общий процент потерянной массы тела были максимальными у пациенток с РПП. Однако, потеря массы тела наблюдалась не только у больных с РПП, но и при других вариантах психопатологии. Можно предположить, что механизмы потери веса и формирование ФГА у данных категорий больных различаются. Так, например, известно, что при РПП, в частности при нервной анорексии, потеря массы тела связана с преднамеренным ограничением потребления пищи и чрезмерными физическими нагрузками, тогда как в отношении механизмов снижения массы тела при депрессии и ТР нет единого мнения. Учитывая, что потеря аппетита характерна для ТР, а анергия (снижение или утрата способности к активной деятельности) и агедония (снижение или утрата способности получать удовольствие) являются типичными симптомами депрессии, можно предположить, что именно они лежат в основе неадекватного пищевого статуса у пациенток с ФГА и тревожно-депрессивными расстройствами [20].
Считается, что регуляция ГГЯ системы во многом зависит от содержания жировой ткани. В проведенном исследовании дефицит жировой ткани (менее 30%) был характерен для 76% больных, а среднее содержание жировой ткани не отличалось между группами. Однако, при рассмотрении степени дефицита жировой ткани, было выявлено, что снижение жировой ткани (менее 20%) наблюдалось у 24% больных и было характерно преимущественно для пациенток с РПП и РБС. Частота выраженного снижения жировой ткани у пациенток с РБС, по всей видимости, может быть обусловлена высокой долей коморбидной нервной анорексии. Обращает на себя внимание, что у 24% больных ФГА сохранялась, несмотря на отсутствие дефицита жировой ткани.
Известно, что функционирование репродуктивной системы зависит от адекватной секреции кисспептина в аркуатных ядрах гипоталамуса, уровень экспрессии которого зависит от энергетического баланса. Связующим звеном между кисспептинергической системой и энергетическим балансом выступает гормон лептин, достаточный уровень которого определяется содержанием жировой ткани [21]. Однако, согласно теории метаболической адаптации даже при нормальном ИМТ и содержании жировой ткани у пациенток с ФГА может наблюдаться отрицательный энергетический баланс, сопровождающийся снижением уровня лептина, что было подтверждено рядом зарубежных работ [22]. Так в исследовании Karen K. Miller и M.P. Warren отмечено, что при отсутствии различий в ИМТ и содержании жировой ткани у пациенток с ФГА, в сравнении с группой контроля, уровень лептина был достоверно ниже [23, 24]. Как выяснилось, снижение уровня лептина было связано с неадекватным питанием. Это подтверждается результатами ранее проведенного нами исследования, в котором 91,7% пациенток с ФГА характеризовались дефицитом потребления углеводов, и в 50% случаев отмечалось снижение общей калорийности рациона [25].
Гиполептинемия, как известно, характерна для пациенток с нервной анорексией и ассоциирована с низким ИМТ и снижением содержания жировой ткани, однако данные о гиполептинемии у пациенток с РБС, депрессией и генерализованными ТР противоречивы и представлены единичными исследованиями. В экспериментальных работах подтверждается роль стрессовых гормонов (кортизола и катехоламинов) в регуляции уровня лептина [26]. Было показано, что кратковременный стресс приводит к повышению уровня лептина в крови, в то время, как состояние хронического стресса, наоборот – к стойкой гиполептинемии. В исследовании Deuschle M. и др. была показана высокая частота гиполептинемии у пациенток с затяжной депрессией. Однако, по мнению авторов, гиполептинемия у больных с депрессией была обусловлена не столько патофизиологическими нейроэндокринными механизмами развития депрессивного расстройства, сколько ограничительным типом питания на фоне потери аппетита и анергии [27].
Заключение
Таким образом, результаты комплексного обследования больных позволяют сделать вывод, что для 93,7% больных с ФГА, при отсутствии существенных различий в эндокринно-метаболическом статусе, характерны психические нарушения в виде РПП, РБС, депрессии, ТР. Их манифестация, вероятно, реализуется на фоне неадекватных стратегий преодоления психологических проблем, дезадаптивных личностных особенностей и хронического стресса. Вышеуказанные расстройства у большей части больных могут сопровождаться ограничительным типом питания, чрезмерными физическими нагрузками, снижением аппетита, апатией, анергией и агедонией с последующим развитием энергетического дефицита, признаками которого в клинической практике являются снижение содержания жировой ткани и гиполептинемия. Это приводит к угнетению кисспептинергической системы, подавлению синтеза ГнРГ, гонадотропинов и развитию аменореи (рис. 2).

Полученные данные позволяют сделать заключение, что проблема ФГА является мультидисциплинарной. Пациенткам необходимо проведение комплексного обследования, включающего консультацию не только гинеколога, но и психиатра с целью выявления и последующей коррекции скрытых психиатрических проблем, что позволит повысить эффективность лечения.



