Актуальность проблемы урогенитальных нарушений и недержания мочи у женщин закономерно
увеличивается в связи с ростом продолжительности жизни. Такая тенденция характерна не только
для России, но и для развитых стран Евросоюза и Америки. G. Samsioe показал, что к 2030 г.
возможно четырехкратное увеличение популяции 80-летних женщин [1]. Согласно литературным
данным, недержание мочи отмечают примерно 24% женщин в возрасте от 30 до 60 лет и более 50%
женщин в возрасте после 60 лет [2]. Но за помощью к врачу обращается лишь незначительная
часть женщин, страдающих этим заболеванием [3]. Зачастую это связано не только с интимностью данной проблемы и нежеланием обсуждать ее в семье или в кабинете врача, но и с некомпетентностью гинекологов и урологов в данном вопросе, а также с общеизвестным ложным суждением о том, что недержание мочи является «естественным» процессом старения. В последнее время проблеме нарушений мочеиспускания уделяется пристальное внимание, это связано с выраженным отрицательным влиянием данной патологии на качество жизни женщин: снижение социальной активности, депрессии, неврозы, сексуальные расстройства [4–6].
Международным комитетом по недержанию мочи данное заболевание определяется как «непроизвольное выделение мочи, являющееся социальной или гигиенической проблемой, при
наличии объективных проявлений неконтролируемого мочеиспускания». На сегодняшний день
выделяют три основные формы недержания мочи: стрессовое, ургентное и смешанное (комбинированная форма) [7].
Наиболее распространенной и сложной в плане лечения является императивная (ургентная) форма
недержания мочи, которая закономерно является частью синдрома, называемого гиперактивный
мочевой пузырь (ГМП). В основе патогенеза ГМП лежат нарушения нервно-мышечной передачи в
мочевом пузыре, приводящие к гиперактивности детрузора (мышцы мочевого пузыря). В уротелии
и детрузоре содержится большое количество холинорецепторов (в основном подтипы М2 и М3).
М2-рецепторы подавляют симпатическую стимуляцию и способствуют релаксации детрузора,
М3-рецепторы стимулируют его сократительную деятельность. Α1-адренорецепторы (в основном
подтипы А1А и А1D) преимущественно находятся в проксимальной части уретры, шейке и основании мочевого пузыря.Блокада этих рецепторов способствует расслаблению шейки мочевого пузыря и увеличению его накопительной функции [8, 9]. В работах последних лет [10] большое внимание уделяется β3-адренорецепторам, которые обнаружены в дне и теле мочевого пузыря. Показано, что стимуляция данных рецепторов способствует торможению активности детрузора и его функциональной адаптации к поступающему объему мочи. Сложные процессы накопления мочи и мочеиспускания регулируются центром мочеиспускания, расположенным в поясничном отделе спинного мозга, а также центральными структурами, в частности стволовой частью мозга, правым дорсолатеральным прифронтальным участком коры и передней опоясывающей извилиной [11, 12]. Различные патологические изменения (травмы, воспаление, ишемия и др.), возникающие как в мочевом пузыре, так в периферической и центральной нервной системе, могут приводить к развитию симптомов ГМП, которые включают [13, 14]:
1. Императивные (ургентные) позывы на мочеиспускание (ощущение неотвратимости мочеиспускания);
2. Паллакиурию (частые позывы на мочеиспускание, более 8 раз в сутки);
3. Ноктурию (частые мочеиспускания в ночное время, более одного эпизода мочеиспускания в
ночное время);
4. Императивное недержание мочи (неудержание мочи при ургентном позыве).
Говоря о причинах ГМП или синдроме императивных нарушений мочеиспускания, надо отметить,
что данное заболевание является многофакторным.
Одной из наиболее частых причин развития данной патологии у женщин являются воспалительные заболевания мочевых путей. По данным разных авторов, от 50 до 70% пациенток, страдающих императивными формами расстройств мочеиспускания, отмечают в анамнезе хронические циститы или уретриты [9, 15].
Причиной развития ГМП может стать различная неврологическая патология: ишемия головного
мозга, инсульт, рассеянный склероз, паркинсонизм, травмы, опухоли, кисты головного и спинного мозга [9, 11]. Нередко ГМП возникает у женщин, перенесших различные гинекологические операции: экстирпация матки, гистерэктомия, а также эндоуретральные операции. Развитие нарушений мочеиспускания и недержания мочи у женщин после радикальных операций на матке связаны с парасимпатической и соматической денервацией мочевого пузыря, уретры и мышц тазового дна, нарушением анатомических взаимоотношений органов малого таза; если приоперации удаляются яичники, то дополнительно развивается эстрогенный дефицит [16].
Факторами риска развития ГМП являются травматичные роды, сахарный диабет, малоподвижный образ жизни [9, 11].
Одной из значимых и частых причин развития ГМП является эстрогенная недостаточность.
Большинство женщин старше 45 лет указывают на то, что начало заболевания совпадает с наступлением менопаузы [12, 17, 18]. Причем распространенность этого симптомокомплекса зависит от длительности постменопаузы и увеличивается с 15,5% при постменопаузе до 5 лет до 71,4% при длительности постменопаузы более 20 лет [19]. Мочевой и генитальный тракты имеют общее эмбриональное происхождение, что объясняет наличие α- и β-эстрогеновых рецепторов во всех структурах урогенитального тракта: нижней трети мочеточников, мочевом пузыре, сосудистых сплетениях, уротелии, мышцах тазового дна, связочном аппарате малого таза. При развитии эстрогенного дефицита в урогенитальном тракте возникают атрофические процессы, снижается эластичность коллагена, входящего в состав соединительной ткани уретры, уменьшается васкуляризация стенки мочеиспускательного канала. Ишемия мочевого пузыря приводит к избыточному апоптозу гладкомышечных клеток детрузора, дегенеративным процессам в нейронах, что нарушает проводимость и нейропластичность мочевых путей [19, 20]. С другой стороны, прекращение пролиферации уротелия повышает синтез нейроактивных субстанций в субуротелиальном пространстве: фактора роста нервов (NGF), цитокинов, нейрокининов А, простагландинов Е2, что приводит к нарушению синаптической передачи и повышению сократительной активности мышечных волокон детрузора и уретры [20, 21].
Лечение ГМП, как правило, консервативное, подразумевает немедикаментозные и медикаментозные
методы, которые применяются в качестве монотерапии и в комбинации друг с другом (см. таблицу).
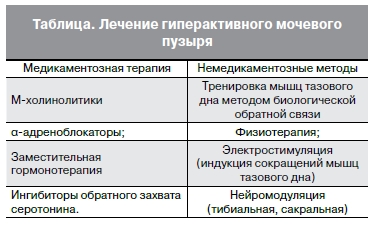
Медикаментозная терапия является основополагающей в лечении императивных нарушений
мочеиспускания [13, 22]. От правильности выбора препарата зависит эффективность лечения,
которая выражается не только в клиническом улучшении на фоне терапии, но и в длительности
последующей ремиссии [23].Препаратами первой линии для лечения ГМП являются м-холиноблокаторы. Блокада м-холинорецепторов сопровождается стереотипной реакцией детрузора,которая
выражается в его расслаблении в фазу наполнения, увеличении резервуарной функции мочевого пузыря [23]. Вследствие этого достигаются существенные позитивные изменения функционального состояния нижнего отдела мочевого тракта, что выражается в исчезновении поллакиурии и нормализации суточного профиля мочеиспускания(рис. 1 cм. на вклейке).
Учитывая, что дефицит эстрогена является одним из основополагающих этиологических факторов в развитии императивных нарушений мочеиспускания у женщин в пери- и постменопаузе, целесообразно применение локальных форм заместительной гормонотерапии – эстриола [19, 24, 25]. При локальном использовании эстрогенов в низких дозах системные побочные эффекты не развиваются[20]. Эстрогены улучшают кровообращение, трофику мочевых путей, пролиферацию клеток уротелия, а также, по данным ряда авторов [19, 20, 25], увеличивают содержание α-адренорецепторов в уретре и мочевом пузыре и снижают чувствительность холинорецепторов. Однако данные об эффективности гормонотерапии, дозах и длительности ее применения при лечении ГМП у женщин в климактерии весьма противоречивы.
Цель исследования: оценить эффективность комбинированной терапии (толтеродин + эстриол) по сравнению с монотерапией холинолитиками (толтеродин) у женщин с ГМП в пери- и постменопаузе.
Материал и методы исследования
За период с апреля 2010 г. по июнь 2011 г. в отделении гинекологической эндокринологии ФГУ
Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава
России в рандомизированное продольное исследование включены 60 пациенток с ГМП в пери- и постменопаузе. Возраст пациенток колебался от 45 до 70 лет (средний возраст – 57,5±12,5 года). Все женщины были разделены на 2 группы по 30 человек: 1-я группа получала терапию препаратом толтеродин в дозе 2 мг 2 раза в день; 2-я группа – комбинированную терапию толтеродином 2 мг 2 раза в день и эстриолом в виде крема интравагинально по ½ дозы (0,5 мг эстриола) 2 раза в неделю. Курс лечения составил 3 месяца, пациентки 2-й группы продолжали принимать эстриол в указанной дозировке в течение года. Диагноз ГМП у всех пациенток был подтвержден комплексным уродинамическим исследованием.
Перед началом терапии всем пациенткам проводилось анкетирование, заполнение дневников
мочеиспусканий, а также оценивалась степень атрофии урогенитального тракта с помощью
индекса вагинального здоровья (ИВЗ). По результатам анкетирования и дневников мочеиспусканий, до начала терапии суточный ритм мочеиспусканий у пациенток 1-й группы составил от 9 до 21 раза (в среднем 15 раз); у пациенток 2-й группы – от 10 до 17 раз (в среднем 13,5 раза). 21 пациентка 1-й группы и 18 2-й отмечали эпизоды неудержания мочи при ургентном позыве. По результатам уродинамического исследования у женщин обеих групп определялось снижение функционального и максимального цистометрического объемов, у 57,4% женщин отмечались признаки нестабильности детрузора, у 30% определялись подпороговые колебания детрузорного давления, у 12,6% – нестабильность уретры.
Результаты исследования и обсуждение
Период наблюдения за пациентками составил 1 год. Контрольные обследования, включающие
заполнение дневников мочеиспусканий, анкетирование, определение функциональных проб,
комплексное уродинамическое исследование, оценка ИВЗ проводились через 3, 6 и 12 мес
от начала терапии. При анализе эффективности медикаментозного лечения в течение 3 месяцев
мы учитывали субъективную оценку симптомов пациенток. Всем женщинам после окончания
терапии было предложено оценить свое состояние в баллах: 0 – отсутствие эффекта или ухудшение
состояния; 1 – минимальные изменения без чувства удовлетворения; 2 – значительное улучшение
состояние, при этом остаются редкие эпизоды недержания мочи, возникающие при сильном
позыве; 3 – полное исчезновение поллакиурии и непроизвольных потерь мочи. Результат, оцененный больными от 0 до 1, нами рассматривался как отрицательный, от 2 до 3 – как положительный.
Анкетирование показало, что 69,6% пациенток 1-й группы оценили результат лечения как положительный (2 или 3 балла). Во 2-й группе процент положительных результатов был несколько
выше – 87,2%. Суточный ритм мочеиспусканий по дневникам у пациенток 1-й группы после лечения составил от 6 до 15 раз (в среднем 10,5 раза); у пациенток 2-й группы – от 5 до 9 раз (в среднем
7 раз). По данным комплексных уродинамических исследований через 3 мес терапии у 69% пациенток 1-й группы и 82% 2-й отмечалось увеличение функционального и максимального объемов мочевого пузыря; нестабильности детрузора и уретры не было выявлено ни у одной пациентки; у 36,4% женщин 1-й группы и у 24,4% 2-й отмечались подпороговые колебания (от 1 до 8 см водн. ст.) детрузорного давления. Важным моментом при оценке эффективности терапии является длительность ремиссии после отмены м-холиноблокаторов. Через 6 мес от начала терапии в 1-й группе возобновление симптомов заболевания (частые позывы на мочеиспускание, неудержание мочи при позыве) отмечали 11 пациенток (36,6%), через 12 мес наблюдения –19 (63,3%). Во 2-й группе рецидив ГМП через 6 мес отмечался у 5 пациенток (16,6%), через 12 мес наблюдения – у 10 (33,3%).
Заключение
Несмотря на то что м-холинолитики обоснованно являются первой линией терапии императивных нарушений мочеиспускания (степень доказательности А), проведенное исследование показало, что назначение локальных форм заместительной гормонотерапии женщинам с ГМП в пери- и постменопаузе значительно повышает эффективность лечения (1-я группа – 75,6%; 2-я группа – 87,2%, при N=60), а также увеличивает период последующей ремиссии (средний период ремиссии в 1-й группе составил 5 мес, во 2-й – 9 мес, р<0,001). Одним из положительных моментов данного вида терапии является его патогенетическая направленность. Заместительная гормонотерапия улучшает кровообращение в мочевом пузыре и уретре, повышает пролиферацию гладкомышечных клеток мочевого пузыря и уротелия, уменьшает секрецию активных субстанций клетками уротелия (NGF, цитокинов, простагландинов Е2 и др.), снижает чувствительность холинорецепторов [3, 11, 15]. Начальная доза локальных эстрогенов подбирается индивидуально в зависимости от степени выраженности урогенитальной атрофии. Однако поддерживающие дозы заместительной гормонотерапии (1/2 дозы – 0,5 мг эстриола 2 раза в неделю) следует назначать на длительный промежуток времени для достижения стойкого терапевтического эффекта.



