Проведение преимплантационного генетического тестирования на анеуплоидии (ПГТ-А) в циклах ЭКО существенно увеличивает частоту имплантации, позволяет сократить время до наступления беременности (на 6 месяцев – 1 год) и более чем в три раза снизить риск потери беременности в I триместре [1, 2].
Современная версия ПГТ-А – тестирование по всем хромосомам – вошло в практику центров вспомогательных репродуктивных технологий (ВРТ) в 2012 г. с внедрением метода сравнительной геномной гибридизации (aCGH, Comparative Genomic Hybridisation on microarrays), а затем массивного параллельного секвенирования (чаще называемого секвенированием следующего поколения, NGS, Next Generation Sequencing). Данные методы имеют сопоставимую разрешающую способность и способны выявлять большинство типов известных хромосомных аномалий [3]. Считается, что преимуществом NGS является лучшая выявляемость мозаичных вариантов, в то время как некоторые платформы для aCGH имеют лучшую разрешающую способность при выявлении сегментных анеуплоидий [4, 5].
Уже после начала применения ранних версий преимплантационной диагностики (с использованием метода FISH на полярных тельцах и бластомерах эмбрионов 3 дня развития) было установлено, что существует выраженная зависимость частоты хромосомной патологии эмбрионов от возраста матери [6]. Доля анеуплоидных эмбрионов начинает увеличиваться уже после 30 лет, а вероятность получения эуплоидного эмбриона из собственных яйцеклеток у пациенток 43 лет и старше не превышает 10% [7, 8]. Согласно рекомендациям PGDIS, возраст женщины старше 35 лет является ведущей причиной назначения ПГТ-А.
Настоящая работа посвящена анализу спектра хромосомной патологии, выявляемой в трофэктодерме эмбрионов 5 дня развития с использованием методов aCGH и NGS в отделении ВРТ НИИ АГиР им. Д.О. Отта и в Международном центре репродуктивной медицины (МЦРМ, Санкт-Петербург), сравнению этих методов и оценке возможного влияния разных эмбриологических протоколов на частоту хромосомных аномалий у эмбрионов.
Материалы и методы
Материалом исследования являлись образцы биоптатов трофэктодермы эмбрионов 5 дня развития, полученные в ходе циклов ЭКО, проводимых в отделении ВРТ НИИ АГиР им. Д.О. Отта и в клинике МЦРМ. Всего в исследование был включен 1041 эмбрион, полученный от 420 пациенток, более подробная информация о распределении пациенток по возрасту приведена в таблице. Донорами ооцитов были женщины 22–28 лет. Критерием исключения являлось выявленное носительство структурных перестроек и маркерных хромосом у одного из родителей. Исследование одобрено Этическим комитетом НИИ АГиР им. Д.О. Отта. Все пациентки подписали информированное согласие на проведение исследования и обработку персональных данных, включая данные историй болезни.
Культивирование и биопсия эмбрионов, МЦРМ. Эмбрионы оплодотворяли методом ЭКО или ИКСИ в зависимости от качества эякулята и культивировали согласно описанному ранее протоколу [9]. Через 16–18 ч после оплодотворения проводилась визуальная качественная оценка пронуклеусов и полярных телец, после чего эмбрионы культивировали на средах COOK 5–6 дней до формирования бластоист. Морфологическая оценка бластоцист проводилась на основании классификации Гарднера [10, 11]. Для бластоцист отличного и хорошего качества была выполнена биопсия клеток трофэктодермы с использованием лазера и последующая криоконсервация методом витрификации в средах Kitazato согласно протоколу производителя (Kitazato Supply Co., Fujinomiya, Japan).
Культивирование и биопсия эмбрионов, НИИ АГиР им. Д.О. Отта. Процедуру контролируемой овариальной стимуляции выполняли по общепринятым методикам. Ооцит-кумулюсные комплексы получали путем трансвагинальной пункции фолликулов через 35–36 ч после введения триггера. Оплодотворение проводили методом ЭКО или ИКСИ в зависимости от качества эякулята. Через 17–18 ч проводили оценку эффективности оплодотворения и культивировали диплоидные зиготы 5–6 дней до стадии бластоцисты. Культивирование осуществляли при 37 °C в СО2-инкубаторе с использованием коммерческих культуральных сред (COOK, США и Vitrolife, Швеция). Биопсию трофэктодермы производили с использованием лазера у эмбрионов качеством не ниже 3ВВ [10, 11]. В буфер помещали фрагмент трофэктодермы, содержащий 4–8 клеток.
Для проведения полногеномной амплификации использовали WGA-PCR PicoPlex SingleCell WGA Kit (Rubicon Genomics) или SmarTer PicoPLEX WGA kit (Takara Boi, США), согласно инструкции производителя. Количество продукта WGA оценивали на флюориметре Qubit 4 (Invitrogen, Life technologies, США) с помощью набора Qubit ds DNA BR Assay Kits (Invitrogen, Life technologies, США), согласно рекомендациям производителя и/или с помощью электрофореза в 1,5% агарозном геле. Полногеномную амплификацию выполняли в НИИ АГиР им. Д.О. Отта и в МЦРМ.
ПГТ-А проводили на двух платформах. Для aCGH использовали олигонуклеотидные чипы G5963A 8×60K производства Agilent (США), мечение ДНК проводили с использованием SureTag Complete DNA Labeling kit (Agilent (США)), гибридизацию, отмывку и сканирование проводили в соответствии с рекомендациями производителя. Для анализа результатов использовали программу Agilent CytoGenomics. Разрешающая способность платформы, согласно указаниям производителя, составляет от 5 млн пар нуклеотидов для сегментных анеуплоидий и от 30% для детекции хромосомного мозаицизма.
Приготовление библиотек для секвенирования производили с помощью набора VeriSeq PGS kit (Illumina, США) с последующей оценкой качества на приборе TapeStation 4200 (Agilent, США). Секвенирование осуществляли на аппарате Illumina MiSeq (Illumina, США). Анализ на численные хромосомные аномалии выполняли с использованием программного обеспечения BluFuse Multi v4.3 (Illumina, США). Эффективное разрешение метода составляло 20 млн пар нуклеотидов. Исследование методом aCGH проводили в НИИ АГиР им. Д.О. Отта, методом NGS – в СПб ГБУЗ «Городская больница №40» и в ООО «Сербалаб».
Статистический анализ. Статистическую обработку полученных результатов проводили с использованием пакета GraphPadPrizm v.6.0. Для сравнения частоты хромосомных аномалий между группами проводили анализ таблиц сопряженности 2×2 с применением точного критерия Фишера. Различия между группами считали статистически значимыми при р<0,05.
Результаты и обсуждение
На первом этапе данной работы был проанализирован спектр хромосомной патологии, выявляемой у эмбрионов 5 дня развития методом aCGH.
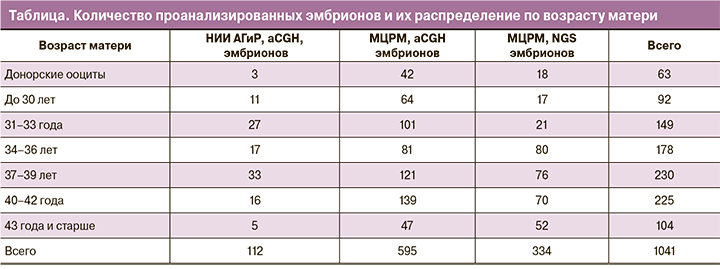
В целом хромосомные аномалии были выявлены у 390 из 707 (55,2%) эмбрионов, доля эмбрионов с эуплоидным набором хромосом составила 44,8%. В остальных проанализированных образцах был выявлен широкий спектр хромосомной патологии – анеуплоидии по одной и нескольким хромосомам (143 и 78 эмбрионов, 20% и 12% всех эмбрионов соответственно), сегментные анеуплоидии (36 эмбрионов, 5%), численные и структурные аномалии половых хромосом (13 эмбрионов, 2%), мозаичные варианты (по целым хромосомам и сегментные аномалии, всего 44 эмбриона, 6%), вероятно, триплоидные и хаотические эмбрионы (16 эмбрионов, 2%) и образцы, в которых было зарегистрировано сочетание нескольких типов хромосомных аномалий (например, полная и сегментная анеуплоидия, анеуплоидия и мозаицизм и т.п., всего 48 эмбрионов, 7%).
Мы выявили резкий рост числа анеуплоидных эмбрионов с увеличением материнского возраста (рис. 1а). Частота простых анеуплоидий (три- и моносомии по одной хромосоме) начинает возрастать уже после 30 лет, достигает максимума в группе 40–42 лет, после чего начинает снижаться. Комплексные анеуплоидии (три- и моносомии по двум и более хромосомам) практически не встречаются у пациенток вплоть до 34–36 лет включительно (9 эмбрионов из 346, 2,6%), однако начиная с 37–38 лет их количество начинает прогрессивно возрастать, достигая максимума у пациенток 43 лет и старше. Доля прочих видов хромосомной патологии с увеличением материнского возраста не изменяется.
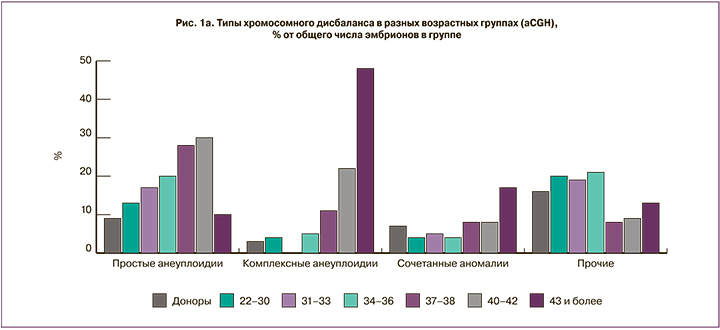
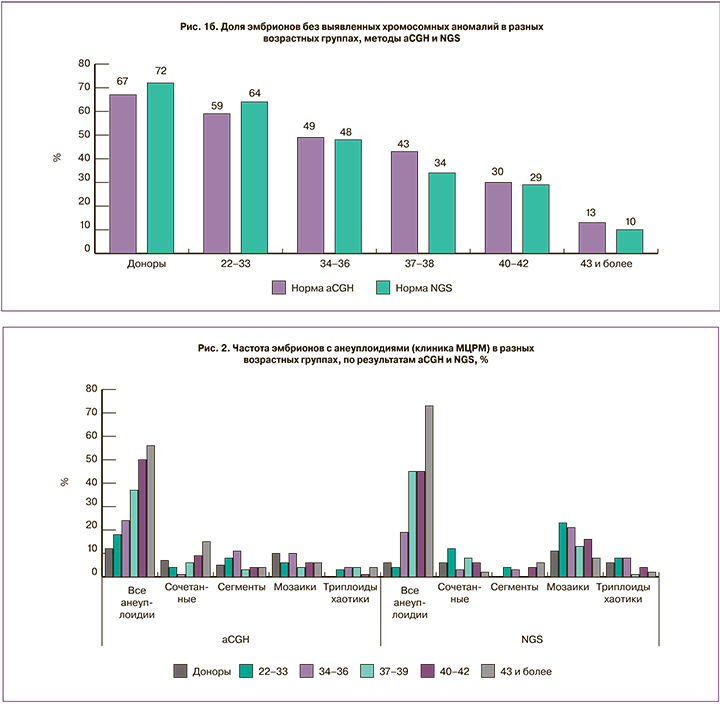
На следующем этапе работы было проведено сравнение частоты и спектра хромосомной патологии, выявляемой разными методами. Методом NGS было проанализировано 334 образца из клиники МЦРМ, выявлено 206 эмбрионов с хромосомными аномалиями (62%). Результаты сравнивали с данными, полученными методом aCGH для 595 эмбрионов из этого же центра. Поскольку частота хромосомной патологии увеличивается с повышением материнского возраста, мы проанализировали частоту эмбрионов с выявленными хромосомными нарушениями отдельно в каждой возрастной группе. Значимых отличий по частоте выявления хромосомных аномалий при использовании разных платформ ПГТ-А (рис. 1б) не было выявлено (минимальное значение p=0,2348 в группе 37–39 лет, в остальных возрастных группах p>0,7). Результаты по разным типам хромосомных аномалий представлены на рис. 2. Независимо от использованного метода проведения исследования, с увеличением возраста женщины наблюдается рост числа эмбрионов с анеуплоидиями (представлены совместные данные по простым и комплексным анеуплоидиям). Анеуплоидии, сочетанные аномалии, сегментные анеуплоидии, вероятно, триплоидные и хаотические эмбрионы с одинаковой частотой выявляются как методом aCGH, так и методом NGS. Однако в группе NGS чаще (p<0,001) выявлялись мозаичные аномалии (в выборке из 334 эмбрионов разные варианты мозаицизма были выявлены у 52; мозаичные эмбрионы составили 15,6% общей выборки против 4,2% в группе aCGH). При этом следует отметить, что у 29 из 52 выявленных методом NGS мозаичных эмбрионов (8,6% всех проанализированных этим методом) доля аномального клона не превышала 30%. Такой уровень мозаицизма не может быть выявлен методом aCGH или выявляется на пределе разрешающей способности метода. Однако, согласно рекомендациям PGDIS 2019 г. [12], перенос эмбрионов с низким уровнем мозаицизма (до 40%) может быть рекомендован, и такие эмбрионы часто имеют хороший потенциал для имплантации, развития беременности и рождения здорового ребенка [13, 14]. Частота мозаицизма, по нашим данным, не зависит от материнского возраста.
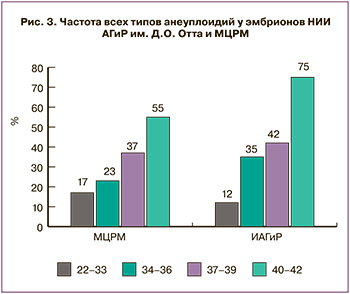 На последнем этапе данной работы мы сравнили частоты хромосомных аномалий в эмбрионах, полученных в разных центрах ВРТ. В литературе активно обсуждается вопрос о причинах высокой частоты образования эмбрионов с хромосомными аномалиями у человека, и, по ряду мнений, важную роль в нерасхождении хромосом могут играть протоколы ВРТ, условия культивирования эмбрионов и методика биопсии [15, 16, 17]. Мы сравнили результаты ПГТ-А, проведенного методом aCGH, для эмбрионов, полученных в отделении ВРТ НИИ АГиР им. Д.О. Отта (всего 112 эмбрионов) и в Международном центре репродуктивной медицины (МЦРМ, Санкт-Петербург, всего 545 эмбрионов), и получили следующие данные. Сбалансированный хромосомный набор был обнаружен у 47 (42%) эмбрионов НИИ АГиР и у 270 (45%) эмбрионов МЦРМ. Частота анеуплоидий в обеих группах увеличивалась с возрастом матери (рис. 3), статистически значимых отличий по частоте анеуплоидных эмбрионов не было выявлено (наименьший уровень p=0,0669 в группе 40 лет и старше, в остальных группах р≥0,3616). Прочие типы хромосомных аномалий, частота которых не зависит от возраста, с одинаковой частотой встречались у эмбрионов обеих групп. Так, мозаицизм был выявлен у 38 (6,9%) эмбрионов МЦРМ и 6 (5,4%) эмбрионов НИИ АГиР (p=0,8323), сегментные анеуплоидии – у 34 (6,2%) и 11 (9%) (p=0,1359), сочетанные аномалии – у 34 (6,2%) и 8 (7,2%) (p=0,5047) и триплоидные/хаотические варианты – у 15 (2,7%) и 2 (1,8%) (p=0,6412) эмбрионов соответственно.
На последнем этапе данной работы мы сравнили частоты хромосомных аномалий в эмбрионах, полученных в разных центрах ВРТ. В литературе активно обсуждается вопрос о причинах высокой частоты образования эмбрионов с хромосомными аномалиями у человека, и, по ряду мнений, важную роль в нерасхождении хромосом могут играть протоколы ВРТ, условия культивирования эмбрионов и методика биопсии [15, 16, 17]. Мы сравнили результаты ПГТ-А, проведенного методом aCGH, для эмбрионов, полученных в отделении ВРТ НИИ АГиР им. Д.О. Отта (всего 112 эмбрионов) и в Международном центре репродуктивной медицины (МЦРМ, Санкт-Петербург, всего 545 эмбрионов), и получили следующие данные. Сбалансированный хромосомный набор был обнаружен у 47 (42%) эмбрионов НИИ АГиР и у 270 (45%) эмбрионов МЦРМ. Частота анеуплоидий в обеих группах увеличивалась с возрастом матери (рис. 3), статистически значимых отличий по частоте анеуплоидных эмбрионов не было выявлено (наименьший уровень p=0,0669 в группе 40 лет и старше, в остальных группах р≥0,3616). Прочие типы хромосомных аномалий, частота которых не зависит от возраста, с одинаковой частотой встречались у эмбрионов обеих групп. Так, мозаицизм был выявлен у 38 (6,9%) эмбрионов МЦРМ и 6 (5,4%) эмбрионов НИИ АГиР (p=0,8323), сегментные анеуплоидии – у 34 (6,2%) и 11 (9%) (p=0,1359), сочетанные аномалии – у 34 (6,2%) и 8 (7,2%) (p=0,5047) и триплоидные/хаотические варианты – у 15 (2,7%) и 2 (1,8%) (p=0,6412) эмбрионов соответственно.
Выводы
Мы подтвердили, что с повышением материнского возраста происходит рост доли аномальных эмбрионов. У молодых женщин-доноров нормальную хромосомную конституцию имеют до 70% эмбрионов; у пациенток ВРТ 34–36 лет к переносу пригодны 48%, в 40–42 года – 30%, а после 43 лет – не более 10–13% эмбрионов. Снижение генетического качества происходит прежде всего за счет роста числа простых анеуплоидий, который начинается уже после 30 лет и достигает максимума в 40–42 года, а также за счет анеуплоидий по двум и более хромосомам. Данный вид хромосомной патологии практически не обнаруживается в эмбрионах пациенток, не достигших 36 лет, а после достижения женщиной 37-летнего возраста доля эмбрионов с комплексными анеуплоидиями прогрессивно возрастает. У пациенток 43 лет и старше такой тип хромосомных аномалий выявлен у 48% эмбрионов.
Методы aCGH и NGS в нашей выборке показали сходную эффективность для проведения ПГТ-А. Метод NGS выявляет большее количество мозаичных эмбрионов, однако преимущество это достигается прежде всего за счет лучшей детекции низкопроцентного мозаицизма (20–30%); по рекомендациям PGDIS 2019 г. в большинстве случаев перенос таких эмбрионов может быть осуществлен.
Наконец, мы не выявили статистически значимых различий в частоте хромосомных аномалий между двумя центрами ВРТ, что является свидетельством хорошего соответствия стандартам проведения схем стимуляции и условий культивирования эмбрионов.



