В настоящее время неспецифические вагиниты и цервициты составляют значительную часть всех случаев инфекционно-воспалительных заболеваний (ИВЗ) женской репродуктивной системы, среди которых доля цервицитов составляет около 60–70%. Однако истинную частоту распространения данной патологии установить достаточно сложно, так как в большинстве случаев они протекают бессимптомно и диагностируются лишь при плановых гинекологических осмотрах [1, 2]. Неспецифический вагинит регистрируют у 19,2% пациенток, обратившихся в гинекологические клиники [3]. Согласно исследованиям, выполненным зарубежными учеными, частота вагинитов в акушерско-гинекологической практике составляет более 10% [4]. В ¾ случаях всех вагинитов и цервицитов причина остается не выявленной [5, 6].
Среди возбудителей неспецифического вагинита чаще всего выделяют аэробные УПМ (E. coli, Staphylococcus aureus, Streptococcus группы B, Enterococci и др.), которые идентифицируют у 30% женщин. При вагините смешанной этиологии к аэробным УПМ присоединяются некоторые анаэробы (Atopobium vaginae, G. vaginalis, Mobiluncus, Fusobacterium и др.) и внутриклеточные микроорганизмы (M. hominis, U. urealyticum), которые в норме присутствуют во влагалище и в ряде случаев могут стать причиной воспалительных заболеваний [6–9]. Практически всегда при вагинальной инфекции в воспалительный процесс вовлекается шейка матки, что сопровождается экзоцервицитом и эндоцервицитом. В ряде исследований установлено, что чаще возбудителями неспецифического вагинита и цервицита являются ассоциации этиологических агентов, которые обусловливают тяжесть заболевания и сложность терапии [10]. Так, при диагностике данной патологии наблюдается следующая тенденция: у 37,4% женщин выявляют менее шести УПМ; у 27,3% – 6–10 возбудителей; а в 10,1% случаев – более 11 УПМ [11]. Неспецифическим вагиниту и цервициту отводится значительная роль в формировании различных осложнений, в частности, воспалительных заболеваний органов малого таза (ВЗОМТ), неблагоприятных исходов беременности (преждевременные роды, преждевременное излитие околоплодных вод), в увеличении риска возникновения послеродового эндометрита, осложнений после аборта [12–14]. Поэтому такие пациентки нуждаются в этиопатогенетической терапии, отличающейся от лечения бактериального вагиноза [15]. Несмотря на многочисленные исследования и методы лечения, распространенность и частота рецидивирования вагинита и цервицита у женщин репродуктивного возраста все еще остаются высокими [16]. Исходя из этого, поиск альтернативных комбинированных методов терапии является чрезвычайно актуальным.
С учетом гетерогенности условно-патогенной флоры, выявленной при бактериологическом исследовании вагинального и цервикального секрета, для лечения неспецифического вагинита и цервицита необходимы бактерицидные препараты, воздействующие на широкий спектр УПМ [15]. По современным данным, подтверждена эффективность терапии неспецифических вагинита и цервицита β-лактамными ингибиторозащищенными препаратами, в частности, амоксициллином/клавулановой кислотой [5, 17]. Однако наличие внутриклеточных УПМ, таких как микоплазма, требует назначения этиотропных антибактериальных препаратов, в частности макролидов, чувствительность к которым Мicoplasma hominis и Ureaplasma urealyticum in vitro составляет около 98% [18, 19].
 Флемоклав солютаб (амоксициллин/клавулановая кислота) представляет собой бактерицидный препарат из группы β-лактамных антибиотиков, комбинированных с ингибитором β-лактамаз. В настоящее время, согласно основной инструкции по медицинскому применению, показанием для назначения препарата являются инфекции в акушерстве и гинекологии. Препарат эффективен в отношении большинства аэробных и анаэробных микроорганизмов.
Флемоклав солютаб (амоксициллин/клавулановая кислота) представляет собой бактерицидный препарат из группы β-лактамных антибиотиков, комбинированных с ингибитором β-лактамаз. В настоящее время, согласно основной инструкции по медицинскому применению, показанием для назначения препарата являются инфекции в акушерстве и гинекологии. Препарат эффективен в отношении большинства аэробных и анаэробных микроорганизмов.
Вильпрафен (джозамицин) является антибактериальным препаратом из группы макролидов, который воздействует на аэробные и анаэробные бактерии, а также на внутриклеточные микроорганизмы (микоплазмы), применяется при цервицитах, вызванных хламидиями и/или микоплазмами.
Принимая во внимание предшествующий клинический опыт, согласно которому эффективность лечения амоксициллином/клавулановой кислотой вагинита, а джозамицином – цервицита может достигать 80–90% [20, 21], целью данной наблюдательной программы явилась оценка эффективности и безопасности препаратов флемоклав солютаб (амоксициллин/клавулановая кислота) и/или вильпрафен (джозамицин) в терапии неспецифического вагинита и/или цервицита в рутинной клинической практике акушера-гинеколога.
Материал и методы исследования
Многоцентровое неинтервенционное проспективное наблюдательное исследование проводилось в период с ноября 2013 по август 2014 гг. в 15 центрах шести городов Российской Федерации (Москва, Санкт-Петербург, Екатеринбург, Самара, Омск и Кемерово). В ФБГУ НЦАГиП им. академика В.И. Кулакова Минздрава России исследование проводилось на базе гинекологического отделения восстановительного лечения. Изучалась эффективность и безопасность терапии неспецифического вагинита и/или цервицита с использованием препаратов флемоклав солютаб (одна таблетка которого содержит амоксициллин в виде амоксициллина тригидрата 875 мг и клавулановую кислоту в виде калия клавуланата 125 мг) и вильпрафен (активное вещество джозамицин 500 мг), «Астеллас Фарма Юроп Б.В.», Нидерланды.
Было включено 712 пациенток, из которых 711 завершили исследование. Критериями включения были: возраст пациенток от 18 до 50 лет, установленный диагноз неспецифического вагинита (НВ) и/или неспецифического цервицита (НЦ); решение врача о лечении амоксициллином/клавулановой кислотой и/или джозамицином в амбулаторных условиях; наличие информированного согласия. Критериями исключения были: беременность и лактация; постменопауза; установленные возбудители специфического вагинита/цервицита (C. trachomatis; N. gonorrhoeae; T. vaginalis; Candida spp.); рецидивирующий вульвовагинальный кандидоз в анамнезе; невозможность перорального приема препаратов; антибиотикотерапия за 1 месяц до включения в программу, наличие противопоказаний к назначению амоксициллина/клавулановой кислоты и/или джозамицина.
Во время первого визита (Визит 0, День – 10…0) проводился сбор анамнеза, оценка физиологических показателей (частота сердечных сокращений, частота дыхания, температура тела), физикальный осмотр, клинический и биохимический анализы крови, общий анализ мочи, гинекологический осмотр с оценкой pH влагалища, микроскопическое, бактериологическое и ПЦР-исследование (M. hominis, Ureaplasma spp., N. gonorrheae., C. trachomatis) отделяемого из влагалища и цервикального канала.
Согласно принципам неинтервенционного исследования амоксициллин/клавулановая кислота и джозамицин в составе монотерапии или комбинации назначались лечащим врачом при наличии показаний в рекомендуемых дозировках и режиме дозирования в соответствии с утвержденной инструкцией по медицинскому применению. Согласно действующим на момент проведения исследования инструкциям, флемоклав солютаб (амоксициллин/клавулановая кислота) рекомендовался к приему по 1 таблетке (872/125 мг) 2 раза в сутки; вильпрафен (джозамицин) – по 1 таблетке (500 мг) 3 раза в сутки. Продолжительность лечения цервицита и вагинита определялась врачом на основании этиологии и тяжести заболевания и составляла в среднем около 7–10 дней. Период последующего наблюдения длился максимально 45 дней. Согласно рутинной клинической практике и протоколу программы, общая продолжительность участия пациентки в исследовании составила не >55 дней, включая период предварительного диагностического обследования. По протоколу пациентки посещали врача четыре раза: при обследовании, в день назначения терапии, при завершении лечения (через 28±7 дней), во время которых проводились диагностические обследования, и во время последующего наблюдения в течение 10±7 дней после завершения терапии, при котором оценивалась эффективность терапии и нежелательные явления (НЯ). Лабораторная диагностика проводилась для оценки безопасности применяемой терапии и соответствовала стандартным процедурам, применяющимся в условиях повседневной клинической практики.
По итогам исследования во время заключительного визита оценивалась клиническая эффективность терапии на основании полного или частичного исчезновения клинических признаков и симптомов и микробиологическая эффективность – по динамике эрадикации этиологического агента. Параметры переносимости определялись по качественной оценке лечащего врача. Параметры безопасности включали в себя оценку НЯ, а также анализ пациенток с НЯ с хроническими соматическими заболеваниями и женщин, у которых обнаружился кандидоз во время исследования.
Исследование было одобрено Межрегиональным независимым этическим комитетом при некоммерческом партнерстве «Межрегиональная ассоциация по клиническим исследованиям» (протокол заседания № 17 от 25.10.2013 г.).
Для анализа результатов наблюдательной программы использованы методы дескриптивной статистики. Для оценки эффективности и безопасности терапии проводился статистический анализ категориальных данных, полученных во время исследования, с использованием таблиц частот и точного критерия Фишера. Для описания категориальных данных использовались проценты или доли.
Результаты и обсуждение
Проанализированы данные 711 пациенток с симптомами неспецифического вагинита и/или цервицита, средний возраст составил 31,3±7,0 года. Пациентки не различались между собой по основным демографическим показателям: росту, массе тела, индексу массы тела, что позволило объединить их для анализа согласно цели исследования, считая выборку исследования гомогенной.
НВ диагностирован у 215 пациенток (30,2%), из них 67,9% получали амоксициллин/клавулановую кислоту, у 7,4% применялся джозамицин, а у 24,7% – комбинация данных антибиотиков. НЦ диагностировали у 242 пациенток (34%), из которых 69,0% получали джозамицин, 16,9% – амоксициллин/клавуланат, 14,1% – комбинацию препаратов. Сочетание НВ и НЦ обнаружено у 254 пациенток (35,7%), из них 51,6% получали комбинацию препаратов амоксициллин/клавулановая кислота и джозамицин, 25,6% – амоксициллин/клавулановую кислоту, 22,8% – только джозамицин.
Таким образом, из 711 пациенток монотерапию препаратом амоксициллин/клавулановая кислота прошли 252 пациентки, монотерапию препаратом джозамицин – 241, комбинацию обоих препаратов – 218 женщин.
 Доля пациенток с отягощенным соматическим анамнезом составила 30,4% (n=216) (рис. 1). У пациенток с сочетанием вагинита и цервицита чаще выявлялись сопутствующие экстрагенитальные заболевания (37,4% пациенток, n=95): хронические воспалительные заболевания ЛОР-органов (36,8%), инфекции моче-выделительной системы (17,9%), гипо- и гипертиреоз (8,4%). Почти половина включенных в исследование пациенток (56,8%, n=404) имели в анамнезе гинекологические заболевания: хронический цервицит, сальпингоофорит, эндометрит, аденомиоз, миому матки, вторичное бесплодие, синдром поликистозных яичников и др. Из них в 54,7% случаев (n=221) регистрировались 2 и более сопутствующих заболевания, среди которых преобладало сочетание хронического цервицита с хроническими сальпингоофоритом или эндометритом (26,2%). Наиболее часто отягощенный гинекологический анамнез отмечался у пациенток с диагнозом НЦ и при сочетании НЦ с НВ (69,4 и 62,6% соответственно). Изучение анамнеза свидетельствует о том, что почти у половины пациенток имелась рецидивирующая цервико-вагинальная инфекция, с преобладанием в группе с сочетанием НВ с НЦ (67,7%, n=172).
Доля пациенток с отягощенным соматическим анамнезом составила 30,4% (n=216) (рис. 1). У пациенток с сочетанием вагинита и цервицита чаще выявлялись сопутствующие экстрагенитальные заболевания (37,4% пациенток, n=95): хронические воспалительные заболевания ЛОР-органов (36,8%), инфекции моче-выделительной системы (17,9%), гипо- и гипертиреоз (8,4%). Почти половина включенных в исследование пациенток (56,8%, n=404) имели в анамнезе гинекологические заболевания: хронический цервицит, сальпингоофорит, эндометрит, аденомиоз, миому матки, вторичное бесплодие, синдром поликистозных яичников и др. Из них в 54,7% случаев (n=221) регистрировались 2 и более сопутствующих заболевания, среди которых преобладало сочетание хронического цервицита с хроническими сальпингоофоритом или эндометритом (26,2%). Наиболее часто отягощенный гинекологический анамнез отмечался у пациенток с диагнозом НЦ и при сочетании НЦ с НВ (69,4 и 62,6% соответственно). Изучение анамнеза свидетельствует о том, что почти у половины пациенток имелась рецидивирующая цервико-вагинальная инфекция, с преобладанием в группе с сочетанием НВ с НЦ (67,7%, n=172).
При бактериологической диагностике основными возбудителями как вагинита, так и цервицита являлись E.coli (25,0%) и E. faecalis (14,2%). При сочетании вагинита с цервицитом наравне с E.coli и E. faecalis, наиболее часто высеивался St. agalactiae (15,7%). Микст-инфекция, вызванная двумя и более возбудителями, чаще выявлялась при сочетании НВ с НЦ (32,2%). Среди инфекционных агентов Ureaplasma spp. в качестве моноинфекции чаще встречалась при цервицитах (в 79,2% случаев моноинфекции), а в составе ассоциаций возбудителей часто выделялась при НЦ (в 97,1% всех случаев микст-инфекции), и при сочетании НВ с цервицитом (91,9%).
Анализ современной литературы показывает, что в норме во влагалище присутствуют внутриклеточные микроорганизмы (в том числе микоплазмы: M. hominis и U. urealyticum), которые в ряде случаев могут стать причиной воспалительных заболеваний у женщин [8]. Так при цервиците сравнительно часто выявляются микоплазмы (М. hominis – в 21,9%, Ureaplasma spp. – в 38,4–39,9% случаев) [22, 23]. U. parvum и U. urealyticum являются самыми частыми возбудителями НЦ. Проведение ПЦР-диагностики доказывает, что Ureaplasma spp. встречается у 58,7% пациенток с НЦ: из них U. parvum в 30,3%, U. urealyticum – в 16,1% случаев, а микст-инфекция диагностируется в 12,3% случаев (р<0,05) [24]. Таким образом, результаты настоящего исследования, выполненного на российской популяции, согласуются с мировыми данными и свидетельствуют о значимой роли генитальных микоплазм в качестве возбудителей цервиковагинальной инфекции.
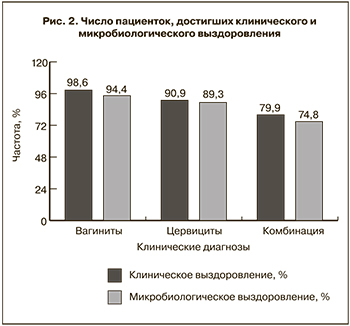
Согласно полученным данным, клиническое выздоровление было зафиксировано в большинстве случаев, вне зависимости от диагноза: в 212 случаях (98,6%) при НВ, в 220 случаях (90,9%) при НЦ, в 203 случаях (79,9%) при сочетании НВ с НЦ. Частичное выздоровление зафиксировано в 3 случаях (1,4%) при НВ, в 18 случаях (7,4%) при НЦ и в 43 случаях (16,9%) при сочетании НВ с НЦ. Отсутствие эффекта от терапии наблюдалось в 3 случаях (1,2%) при НЦ, в 7 случаях (2,8%) при сочетании НВ с НЦ и не наблюдалось при НВ.
Оба препарата показали сходный профиль эффективности. Клиническое выздоровление после терапии амоксициллин/клавулановой кислотой отмечено в 225 случаях (89,3%), частичное выздоровление – в 24 (9,5%), неэффективность терапии – у 2 пациенток (0,8%). Выздоровление после терапии джозамицином произошло в 212 случаях (88,0%), частичное выздоровление – в 24 (10,0%), неэффективность терапии – у 4 пациенток (1,7%). Выздоровление после комбинированной терапии амоксициллин/ клавуланатом и джозамицином отмечено в 198 случаях (90,8%), частичное выздоровление – в 16 (7,3%), неэффективность терапии – у 4 пациенток (1,8%). Результаты анализа свидетельствуют о том, что клиническое выздоровление отмечалось у большинства пациенток с вагинитом и цервицитом вне зависимости от наличия или отсутствия сопутствующей соматической патологии.
Таким образом, исследуемые препараты амоксициллин/клавулановая кислота и джозамицин продемонстрировали эффективность в отношении купирования основных клинических симптомов НВ и/или НЦ: уменьшение количества патологических выделений из влагалища и цервикального канала; отсутствие гиперемии и отека слизистой оболочки вульвы, влагалища и шейки матки.
Микробиологическая эффективность исследуемой терапии оценивалась врачами-исследователями на заключительном визите (через 31–45 дней с момента начала лечения) путем определения одного из следующих исходов терапии: выздоровление (полная эрадикация этиологического возбудителя); частичное выздоровление (частичная эрадикация этиологического возбудителя); неэффективность терапии (неадекватный ответ на терапию, требующий назначения других антибактериальных средств); невозможность оценки ответа (пациентка недоступна для наблюдения).
Согласно полученным данным, микробиологическое выздоровление было зафиксировано у большинства пациенток с НВ – в 203 случаях (94,4%), НЦ – в 216 (89,3%), при сочетании НВ с НЦ – у 190 пациенток (74,8%). Частичное выздоровление произошло в 12 случаях (5,6%) при НВ, в 22 (9,1%) – при НЦ и у 48 пациенток (18,9%) с НВ и НЦ. Отсутствие эффекта исследуемой терапии наблюдалось в 3 случаях (1,2%) при НЦ, у 15 пациенток (5,9%) при сочетании НВ с НЦ и не наблюдалось при вагините.
Оба препарата показали сходный профиль микробиологической эффективности. Выздоровление после терапии препаратом амоксициллин/клавулановая кислота отмечено в 212 случаях (84,1%), частичное выздоровление – в 31 (12,3%), а неэффективность терапии – в 8 (3,2%). Выздоровление после терапии джозамицином произошло в 208 случаях (86,3%), частичное выздоровление – в 28 (11,6%), а неэффективность терапии – у 4 пациенток (1,7%). Выздоровление после комбинированной терапии препаратами амоксициллин/клавулановой кислоты и джозамицина наблюдалось в 189 случаях (86,7%), частичное выздоровление – в 23 (10,6%), а неэффективность терапии – у 6 пациенток (2,8%).
Анализ данных микробиологических исследований продемонстрировал высокую эффективность исследуемой терапии у пациенток с сопутствующей соматической патологий. У пациенток с НВ, имевших сопутствующую соматическую патологию, полное выздоровление было зафиксировано у 50 (92,9%), а частичное выздоровление у 4 пациенток (7,4%); при НЦ среди пациенток, имевших сопутствующие соматические заболевания, выздоровление произошло в 58 случаях (86,6%), частичное выздоровление – в 8 (11,9%), а неэффективность терапии отмечена лишь в 1 случае (1,5%).
Анализ результатов бактериологического исследования в динамике показал, что исследуемые препараты оказывают бактериостатический эффект в отношении возбудителей основного заболевания, характеризующийся, прежде всего, статистически значимым снижением умеренного и значительного роста УПМ. Так у пациенток, принимавших препарат амоксициллин/клавулановой кислоты, независимо от диагноза, выявилось значимое подавление роста E. faecalis, E.coli, Staphylococcus spp., Streptococcus spp., K. pneumoniae, Megasphaera spp. и др. (p<0,05), при этом не было отмечено значимого роста Candida spp.
У пациенток, принимавших джозамицин, выявилось подавление роста большинства значимых этиологических возбудителей: E. faecalis, E.coli, S. Saprophyticus, S. epidermidis, Streptococcus spp., Eubacterium spp., Peptostreptococcus spp., Atopobium vaginae, Gardnerella vaginalis, Veillonella spp. (p<0,05). Кроме того, препарат продемонстрировал эффективность и в отношении Ureaplasma spp. (p<0,05). Лишь у пациенток с НЦ на фоне приема джозамицина выявлялся незначительный рост до 102 КОЕ/мл Candida spp. (5,6 % случаев) (p<0,05), данный титр не имеет клинической значимости.
В группе комбинации препаратов амоксициллин/клавулановой кислоты и джозамицина выявилось значимое подавление роста практически всех выявленных возбудителей НВ и НЦ (p<0,05), что демонстрирует наибольшую эффективность совместного применения антибактериальных препаратов при данных заболеваниях. Но стоит отметить, что при этом отмечена самая высокая частота случаев незначительного (7,4%) и умеренного роста (5,2%) Candida spp. не более 102–104 КОЕ/мл (p<0,05), не сопровождавшегося клиническими проявлениями.
Анализ динамики показателей ПЦР-диагностики вагинального секрета у пациенток с НВ выявил значимое снижение случаев выявления G. vaginalis (0% по сравнению с 62,7% до лечения, p<0,05), Ureaplasma spp. (16,6%, по сравнению с 25,49% до начала терапии, p=0,06) и случаев выявления нескольких возбудителей в биообразцах (0,47 %, по сравнению с 6,05 % до лечения, p<0,05). У пациенток с НЦ и при сочетании НЦ с НВ выявилось снижение общего количества единично обнаруженных M. hominis и Ureaplasma spp. (p<0,05), а также случаев выявления нескольких возбудителей в биообразцах (Ureaplasma spp. + M. hominis, p<0,05). Таким образом, положительная динамика показателей ПЦР-диагностики выявлена вне зависимости от диагностированного заболевания и применяемого препарата. Однако при комбинированном приеме двух антибиотиков у пациенток при сочетании НВ с НЦ увеличились случаи выявления Candida spp. (у 30,3% пациенток, p<0,05). Полученные данные соответствуют результатам зарубежных исследований, при которых частота обнаружения Candida spp. во время пероральной антибиотикотерапии и в течение 4–6 недель после составляет от 5 до 30% [25, 26].
Амоксициллин/клавулановая кислота и джозамицин давно применяются в акушерско-гинекологической практике и имеют доказанную эффективность в лечении урогенитальных инфекций. Например, в рандомизированном сравнительном исследовании G. Cormio [26] доказано, что частота послеоперационных инфекционно-воспалительных осложнений в 2 раза ниже в случае использования амоксициллина/клавулановой кислоты по сравнению с цефазолином (р=0,016).
В зарубежных исследованиях чувствительность Ureaplasma spp. к джозамицину составляет от 86 % до 98% по данным различных авторов [27, 28]. Кроме того, Ureaplasma spp. при НЦ демонстрирует высокую чувствительность и самую низкую резистентность (<5,0%) к джозамицину по сравнению с доксициклином и азитромицином [23]. При этом, как показано в ряде исследований [29, 30], джозамицин сохраняет высокую активность в отношении штаммов Ureaplasma spp. при ее ассоциации с другими возбудителями, резистентными к основным антибиотикам. Учитывая вышеизложенное, джозамицин является одним из препаратов выбора в лечении неспецифических инфекций нижних отделов генитального тракта.
Полученные данные подтверждают результаты предшествующих исследований и свидетельствуют о микробиологической эффективности терапии амоксициллин/клавуланавой кислоты и джозамицин в отношении возбудителей НВ и/или НЦ, при которой максимальный эффект достигается в случае назначения комбинации амоксициллин/клавулановая кислота с джозамицином.
Суммарные данные о клиническом и микробиологическом выздоровлении пациентов представлены на рис. 2.
Анализ частоты назначения сопутствующей терапии в зависимости от диагноза показал, что в большинстве случаев исследуемые препараты назначались в качестве единственных средств этиотропной терапии. Стоит отметить, что случаи назначения терапевтического комплекса, состоящего из большего количества препаратов, включали в себя местную терапию вагинитов и цервицитов, а также сопутствующую комплексную терапию пробиотическими и антимикотическими препаратами.
Согласно полученным данным, большинство пациенток переносило антибактериальную терапию хорошо. При приеме амоксициллин/клавулановой кислоты хорошая переносимость отмечена в 228 случаях (90,5%). Терапия переносилась удовлетворительно в 20 случаях (7,9%), непереносимость препарата была у 3 пациенток (1,2%). При приеме джозамицина хорошая переносимость отмечена в 207 случаях (85,9%); лечение переносилось удовлетворительно у 31 пациентки (12,9%), а непереносимость терапии была у 2 пациенток (0,8%). При совместном приеме исследуемых препаратов хорошая переносимость отмечена в 197 случаях (90,4%); удовлетворительная оценка дана в 17 случаях (7,8%), а непереносимость комбинированной терапии выявлена у 4 пациенток (1,8%). Таким образом, терапевтический курс амоксициллином/ клавулановой кислотой, джозамицином, или их комбинацией в большинстве случаев характеризовался хорошей переносимостью.
Оценка безопасности исследуемой терапии производилась посредством регистрации нежелательных явлений (НЯ), выявленных в ходе проведения программы, выявления доли пациенток с нежелательными реакциями (НР) во время проведения программы, а также доли пациенток с хроническими соматическими заболеваниями с выявленными НР во время проведения программы и количества женщин, у которых развился кандидоз во время исследования. К НЯ исследователями были отнесены: диарея, тошнота, кожная сыпь, обострение гастрита, боль в животе. НЯ, классифицированные врачами как серьезные нежелательные явления (СНЯ), были представлены диареей, кожной сыпью, вульвовагинальным кандидозом, тошнотой.
В настоящем исследовании зафиксировано 14 (2,0%) случаев возникновения НЯ, включая 5 случаев СНЯ (0,7%). У пациенток с хроническими соматическими заболеваниями НЯ зарегистрировано в 6 случаях (2,8%). Вульвовагинальный кандидоз на фоне приема исследуемых препаратов развился у 4 пациенток (0,6%): у 1 – на фоне приема амоксициллин/ клавулановой кислоты, у 1 – на фоне приема джозамицина и у 2 пациенток – при комбинированной терапии обоими препаратами. Чаще всего НЯ отмечены в группе приема амоксициллина/клавулановой кислоты (3,6%). СНЯ, в том числе вульвовагинальный кандидоз, чаще всего были вызваны комбинированным приемом двух препаратов (1,4%). В большинстве случаев связь НЯ с приемом исследуемых препаратов была расценена как возможная.
Заключение
На основании полученных данных можно заключить, что исследуемые препараты флемоклав солютаб (амоксициллин/клавулановая кислота) и вильпрафен (джозамицин) являются высокоэффективными при лечении НВ и/или НЦ. Они обладают выраженным эффектом в отношении эрадикации наиболее распространенных возбудителей инфекций и демонстрируют благоприятный профиль безопасности из-за низкой частоты развития вульвовагинального кандидоза и других нежелательных явлений.
Авторы выражают признательность клиническим центрам и исследователям, принимавшим участие в исследовании: проф. В.Е. Радзинскому и доц. И.М. Ордиянц (РУДН, Москва), И.А. Душкиной (Гута-клиник), Е.А. Душкиной и проф. Е.Ф. Кира (ИУВ НМХЦ им. Пирогова, Москва), проф. Ю.Н. Перламутрову и доц. Н.И. Черновой (МГМСУ, Москва), А.А. Чургановой (КДЦ, ГКБ № 7), проф. А.Л. Тихомирову и Г.А. Грачеву (МГМСУ, Москва), доц. П.В. Буданову (ПМГМУ, Москва), проф. Н.И. Тапильской и доц. С.С. Аганезову (СпбГМУ им. И.П. Павлова), А.Р. Хачатурян (НИИАГ им. Д.О. Отта, Санкт-Петербург), доц. Н.А. Татаровой и доц. С.В. Рищук (СпбГМУ им. И.И. Мечникова, Санкт-Петербург), доц. О.Л. Молчанову и Ж.М. Карпищенко (ВМА им. С.М. Кирова, Санкт-Петербург), К.Е. Кира (СпбГМУ им. Мечникова, Санкт-Петербург), проф. Е.Н. Кравченко (ОмГМА, Омск), О.Л. Цыганковой (РД № 1, Омск), О.В. Прохоровой (УрГМА, Екатеринбург), проф. Н.В. Спиридоновой (ИПО СамГМУ, Самара), проф. Е.В. Уткину (КемГМА, Кемерово), проф. Т.А. Обоскаловой (УрГМА, Екатеринбург), Н.В. Карасевой («Добромед», Москва), М.Д. Меркуловой (Поликлиника № 4 УДП, Москва), Н.С. Меньшиковой (Москва), Н.В. Зароченцевой (МОНИИАГ, Москва).



