В докладе Всемирной организации здравоохранения 2015 года о глобальном наблюдении за инфекциями, передаваемыми половым путем (ИППП), отмечается, что в мире частота новых случаев хламидийной инфекции, гонореи, сифилиса и трихомониаза составляет 1 млн ежедневно.
В настоящее время большинство публикаций содержат информацию о том, что до 80% вульвовагинитов, цервицитов и воспалительных заболеваний органов малого таза (ВЗОМТ) вызваны полимикробными инфекциями.
Многие отечественные авторы единодушны во мнении, что ведущими инициаторами воспалительных заболеваний являются C. trachomatis (30–37%) и N.gonorrhoeae (40–50%), при этом более половины из них протекают бессимптомно. Указана также роль бактерий родов Staphylococcus (53–56%) и Streptococcus (33%), условно-патогенной флоры и анаэробов (20–56%).
Отмечается, что важной особенностью хронических инфекций является наличие смешанной аэробно-анаэробной флоры, ассоциированной с вирусами [1, 2].
Частота ассоциаций возбудителей, указываемая в литературе, варьирует в широком диапазоне, однако клинические рекомендации по лечению приводятся только для заболеваний, вызванных моноинфекцией.
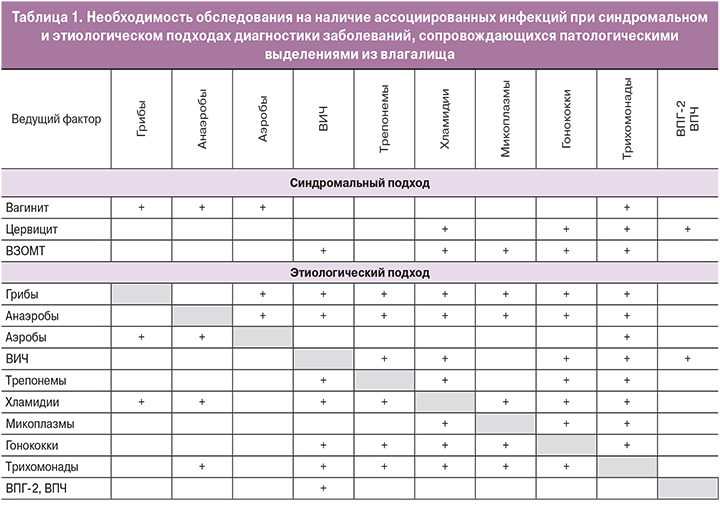
Классификация инфекций половых органов у женщин основана на двух подходах: синдромальном и этиологическом [3].
На основе синдромального подхода выделяют три группы заболеваний (в скобках указана этиологическая роль инфектов в развитии указанного заболевания):
Заболевания, характеризующиеся патологическими выделениями из влагалища: бактериальный вагиноз (G. vaginalis – 60–90%, A. vaginae – 1–40%, другие – Prevotella spp., Peptostreptococci, Porphyromonas, Mobiluncus spp., Leptotrichia spp., Mycoplasma hominis – 1–15%), трихомониаз (Trichomonas v. – 100%), вульвовагинальный кандидоз (C. albicans – 84,6%, C. nonalbicans: C. glabrata – 6,8%, C. Кrusei – 5,6%, C. Parapsilosis – 3,0%, C. Tropicalis – нет данных), аэробный вагинит (streptococci В – 58,7%, Staph. aureus – 41,7%, E. coli – 23,0%, Enterococci fecalis – 9%, Klebsiella spp. – 3,0%) [4–7].
Заболевания, характеризующиеся наличием цервицита, вызванные C. trachomatis (45%), N. gonorrhoea (10%), Trichomonas v. (36%), G. vaginalis (15%), вирусом простого герпеса 2 типа (ВПГ-2) (35%), вирусом папилломы человека (ВПЧ) (75%) и M. genitalium (30%) [8–10].
Воспалительные заболевания органов малого таза, вызванные N. gonorrhoeae (4%), C. trachomatis (9–35%), Cytomegalovirus (ЦМВ) (20–23%), U. Urealyticum, M. genitalium (13–16%) [11, 12]. G. vaginalis, Haemophilus influenza, Enteric gram-negative rod, Strept. agalactiae увеличивают риск ВЗОМТ в 2 раза [13].
Этиологический подход позволяет классифицировать заболевания, вызывающие выделения из влагалища, на группы (в скобках указана распространенность в популяции, %):
Инфекции, не передаваемые половым путем – бактериальный вагиноз (БВ) (24–30%), вульво-вагинальный кандидоз (9,7–11,7%), неспецифический (аэробный) вагинит (5–23,7%) [14, 15].
Инфекции, передаваемые половым путем – хламидийная (3,7–4,7%), гонококковая (1,6–5%), трихомониаз (3,1–13,3%), инфекция, вызванная ВПГ 2 типа (11,3% – клинически выраженный, 90% – носительство), ВПЧ (78,1% – у женщин с цервикальной интраэпителиальной неоплазией (CIN II–III); 86,6% – с раком шейки матки; 12,6% – с нормальной цитологией шейки матки) [3, 8, 16, 17].
Неинфекционные – атрофический вагинит, полипы и эктопия шейки матки, дерматит преддверия, красный плоский лишай, злокачественные заболевания, свищи, наличие инородных тел или ВМС.
Среди инфекций, вызванных полимикробными ассоциациями, различают:
Микст-инфекции (смешанные) – заболевания, вызванные несколькими видами бактерий и/или вирусов с единым патогенезом, при этом ассоцианты проявляют повышенную вирулентность, резистентность, тяжесть клинических проявлений, продолжительность терапии (синергия). Типичными представителями микст-инфекций являются бактериальный вагиноз и аэробный вагинит.
Ко-инфекции (ассоциированные, сочетанные) – заболевания, вызванные несколькими видами микроорганизмов с собственным патогенезом, которые независимо друг от друга вызывают клинические проявления, как правило, с преобладанием доминирующего фактора.
Суперинфекции – состояния, вызванные резким ростом бактерий другого типа, отличающегося от вызвавшего первичную манифестацию заболевания. Обычно суперинфекция связана с лечением, которое проводится без учета полимикробной природы заболевания, когда элиминация «ведущего» возбудителя приводит к манифестации другого, и/или в случае заражения резистентными микроорганизмами.
В современной литературе приводятся различные сведения о частоте сочетаемости инфекций. Их обобщенный анализ показал, что при выделении одного ведущего микробного фактора сочетание его с другими инфектами имеет следующую частоту (приводится верхний предел диапазона по сведениям разных авторов): трихомонады – 92%, микоплазмы – 90%, хламидии – 85%, бледная трепонема – 72%, ВПГ-2 и ВПЧ – 71%, ВИЧ – 64%, аэробы – 61%, анаэробы – 57%, гонорея – 40%, грибы – «часто» (цифровые данные отсутствуют).
Эпидемиологические исследования показали, что БВ связан со значительным повышением риска ИППП (для N. gonorrhoeae ОР=4,1; 95% ДИ: 1,7–9,7; C. trachomatis – ОР=3,4; 95% ДИ: 1,5–7,8; ВПГ-2 – ОР=2,1; 95% ДИ: 1,0–4,5) [18], ВИЧ (ОР=2,0; 95% ДИ: 1,2–3,5) и ВЗОМТ (ОР=2,03; 95% ДИ: 1,16–3,53) [19–22], в особенности женщины с БВ и новым сексуальным партнером (ОР=8,77; 95% ДИ: 1,11–69,2) [13].
ВПГ-2 и сифилис также могут повышать риск ВИЧ-инфицирования. Так, 81% женщин с ВИЧ коинфицированы ВПГ-2, а распространенность ВИЧ среди пациентов с ВПГ-2 составляет 16% против 2% среди неинфицированных [9]. Распространенность сифилиса среди ВИЧ-инфицированных женщин – 5,9% против 0,9% у неинфицированных [23].
Ассоциация C. trachomatis у женщин с цервицитом с C. albicans составляет 25%, с БВ – 24%, T. vaginalis – 8% (по другим данным – 36%) [24].
Трихомонады ассоциированы с двумя и более патогенами: микоплазмами – 47,3%, гарднереллами – 31,4%, гонококками – 29,1%, ВИЧ –20%, хламидиями –18,2%, грибами –15,7% [25, 26].
Аэробный вагинит диагностируется в сочетании с ВВК – в 38% случаев, БВ – 37% и трихомониазом – 25% [15].
Проблема инфекционно-воспалительных заболеваний полового тракта у женщин усугубляется тем, что, несмотря на особое внимание, уделяемое ей в научно-практической литературе и общественном здравоохранении, диагностика заболеваний существенно ниже ее реальной распространенности – около 60% пациентов имеют бессимптомные формы заболеваний, а своевременную медицинскую помощь в соответствии с доказательными рекомендациями получают менее 50% нуждающихся в ней [27].
Известно, что заболевания, вызванные смешанной инфекцией, характеризуются более длительным течением, клинически протекают тяжелее, часто рецидивируют, на их фоне нередко возникают различные осложнения, которые приводят к нарушениям репродуктивной функции. Кроме того, при смешанной инфекции, особенно при хроническом течении заболевания, добиться излечения гораздо труднее, чем при моноинфекции.
Таким образом, высокая частота полимикробных ассоциаций требует диагностики всех абсолютных патогенов (ИППП), а также инфекций, не связанных с половой передачей (БВ, ВВК, аэробный вагинит), у женщин с заболеваниями, сопровождающимися патологическими выделениями из влагалища[8, 25, 28–31] (табл. 1).
Такой подход позволяет провести адекватную санацию и предотвратить распространение инфекций в верхний отдел генитального тракта, а также обеспечивает своевременное лечение ВЗОМТ и профилактику осложнений, приводящих, к функциональным и структурным повреждениям тазовых органов [8].
Особую тревогу вызывает антимикробная резистентность – устойчивость микроорганизма к препарату, который изначально был эффективен для лечения инфекций, вызванных им. При этом стандартные виды лечения становятся неэффективными, а инфекции сохраняются, увеличивается риск их распространения [3].
ВОЗ приводит список установленной резистентности микроорганизмов к антимикробным препаратам во всем мире (здесь – фрагмент, имеющий отношение к половым инфекциям): N. gonorrhoeae – к цефалоспоринам третьего поколения; E. coli – к фторхинолонам; Klebsiella p. – к цефалоспоринам третьего поколения и карбапенемам; Staph. aureus – к метициллину; Candida spp. (non-albicans) – к противогрибковым препаратам (флуконазолу); кишечные бактерии – к карбапенемам (класс β-лактамных антибиотиков с широким спектром действия); стафилоккоки – к препаратам первого ряда (метициллин, оксациллин); ВИЧ – к препаратам антиретровирусной терапии из схем первой и второй линии [3].
В связи с установленными фактами резистентности к антибиотикам эксперты ВОЗ в 2016 г. пересмотрели рекомендуемые и альтернативные схемы лечения наиболее распространенных ИППП – инфекций, вызванных C. trachomatis, N. gonorrhoeae, ВПГ-2 и сифилиса [25, 28–31].
Критериями выбора лекарственных средств для лечения ИППП были определены следующие: высокая эффективность (не менее 95%); высокое качество (активный ингредиент); экономичность; низкий уровень токсичности; отсутствие резистентности; разовая доза (однократное применение); пероральное введение; отсутствие противопоказаний для беременных или кормящих женщин; соответствующие лекарства должны быть включены в национальные перечни основных лекарственных средств.
Экспертами ВОЗ подчеркивается, что женщин, у которых обнаружены C. trachomatis и которым поставлен диагноз неосложненной инфекции шейки матки, вызванной C. trachomatis, следует рассматривать как лиц с наличием субклинической инфекции верхних отделов репродуктивного тракта. Всем лицам, у которых обнаружена C. trachomatis, следует начинать лечение незамедлительно, поскольку задержки лечения могут быть связаны с осложнениями (ВЗОМТ, внематочная беременность, бесплодие, хронические тазовые боли) [25].
Резистентность C. trachomatis к рекомендуемым препаратам не выявлена, поэтому, как и прежде, используются азитромицин (1 г внутрь 1 раз) или доксициклин (100 мг внутрь 2 раза в день 7 дней) (Ia; A) [22, 23].
При инфицировании C. trachomatis, когда сопутствующая инфекция М. genitalium была верифицирована, лечение азитромицином проводится по схеме: 500 мг 1-й день, затем 250 мг 1 раз в день в течение 4 дней (III; С) [31].
Что касается гонореи, то в соответствии с пересмотренными руководящими принципами, опубликованными ВОЗ, наиболее эффективным методом лечения на сегодняшний день является комбинированная терапия: цефтриаксон (250 мг в/м) вместе с азитромицином (1 г внутрь) (Ia; A). Лечение только одним препаратом более не рекомендуется. Последние данные свидетельствуют, что цефиксим в настоящее время не является эффективным в лечении гонореи, и существуют опасения, что устойчивость может развиться ко всем цефалоспоринам. Ограничение использования цефиксима сейчас может помочь сохранить цефтриаксон как вариант для лечения этой инфекции [28]. При выявлении трихомониаза он должен быть пролечен в первую очередь.
Для лечения трихомониаза рекомендуются метронидазол 2 г или тинидазол 2 г внутрь однократно (Ia; A) [32]. При латентных, торпидных и хронических формах трихомониаза дополнительно назначается местное лечение, которое необходимо применять одновременно с протистоцидными препаратами общего действия (внутрь). В случае сочетания трихомониаза с БВ следует воспользоваться метронидазолом (внутрь 500 мг 2 р/сут 7 дней) либо принимать тинидазол по 2 г внутрь в течение 3 дней (Ia; A) [33].
Схема лечения ВЗОМТ смешанной этиологии может быть представлена следующим образом: инъекция цефтриаксона 250 мг + азитромицин 1 г + 14-дневный прием метронидазола (местно), а при наличии трихомонад – 2 г внутрь (III; С) [25, 26, 28, 31–33].
Людей, живущих с ВИЧ, следует рассматривать в плане выбора антибактериальных средств так же, как ВИЧ-отрицательных (IV; С) [29].
Как было указано выше, половые инфекции (хламидийная, гонорейная, трихомониаз) и антибиотикотерапия являются факторами риска, ассоциированными с развитием БВ. Ключевое звено патогенеза БВ – образование биопленки, которая состоит из G. vaginalis, A. vaginae и других бактерий, при этом содержание лактобактерий снижается до 0,1–0,001% [34].
Поскольку резистентность анаэробов (в том числе G. vaginalis) к антимикробным средствам не установлена, в настоящее время в клинических рекомендациях [33] указаны следующие схемы для лечения БВ: метронидазол гель 0,75% 5 г вагинально 1 раз в день 5 дней (Ia; A) или клиндамицин крем 2% 5 г вагинально 7 дней (Ia; A). Прием препаратов внутрь (метронидазол 500 мг внутрь 2 раза в день 7 дней или тинидазол 2,0 г перорально 1 раз в сутки в течение 3 дней) рекомендуется только при устойчивости к вагинальному лечению данными препаратами либо при сочетании с трихомонадами (Ia; A).
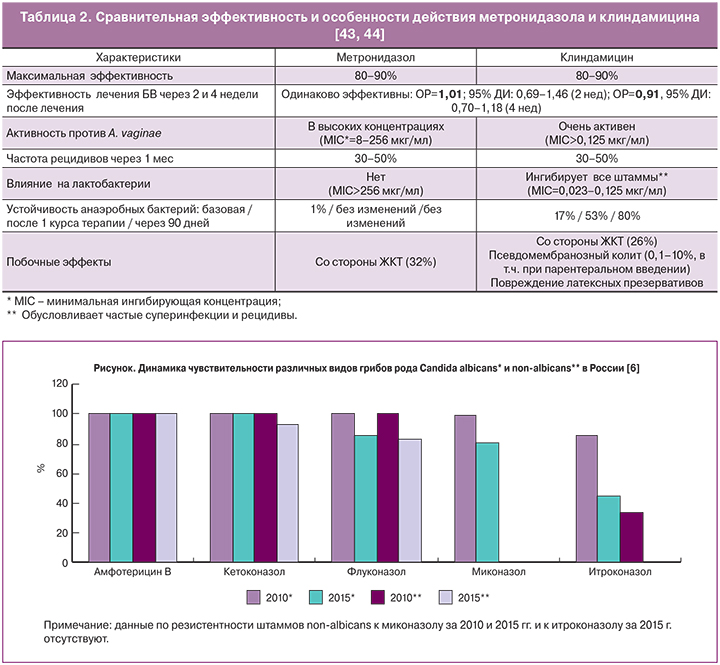
Эффективность метронидазола была доказана в рандомизинированных клинических исследованиях и достигает 90% по критериям Амселя [35]. В обзоре работ базы Кокрейна [36] указывается, что предпочтительны схемы с введением метронидазола в дозе 500 мг 2 раза в день на протяжении 7 дней вагинально по сравнению с однократной дозой 2 г внутрь (эффективность 82% против 62%), а клиндамицин и метронидазол одинаково эффективны независимо от режима введения при наблюдении в течение 2 и 4 недель (ОР=1,01; 95% ДИ: 0,69–1,46; ОР=0,91, 95% ДИ: 0,70–1,18 соответственно).
Однако работы последних лет все чаще свидетельствуют о вариабельности клинического эффекта метронидазола в диапазоне от 58 до 100%, что, вероятно, связано с образованием биопленок и присутствием иных инфектов [37]. Работы A. McMillana соавт. [38], выполненные in vitro, демонстрируют эффективность метронидазола, сравнимую со штаммами лактобактерий (L. Reuteri RC-14 и L. Rhamnosus GR-1), по отношению и к G. vaginalis и к А. vaginae, а также способность к неполному разрушению биопленок за счет образования «отверстий» в них.
Большое разнообразие микрофлоры во влагалище при БВ может оказаться причиной его рецидивирующего течения. Имеются сведения о достижении лучшего эффекта при применении комбинированных средств (например, свечей метромикон-нео, содержащих метронидазола 500 мг и миконазола 100 мг) при одновременном присутствии возбудителей БВ, грибов и/или кокковой флоры [39]. Это связано с тем, что кокки могут захватывать активную нитрогруппу и приводить к снижению концентрации действующего вещества, провоцируя, таким образом, относительную «резистентность» к метронидазолу, а миконазол помимо антифунгального обладает и антибактериальным действием в отношении грамположительных бактерий [40].
В отдельных публикациях было показано, что A. vaginae в исследованиях in vitro демонстрировали бóльшую чувствительность к клиндамицину, чем к метронидазолу [41, 42]. Между тем, те же авторы предостерегают от назначения клиндамицина при первом эпизоде БВ, поскольку анаэробная флора быстрее формирует устойчивость к клиндамицину, чем к метронидазолу, а также полностью ингибирует лактобактерии [43, 44] (табл. 2).
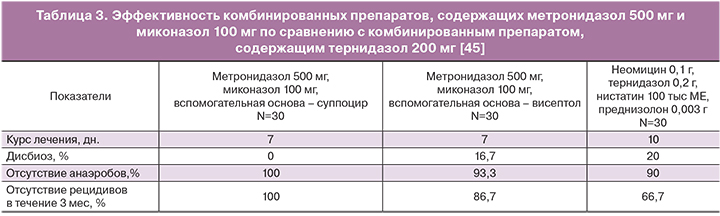
В сравнительном исследовании комбинированных препаратов, содержащих метронидазол и миконазол, с тернидазолом продемонстрировано (табл. 3), что эффективность препарата определяется не только дозой активного вещества, но и носителем суппоцир АМ (в препарате метромикон-нео), который обеспечивает его высокие биоадгезивные и мукоадгезивные свойства [45].
Для БВ не характерны зуд и жжение – наличие этих признаков свидетельствует о смешанном процессе – его сочетании с аэробным вагинитом. В этом случае при положительных критериях Амселя при микроскопии вагинальных выделений дополнительно выявляют лейкоциты.
Бактериальные, грибковые и смешанные вагинозы и вагиниты могут быть успешно излечены комбинированными препаратами с антибактериальным и антифунгальным действием (клиндамицин с бутоконазолом, нифуратель с нистатином), а также антисептическими препаратами (повидон-иод, деквалиния хлорид).
В связи с установленным фактом резистентности C. non-albicans к противогрибковым препаратам, производным нитроимидазола и триазола, в особенности к флуконазалу (рисунок), и увеличением их роли в возникновении ВВК за последние 5 лет [6] в качестве средства первой линии терапии при рецидивах рекомендуется натамицин (суппозитории примафунгин по 100 мг 1 раз в сутки 6 дней) (III; С) или второй линии – нистатин (суппозитории 100 тыс ЕД 1 раз в сутки 21 день) [36].
Врачи могут влиять на риск инфицирования путем эффективного консультирования [8, 46], направленного на изменение поведения и проведения мер первичной профилактики ИППП (включая ВИЧ), а также нежелательной беременности. Скрининговые программы уменьшают как распространенность хламидийной инфекции, так и частоту ВЗОМТ у женщин. Сексуально активные женщины в возрасте младше 25 лет и женщины в возрасте 25 лет и старше с факторами риска (например, новый сексуальный партнер или несколько партнеров) должны ежегодно проходить скрининг на хламидийную инфекцию.
Таким образом, изменения в эпидемиологии (высокая сочетаемость инфекций, увеличение распространенности вирусных патогенов) и изменение устойчивости к противомикробным препаратам, наблюдаемые в последние годы, требуют новых подходов и рекомендаций по предупреждению, лечению и управлению ИППП и воспалительных заболеваний, вызванных другими инфекциями.
Применение антибиотиков в эпоху все возрастающей резистентности микроорганизмов к ним как с лечебной, так и с профилактической целью, должно быть строго обосновано и подкреплено доказательными данными, а любые произвольные решения должны быть исключены.



