В декабре 2019 г. в Ухане (Китай) произошла вспышка заболевания (COVID-19), вызванного новой коронавирусной инфекцией (SARS-CoV-2), которая быстро распространилась по всему миру.
К настоящему времени накопилось достаточно данных, свидетельствующих о том, что заболевание, вызванное SARS-CoV-2, протекает в различных формах – от бессимптомного течения до тяжелых форм, сопровождающихся обширным поражением легких, приводящим к острому респираторному дистресс-синдрому, полиорганной недостаточности и сепсису [1, 2]. Уровень смертности составляет 0,5–3,5% [3].
Значимую роль в развитии тяжелых форм заболевания играет нарушение регуляции иммунного ответа, поэтому раннее выявление маркеров иммунной дисрегуляции может помочь в понимании патогенеза развития тяжелых форм заболевания и разработке методов терапии и профилактики данных осложнений.
Целью исследования было оценить состояние иммунной системы и сравнить различия в иммунологических показателях у пациентов с разной тяжестью течения COVID-19.
Материалы и методы
В проспективное исследование были включены 62 больных COVID-19. Критериями включения явились: подтверждение диагноза COVID-19, возраст 18+ лет, подписанное информированное добровольное согласие на включение в исследование и возможность проведения забора крови через 3–7 дней от старта заболевания. Критериями исключения были: ВИЧ-инфекция и другие врожденные и приобретенные иммунодефициты, любые хронические инфекционные, онкологические, аутоиммунные и ревматические заболевания, период беременности и лактации для женщин, прием иммуномодулирующих препаратов в течение не менее 3 месяцев до старта болезни и во время болезни.
В зависимости от тяжести заболевания пациенты были разделены на 3 группы: группа 1 – 29 человек с легкой формой болезни; группа 2 – 17 человек со среднетяжелой формой COVID-19; группа 3 – 16 человек с тяжелой формой болезни.
Критериями легкой формы COVID-19 было выявление РНК SARS-CoV-2 методом полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) в мазке из ротоглотки в сочетании со следующими клиническими проявлениями: температура не выше субфебрильной (<38°С) и отсутствие критериев тяжелого и среднетяжелого течения инфекции.
Критериями среднетяжелой формы заболевания было выявление РНК SARS-CoV-2 методом ОТ-ПЦР в мазке из ротоглотки в сочетании с каким-либо из следующих клинических проявлений: температура выше субфебрильной (>38°С), частота дыхательных движений (ЧДД) >22/мин, одышка при физических нагрузках, сатурация кислорода (SpO2) <95%; наличие пневмонии по данным компьютерной томографии (КТ) с минимальным или средним объемом поражения легких (КТ 1–2).
Критериями тяжелой формы заболевания было выявление РНК SARS-CoV-2 методом ОТ-ПЦР в мазке из ротоглотки в сочетании с каким-либо из следующих клинических проявлений: ЧДД > 30/мин;
SpO2 ≤93%; PaO2/FiO2 ≤300 мм рт.ст.; снижение уровня сознания, ажитация; нестабильная гемодинамика (систолическое АД менее 90 мм рт.ст. или диастолическое АД менее 60 мм рт.ст., диурез менее 20 мл/ч); изменения в легких при КТ (рентгенографии), типичные для вирусного поражения (объем поражения значительный или субтотальный; КТ 3–4); qSOFA >2 баллов [4].
Идентификация вируса проводилась с помощью «Набора реагентов для выявления РНК коронавирусов SARS-CoV-2 и подобных SARS-CoV методом ОТ-ПЦР в режиме реального времени (SARS-CoV-2/SARS-CoV)» (ООО НПО «ДНК-Технология», Россия). В качестве мишеней были выбраны три участка генома: специфичные для коронавируса ЅАRЅ-СоV-2 участки гена N и гена Е, а также консервативный участок гена Е, общий для группы коронавирусов, подобных ЅАRЅ-СоV (включая ЅАRЅ-СоV и ЅАRЅ-СоV-2). Амплификацию проводили на приборе «ДТ-964» (ООО НПО «ДНК-Технология», Россия). Обработка результатов осуществлялась автоматически с помощью программного обеспечения к прибору.
На 3–7-е сутки от начала заболевания производились забор крови из периферической вены и оценка параметров иммунограммы с оценкой общего числа лимфоцитов, анализом субпопуляционного состава лимфоцитов: CD3+, CD3+CD4+, CD3+CD8+, CD19+, CD3-CD56+CD16+, CD3+CD56+CD16+, CD19+CD5+, Tрег, с оценкой содержания в периферической крови активированных лимфоцитов (CD3+HLA-DR+, CD3+CD25+), а также фагоцитарной активности нейтрофилов (ФАН) с расчетом индекса стимуляции (ИС).
Фенотипирование лимфоцитов периферической крови осуществлялось методом проточной цитометрии с помощью моноклональных антител (мАт), меченных FITC или PE, против антигенов CD3 (FITC), CD4 (PE), CD5 (PE), CD8 (PE), CD16 (PE), CD19 (FITC), CD56 (PE), CD25 (FITC), HLA-DR (FITC) (Becton Dickinson и eBioscience, США). Оценивалось содержание основных субпопуляций иммунокомпетентных T-клеток (СD3+, CD4+, CD8+), В-клеток (CD19+), B1-клеток (CD19+CD5+), NK-клеток (СD56+СD16+). Лимфоцитарный гейт, позволяющий исключить из анализа другие клетки крови, выявлялся с помощью мАт к СD45, меченных перидинин-хлорофилл-протеином (PerCP), (Dako, Дания). Для оценки позитивноокрашенных субпопуляций использовались соответствующие FITC- или PE-меченые изотипические IgG.
Трег-клетки с внутриклеточной экспрессией FOXP3 в цельной крови определялись как субпопуляция с фенотипом СD4+CD25highCD127low/-, с использованием сочетания мАт к антигенам CD4, меченных PerCP (eBioscience, США), CD25, меченных FITC (Becton Dickinson, США), и СD127, меченных РЕ (eBioscience, США). Оценивалась доля Трег среди CD4+-клеток. Моноклональные антитела добавлялись непосредственно к цельной крови, затем лизировались с помощью раствора FACS Lysing Solution (Becton Dickinson, США).
ФАН оценивали с помощью метода FagoFlow (ExBio, Чехия). Тест основан на оценке окислительного взрыва в гранулоцитах после стимуляции E. сoli. Отношение средней интенсивности флуоресценции (СИФ) активированных гранулоцитов стимулированных образцов и отрицательных контролей отражает интенсивность окислительного взрыва гранулоцитов после стимуляции Е. coli и обозначается как ИС.
Фенотипирование лимфоцитов и оценка ФАН выполнялись на проточном цитофлуориметре Gallios (Beckman Coulter, США) с использованием программы Kaluza.
Забор крови для определения концентрации цитокинов производился на 3–7-е сутки от начала заболевания. Фактор роста фибробластов (FGF basic), Eotaxin, гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), интерферон-гамма (IFN-γ), интерлейкины (IL)-1β, IL-1ra, IL-1α, IL-2Rα, IL-3, IL-12 (p40), IL-16, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, GRO-α, фактор роста гепатоцитов (HGF), IFN-α2, фактор ингибирования лейкемии (LIF), моноцитарный хемотаксический протеин (MCP-3), IL-10, IL-12 (p70), IL-13, IL-15, IL-17A, IP-10, MCP-1, монокин, индуцированный гамма-интерфероном (MIG), фактор роста нервов (β-NGF), фактор стволовых клеток (SCF), фактор роста стволовых клеток (SCGF-β), фактор стромальных клеток (SDF-1α), макрофагальный белок воспаления (MIP-1α), MIP-1β, тромбоцитарный фактор роста (PDGF-BB), хемокин, регулирующий активацию, экспрессируемый и секретируемый нормальными Т-клетками (RANTES), фактор некроза опухоли (TNF)-α, фактор роста эндотелия сосудов (VEGF), кожный Т-клетки аттрактирующий хемокин (CTACK), макрофаг ингибирующий фактор (MIF), лиганд, индуцирующий апоптоз, связанный с фактором некроза опухолей (TRAIL), IL-18, колониестимулирующий фактор макрофагов (M-CSF), TNF-β в плазме периферической крови определяли мультиплексным методом с использованием стандартной 48-плексной тест-системы Bio-Plex Pro Human Cytokine Screening (Bio-Rad, США) на проточном лазерном иммуноанализаторе Bio-Plex 200 (Bio-Rad, США) с последующей обработкой полученных результатов с использованием приложения Bio-Plex Manager 6.0 Properties (Bio-Rad, США).
Согласно инструкции производителя тест-системы компании Bio-Rad, для приготовления образцов ЭДТА-плазмы применяли двукратное центрифугирование образцов периферической крови при 1000 g в течение 15 минут при 4°С и 10 000 g в течение 10 минут при 4°С. Образцы плазмы замораживали и хранили до момента проведения анализа при температуре -80°С.
Статистический анализ
Для статистического анализа использовали пакет статистических программ Microsoft Office Excel 2007 и программы MedCalc v16.8. Проверку гипотезы о нормальном распределении количественных переменных осуществляли, используя критерий Шапиро–Уилка. В случае нормального распределения данные представлены средней величиной и стандартным отклонением (M (SD)), в случае отклонения распределения от нормального данные были представлены как медиана и интерквартильный размах (Ме (Q1; Q3)). Для оценки значимости различий между двумя группами нормально распределенных количественных переменных использовали t-критерий Стьюдента для независимых выборок с неравными дисперсиями. В случае отклонения распределения количественных переменных от нормального с указанной целью использовали U-критерий Манна–Уитни. Различия считали статистически значимыми при р<0,017, с учетом поправки Бонферрони для парных сравнений при наличии трех обследуемых групп. Другие случаи использования представления данных и используемых статистических критериев указаны в тексте.
Исследование было одобрено комиссией по этике ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России (протокол №4 от 23.04.2020).
Результаты
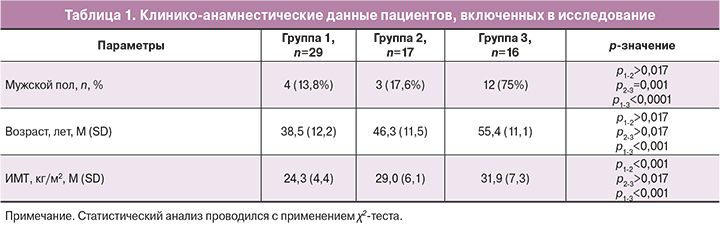
Отмечено статистически значимое отличие пола, возраста и индекса массы тела (ИМТ). Преобладали лица мужского пола и более старшего возраста в группе с тяжелой формой COVID-19, также в этой группе был выше ИМТ (табл. 1).
Все пациенты 1-й и 2-й групп с клиническими проявлениями COVID-19 находились на амбулаторном лечении и получали тот или иной вид терапии. Наиболее часто назначались антибиотики широкого спектра действия – 32 из 46 человек (69,5%) и препараты низкомолекулярных гепаринов (НМГ) в профилактических дозировках – 17 из 46 человек (36,9%). Пневмония по данным КТ (КТ-1 или КТ-2) была диагностирована только у пациентов во 2-й группе – у 12 (70,6%) человек.
В 3-ю группу были включены пациенты с тяжелым течением заболевания. Важно отметить, что данная группа пациентов характеризовалась высокой гетерогенностью тяжести течения COVID-19 на всем протяжении пребывания в отделении интенсивной терапии. Эта изменчивость состояния проявлялась как в показателях лабораторных анализов, так и, особенно выраженно, в клинической картине. В течение одних суток и даже часов клиническая картина у данных пациентов могла значительно изменяться. Из 16 пациентов данной группы 12 (75%) были мужского пола. Средний возраст пациентов составил 55,4±11,1 года, а ИМТ – 31,9±7,3 кг/м2. Значительно отличалось время пребывания пациентов в отделении интенсивной терапии, варьировало от 4 до 40 дней; в среднем это значение составило 15,5 дня. Исходом заболевания для всех пациентов с тяжелой формой заболевания стали выздоровление и перевод из отделения интенсивной терапии. Все пациенты данной группы имели высокую ЧДД –>30/мин, снижение уровня SpO2≤93% и требовали назначения оксигенотерапии. Режимы вентиляции у пациентов данной группы за время лечения, в связи с изменением клинического состояния, могли меняться неоднократно. При поступлении в отделение интенсивной терапии и первой оценке лабораторных показателей 2 пациента (12,5%) находились на инвазивной вентиляции легких (ИВЛ), 2 пациента (12,5%) – на неинвазивной вентиляции легких (НИВЛ), 8 пациентов (50%) находились на высокопоточной назальной оксигенации, 4 пациента (25%) – на инсуффляции кислорода через лицевую маску с высоким потоком кислорода (15 л/мин). Респираторный индекс PaO2/FiO2 варьировал в диапазоне от 105 до 274 мм рт.ст. и в среднем составил 152,5 мм рт.ст. Во время дальнейшего пребывания в отделении интенсивной терапии ИВЛ потребовалась 6 пациентам (36,5%). Снижение уровня сознания наблюдалось у 3 (18,75%) пациентов при поступлении в отделение и у 8 (50%) пациентов за все время лечения в отделении интенсивной терапии. Признаки нестабильной гемодинамики (систолическое АД менее 90 мм рт.ст.) отмечались у 2 (12,5%) пациентов на момент поступления в отделение интенсивной терапии и требовали назначения вазопрессорной поддержки. Стоит отметить, что у 5 (31,25%) пациентов на момент поступления в отделение отмечалось повышенное артериальное давление (систолическое АД выше 140 мм рт.ст). Снижение темпа диуреза (диурез менее 20 мл/ч) было выявлено у 1 (6,25%) пациента. Заместительная почечная терапия и эфферентные методы лечения на данном этапе не проводились ни одному из пациентов. У всех пациентов данной группы при КТ диагностированы изменения в легких, типичные для вирусного поражения: у 5 пациентов – КТ-2, у 9 пациентов – КТ-3, у 2 пациентов – КТ-4. По шкале тяжести течения COVID-19 NEWS2 полученные данные варьировались в диапазоне от 2 баллов, отражающих низкий риск тяжелого течения, до 9 баллов, указывающих на высокий риск течения заболевания. В среднем этот показатель составил 6 баллов, отражающих средний риск тяжелого течения COVID-19. По шкале qSOFA средний показатель составил 1,3 балла, что указывало на низкий риск тяжелого течения COVID-19 на данном этапе заболевания. Однако по результатам, полученным в ходе расчета шкалы SOFA, данные варьировались в диапазоне от 3 до 6 баллов и в среднем составили 4 балла (смертность при таком значении при первоначальной оценке составляет 20,2%), что характеризует данную группу пациентов, указывая на возможные риски летального исхода. Оценка риска смертности пациентов с тяжелым течением заболевания проводилась с помощью трех наиболее изученных шкал – APACHE-II, SAPS-II, 4C Mortality Score for COVID-19. Прогноз летальности у пациентов данной группы оценивался с помощью шкалы оценки острых физиологических расстройств и хронических нарушений состояния APACHE-II. Полученные данные варьировались от 4 до 15 баллов, в среднем данный показатель составил 7,5 балла (полученный результат соответствует 8% риску внутригоспитальной смертности). Для измерения степени тяжести заболевания у пациентов данной группы при поступлении в отделение интенсивной терапии была проведена оценка по шкале SAPS-II. Полученные данные варьировались от 19 до 46 баллов, в среднем данный показатель составил 26 баллов (полученный результат соответствует 7,2% риску внутригоспитальной смертности). Определение группы риска внутрибольничной смертности проводилось с помощью шкалы 4C Mortality Score for COVID-19, специально разработанной для госпитализированных пациентов с COVID-19. Полученные данные варьировались от 5 до 15 баллов, в среднем данный показатель составил 9 баллов (полученный результат соответствует группе пациентов высокого риска внутрибольничной смертности и составляет 31,4–34,9%), что говорит о тяжелом течении заболевания и высоком риске летальности у данной группы пациентов. Был зафиксирован один летальный исход в этой группе после перевода в другое лечебное учреждение. Сопутствующие заболевания, такие как ожирение, сахарный диабет, гипертоническая болезнь, были диагностированы у 4/16 (25%), 2/16 (12,5%) и 3/16 (18,75%) пациентов соответственно.
При оценке параметров клинического и биохимического анализа крови было выявлено, что пациенты с тяжелой формой COVID-19 (группа 3) имели более высокие уровни лейкоцитов, нейтрофилов, нейтрофильно-лейкоцитарного индекса (НФ/ЛФ) и С-реактивного белка (СРБ), а также низкий уровень относительного и абсолютного содержания лимфоцитов (табл. 2).

При анализе параметров иммунограммы было выявлено, что у пациентов с тяжелой формой COVID-19 (группа 3) определялось низкое содержание абсолютного количества CD3+, CD3+CD4+, CD3+CD8+, Т-лимфоцитов, экспрессирующих активационный маркер HLA-DR (CD3+HLA-DR+), NK-клеток, а также ФАН, ИС (табл. 3). Следует отметить повышение относительного содержания Трег-клеток (табл. 3).

Для оценки клинической значимости выявленных отличий в содержании изученных субпопуляций лимфоцитов в прогнозе развития тяжелых форм COVID-19 проведен ROC-анализ. Результаты его представлены в таблице 4.
Для показателей СРБ, НФ, ЛФ, абсолютное содержание NK-клеток и Т-лимфоцитов (как общего количества, так и субпопуляций и количества Т-лимфоцитов с экспрессией HLA-DR), индекс НФ/ЛФ, ФАН, ИС параметры диагностической значимости оказались лучшими, и поэтому при поступлении в отделение реанимации и интенсивной терапии эти показатели можно использовать как предикторы неблагоприятного исхода заболевания. Все обнаруженные изменения вышеперечисленных показателей иммунограммы указывают на проявление дисфункции иммунной системы, которая может привести к развитию системного воспалительного ответа [5].
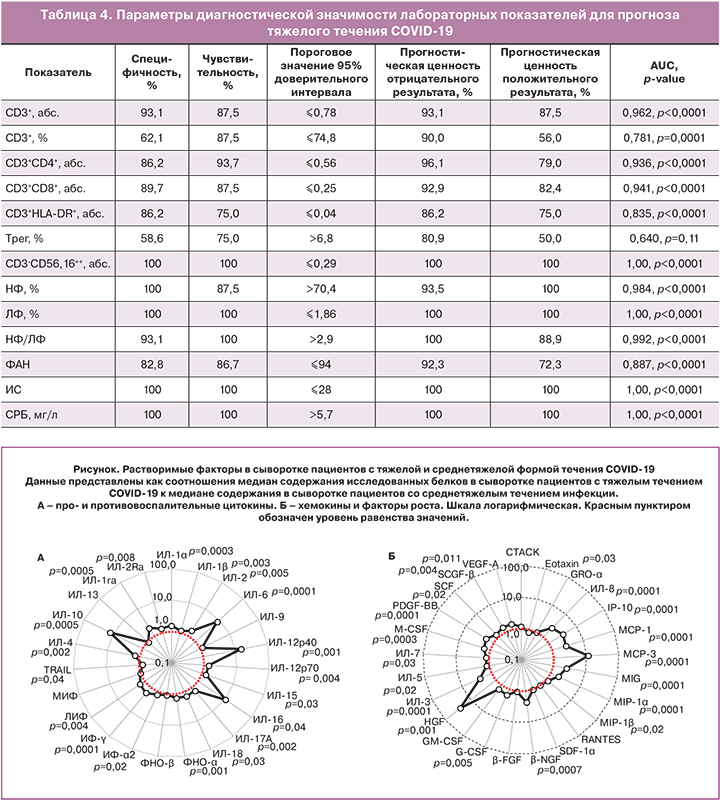
Для подтверждения полученного результата у больных с тяжелой и среднетяжелой формами заболевания оценивали содержание про-, противовоспалительных цитокинов, хемокинов и ростовых факторов. Данные представлены в таблице 5, на рисунке.
Цитокиновый профиль плазмы периферической крови в группе больных с тяжелой формой COVID-19 характеризовался изменением 39 из 48 исcледованных растворимых факторов, за исключением CTACK, GRO-α, SDF-1α, GM-CSF, IL-13, MIF, RANTES, TNF-β, IL-9. Обращает на себя внимание высокий уровень провоспалительных цитокинов IL-6, IL-12р40, IL-16 и иммунорегуляторного IL-10, хемокинов МСР-1, МСР-3, MIG, MIP-1α, MIP-β, IP-10, IL-8 и практически всех исследованных факторов роста (G-GSF, M-GSF, HGF, PDGF, SCF, SCGF, VEGF-A, β-NGF), что и отражает развитие у пациентов с тяжелой формой заболевания феномена, названного «цитокиновым штормом», связанного с разрушением различных популяций клеток в организме и обуславливающего разнообразие и тяжесть клинических симптомов, приводящих к неблагоприятным исходам.


Таким образом, более высокие уровни лейкоцитов, нейтрофилов, СРБ, НФ/ЛФ, а также низкий уровень относительного и абсолютного содержания лимфоцитов, выраженные изменения иммунологических показателей, системная воспалительная реакция, связанная с высвобождением медиаторов («цитокиновый шторм»), предрасполагают к тяжелой форме течения COVID-19.
Обсуждение
Цитокины и хемокины играют важную роль в патогенезе вирусных инфекций. Нейтрофилы также играют важную роль во врожденном иммунитете, который является первой линией защиты от вирусных инфекций, поэтому дисбаланс или гиперреакция иммунной системы может привести к иммунопатологии [6–8]. Хотя нет прямых исследований участия провоспалительных цитокинов и хемокинов в развитии патологии легких во время инфекций, вызванных другими штаммами коронавирусов с формированием SARS- и MERS-синдромов (2002 и 2012 гг.), есть данные о высокой роли гипервоспалительных реакций в патогенезе острого респираторного синдрома у пациентов с тяжелым течением заболеваний. Высокие сывороточные уровни провоспалительных цитокинов (IFN-γ, IL-1, IL-6, IL-12 и TGFβ) и хемокинов (CCL2, CXCL10, CXCL9 и IL-8) были обнаружены у пациентов с SARS с тяжелым течением заболевания по сравнению с уровнем у пациентов с неосложненным течением ОРВИ [9–12], и, напротив, эти пациенты имели очень низкие уровни противовоспалительного цитокина IL-10 [9]. В дополнение к провоспалительным цитокинам и хемокинам, у лиц с летальным исходом атипичной пневмонии наблюдались повышенные уровни IFN (IFN-α и IFN-γ) и IFN-стимулированных генов (ISG; CXCL10 и CCL-2), по сравнению со здоровыми людьми из контрольной группы или людьми с заболеванием легкой/средней степени тяжести [13–16]. Эти результаты впервые позволили предположить возможную роль IFN и ISG в иммунопатогенезе SARS у людей. Следовательно, нарушение регуляции и/или увеличение цитокиновых и хемокиновых ответов со стороны SARS-CoV-инфицированных дендритных клеток и макрофагов может играть важную роль в патогенезе SARS. Изменение ФАН характеризуется продукцией нейтрофилами активных форм кислорода, то есть окислительным взрывом и ее интенсивностью, выражающейся в ИС, что может являться индикатором снижения устойчивости организма к инфекционно-воспалительным агентам. ФАН отражает способность указанных микрофагов крови (одних из основных клеток, способных к фагоцитозу) к поглощению любых патогенных агентов (бактерий, вирусов, пораженных клеток). Снижение данного показателя может наблюдаться при хронических инфекционных заболеваниях, иммунодефицитах, новообразованиях, применении иммунодепрессантов (исключено в нашем исследовании), а также при врожденных дефектах фагоцитарной системы, мальабсорбции, недостаточности питания и др. В базе данных https://pubmed.ncbi.nlm.nih.gov на сегодняшний день имеются единичные публикации, в которых анализируется связь ФАН и COVID-19 [17]. Очевидно, что снижение активности врожденного иммунитета в виде нарушения фагоцитоза нейтрофилами патогенов может негативно влиять на развитие любого инфекционного и воспалительного процесса, в том числе вызванного SARS-CoV-2. Кроме того, внеклеточные ловушки нейтрофилов, внеклеточные сети, высвобождаемые нейтрофилами, могут способствовать высвобождению цитокинов и вносить вклад в формирование «цитокинового шторма» при данном заболевании [18].
Наше исследование подтвердило, что снижение ФАН, ИС, а также нейтрофилия и развитие лимфопении характерны для пациентов с тяжелой формой заболевания, что может указывать на высокую интенсивность воспалительного процесса и высокую степень поражения иммунной системы вирусной инфекцией у пациентов с тяжелым течением заболевания. Поэтому такие показатели иммунограммы, как абсолютное содержание Т-лимфоцитов, субпопуляции Т-клеток, NK-клеток, ФАН, ИС и НФ/ЛФ могут являться надежными прогностическими параметрами развития тяжелых форм COVID-19 [19, 20].
При анализе субпопуляционного состава лимфоцитов обращает на себя внимание снижение показателей Т-клеточного звена иммунитета при увеличенном содержании T-рег-клеток с естественной регуляторной активностью. Последнее позволяет предположить формирование дисбаланса иммунной системы, что, наряду с развитием гипервоспалительных реакций, проявляющихся увеличением СРБ, снижением содержания NK-клеток и одновременно «цитокиновым штормом», при котором наблюдается необычно высокая продукция цитокинов, запускающая иммунопатологические реакции, отражает дисрегуляцию иммунного ответа у больных с SARS-CoV-2 [5, 21]. В работе Murakami M., Kamimura D., Hirano T. [22] предложен потенциальный механизм цитокинового шторма, связанный с активацией через сигнальные пути NF-κB и STAT3 продукции различных провоспалительных цитокинов и хемокинов, следствием которой являются их плейотропные эффекты на клетки приобретенного и врожденного иммунитета: в совокупности ослабление Т-клеточного звена иммунитета в ответе на SARS-CoV-2 и неконтролируемые нарушения воспалительных ответов врожденной иммунной системы на SARS-CoV-2 приводят к «цитокиновому шторму», что согласуется с результатами, полученными в данной работе.
Заключение
Обобщая изложение результатов исследования состояния иммунной системы у пациентов с различной тяжестью течения COVID-19, следует заключить, что выявленные клинико-лабораторные отличия между различными клиническими формами COVID-19, в том числе параметры иммунограммы, включая цитокины, могут быть предикторами развития тяжелых форм инфекции и использоваться в клинической практике для прогноза развития заболевания. Неконтролируемая системная воспалительная реакция, выражающаяся в развитии «цитокинового шторма», лежит в основе неблагоприятных исходов заболевания, поэтому перспективы лечения могут быть связаны с использованием иммуномодулирующей терапии и антагонистов цитокинов.



