С современных позиций синдром поликистозных яичников (СПКЯ) рассматривается не только как одна из ведущих причин гиперандрогении, следствием которой является гирсутизм и ановуляторное бесплодие, но и как форма метаболического синдрома, ассоциированная с риском развития сахарного диабета 2 типа и сердечно-сосудистых заболеваний (ССЗ) [6, 13, 17, 19, 24]. Несмотря на отсутствие клинической манифестации, у больных СПКЯ уже в молодом возрасте могут выявляться маркеры субклинического атеросклероза: эндотелиальная дисфункция, увеличение толщины интима-медиа, кальцификация сонныхартерий,повышенные уровни высокочувствительного С-реактивного белка (вч-CРБ) и провоспалительных цитокинов [1, 22]. Важную роль в атерогенезе играют нарушения метаболизма и транспорта липидов; частота дислипидемий при СПКЯ достигает 60–70%, в их структуре доминирует изолированная гиперхолестеринемия и гипоальфалипопротеидемия [2, 27].
При ожирении коррекция гормональных нарушений и снижение кардиоваскулярных рисков возможны посредством повышения физической активности, снижения массы тела и нормализации метаболических нарушений. При его отсутствии необходимы иные терапевтические подходы, которые предусматривали бы коррекцию как гормональных, так и метаболических нарушений, в том числеатерогенныхдислипидемий.Однакотерапия комбинированнымиоральнымиконтрацептивами
(КОК), которая рассматривается как базисная при СПКЯ, не всегда является метаболически нейтральной, поскольку может способствовать увеличению массы тела, усилению инсулинорезистентности (ИР), повышению уровня триглицеридов (ТГ), холестерина (ХС), липопротеинов низкой плотности (ЛПНП) [4, 26]. В связи с этим наряду с КОК предлагаются альтернативные методы терапии – различные виды инсулиносенситайзеров и гиполипидемические средства,такиекакстатины.
В последние годы появилось несколько клинических исследований, в которых было показано положительное влияние статинов как на синтез липидов, так и на уровень андрогенов у больных
СПКЯ [4, 9, 10]. В связи с этим есть основания полагать, что использование статинов при СПКЯ
может обеспечить снижение гиперандрогении и кардиоваскулярных рисков, хотя целесообразность их клинического применения при СПКЯ не доказана в длительных рандомизированных плацебо-контролируемых исследованиях.
Применение статинов может оказаться целесообразным при назначении КОК больным СПКЯ,
поскольку не исключено, что их длительное использование усугубляет метаболические нарушения, приводя к увеличению частоты дислипидемий и ИР, гиперинсулинемии. Научный интерес к этому аспекту проблемы послужил основанием для проведения данного исследования.
Цель исследования – сравнительная оценка сочетанного воздействия дроспиренонсодержащего КОК и аторвастатина с монотерапией КОК на эндокринно-метаболические параметры больных СПКЯ.
Материал и методы исследования
В проспективное исследование были включены 42 пациентки с СПКЯ, диагностированным в соответствии с Роттердамскими критериями [23], репродуктивного возраста (средний возраст 23,9 года [20,25–27,0]), ранее не получавшие статины, не планирующие беременность, которым
было рекомендовано не менять образ жизни (физическую активность и пищевые привычки) на время проведения исследования. У 25 (59,5%) больных масса тела не превышала нормативных показателей, у 11 (26,2%) имелась избыточная масса тела и у 6 (14,3%) – ожирение. Средний показатель соотношения окружность талии/окружность бедер составил 0,78±0,01. Клинические признаки андрогенизации в виде гирсутизма имелись у 29 (69,0%) женщин с СПКЯ. Нарушения функции яичников диагностированы у всех больных. В подавляющем большинстве случаев – 31 (73,8%) они были представлены олигоменореей (≤8 спонтанных менструаций в год) или вторичной аменореей – 5 (14,3%), у 5 (11,9%) имела место ановуляция на фоне регулярного ритма менструаций.
Больные были рандомизированы в 2 группы: 1-ю составила 21 больная, которой была рекомендована сочетанная терапия КОК, содержащим 30 мкг этинилэстрадиола и 3 мг дроспиренона, и аторвастатином по 20 мг/сут; 2-ю – 21 больная, находившаяся на монотерапии КОК. Результаты
исследования проанализированы у 20 больных 1-й группы, возраст 22,5 (20,5–28,0) года, индекс
массы тела (ИМТ) – 23,5 (21,8 – 26,6) кг/м² и у 19 во 2-й группе, возраст 23,0 (20,0–26,0) года, ИМТ – 24,2 (22,7–27,3) кг/м² ( р>0,05), т.к. 3 пациентки выбыли из исследования в течение первых 3 мес в связи с отсутствием приверженности терапии.
Протокол исследования был одобрен комитетом по этике биомедицинских исследований ФГБУ НЦ АГиП им. академика В.И. Кулакова, пациентки подписали информированное согласие на проведение данного вида терапии.
Длительность терапии составила 24 нед, клинические и биохимические параметры оценивались с 3-месячным интервалом. Определяли уровни лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), тестостерона (Тс), андростендиона (Ас), тестостерон-эстроген-связывающего глобулина (ТЭСГ), индекса свободныхандрогенов(ИСА),оценивали липидный спектр крови, проводили глюкозо-толерантный тест (ГТТ) с динамической оценкой секреции инсулина.
Статистическая обработка данных выполнена на индивидуальном компьютере с помощью электронных таблиц «Microsoft Exсel» и пакета прикладных программ «Statistica for Windows» v.
6.0. Результаты исследования представлены как медиана (25–75% процентиль) (Ме 25–75%).
Результаты исследования
Проведенная терапия сопровождалась супрессией секреции ЛГ, без значимых изменений ФСГ
(см. таблицу). Наиболее выраженный эффект был получен после комбинированной терапии: средний уровень ЛГ понизился на 42%, тогда как после монотерапии КОК – на 20%. Соответственно в 1-й группе более существенно снизилось соотношение ЛГ/ФСГ.
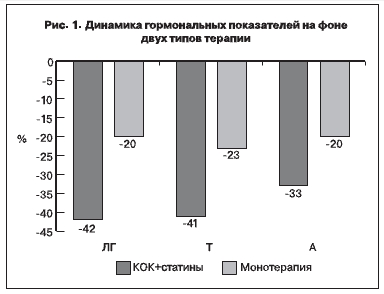
После 6-месячного курса терапии средние уровни Тс статистически значимо понизились в обеих группах, наметилась тенденция к снижению Ас. Однако на фоне комбинированной терапии динамика оказалась достоверно более выраженной: после окончания курса концентрация Тс в сыворотке крови понизилась в среднем на 41%, Ас – на 33%; после монотерапии эти показатели соответственно составили 23 и 20% (р<0,0001), что отображено на рис. 1. На фоне КОК отмечено равнозначное, примерно 3-кратное повышение уровней ТЭСГ, что в сочетании с уменьшением уровня Тс повлекло достоверное снижение ИСА, более значительное в группе комбинированной терапии.
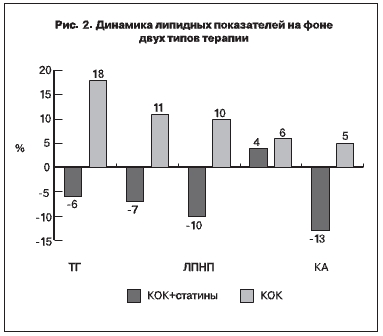
Выявлено разнонаправленное влияние двух видов терапии на показатели липидного спектра крови: на фоне комбинированной терапии уровень ТГ снизился на 6%, ХС – на 7%, ЛПНП – на 10%, коэффициент атерогенности (КА) – на 13%; после монотерапии эти показатели повысились соответственно на 18%, 11, 10 и 5% (рис. 2).
Таблица. Воздействие двух видов терапии на биохимические и гормональные параметры
больных СПКЯ.
Следует отметить, что если исходно существенных различий между группами по показателям липидного спектра крови не найдено, то после комбинированного лечения средние уровни ХС,
ТГ, ЛПНП и КА оказались достоверно более низкими, чем после приема КОК (см. таблицу). Средний уровень вч-СРБ после 6-месячного курса КОК повысился на 3%, что не повлекло за собой изменений средних значений данного показателя, тогда как после сочетанного воздействия КОК со статинами – снизился в среднем на 25%. Статистически значимых различий между группами по средним уровням глюкозы, иммунореактивного инсулина (ИРИ) и индекса НОМА после лечения не выявлено (см. таблицу). Однако уровень ИРИ на фоне КОК повысился на 8%, НОМА – на 9%, а на фоне комбинированной терапии – лишь на 2 и 4% (р=0,43), НОМА – 0% (р=0,069).
Обсуждение
В результате проведенного исследования получены данные о влиянии комбинированной терапии
КОК с аторвастатином на метаболические и эндокринные параметры женщин с СПКЯ. Аторвастатин
относится к группе статинов, являющихся ингибиторами 3-гидрокси-3-метилглутарил-коэнзимА (НМG-CoA) редуктазы. Конкурентное обратимое ингибирование этого фермента приводит к уменьшению печеночного выброса ХС и компенсаторному повышению экспрессии ЛПНП рецепторов в печени. Этот механизм играет основную роль в связывании и последующем удалении из кровотока ЛПНП и липопротеинов очень низкой плотности, что приводит к снижению уровней ХС, ТГ и ЛПНП. Концептуально, можно рассмотреть несколько аспектов целесообразности назначения статинов при СПКЯ. Статины обладают плейотропными кардиопротективными эффектами: антиоксидантным, противовоспалительным и коррегирующим функцию эндотелия [3, 7, 20], а также антиандрогенной активностью.
Согласно полученным результатам, дополнительное применнеие аторвастатина усиливает антиандрогенную активность КОК, характеризующуюся статистически значимым снижением уровней Тс, Ас, ИСА и повышением ТЭСГ. Так, после комбинированной терапии концентрация Тс в сыворотке крови понизилась в среднем на 41%, Ас – на 33%, после монотерапии эти показатели соответственно составили 23 и 20% (р<0,0001).Высокая и сравнимая с нашими результатами эффективность дополнительного применения статинов на уровень Тс была получена в исследовании воздействия комбинированной терапии дезогестрелсодержащим КОК с симвастатином при СПКЯ [4]. Результаты, полученные в ходе проведенного нами исследования, не противоречат данным, представленным в Кохрановском обзоре 2011 г. При сравнении антиандрогенного эффекта комбинированной терапии (КОК+статин) и монотерапии статинами отмечено значительное снижение уровня Тс на фоне комбинированной терапии (средняя разница (MD)=-0,48, 95% доверительный интервал [ДИ] от -0,88 до -0,08, р=0,02) [21]. В литературе имеются данные о том, что симвастатин усиливает антиандрогенный эффект метформина, приводя к дополнительному снижению уровня сывороточного Тс на 25,5% [16].
Гипоандрогенное воздействие статинов можно рассматривать с позиций ингибирования мевалонового пути, что приводит к уменьшению синтеза и доступности ХС, который является субстратом для продукции андрогенов. В исследованиях in vitro был доказан ингибирующий эффект статинов на овариальную продукцию андрогенов, опосредованный снижением пролиферации тека-клеток [14]. Кроме того, статины могут снижать экспрессию ряда ключевых ферментов, участвующих в продукции Ас: фермента боковой цепи расщепления холестерина(P450scc),17a-гидроксилаза/17,20-лиаза (P450c17) и 3b-гидроксистероиддегидрогеназы (3bHSD). Такие эффекты статинов были отмечены
в клетках коры надпочечников [28, 29]. Механизм этого действия может быть связан с ингибирующим эффектом статинов на изопренилирование [24], что ведет к снижению функции малых гуанозин трифосфатаз (Ras, Rho и Rac), которые могут увеличить экспрессию P450scc, P450c17 и 3bHSD.
В связи с этим можно предположить, что статины ингибируют Ras-индуцированный стероидогенез
в яичниках [29].
Согласно полученным данным, терапия КОК с аторвастатином оказывает более выраженный супрессивный эффект на уровень ЛГ по сравнению с КОК (после комбинированной терапии средний
уровень ЛГ понизился на 42%, после монотерапии – на 20%). Хотя в одной из зарубежных публикаций по сравнительной оценке влияния дезогестрелсодержащего КОК и его комбинации с симвастатином представлены данные о сходном снижении уровня ЛГ (на 37%) на фоне двух видов терапии [4]. Различия с полученными нами данными сложно интерпретировать, можно лишь думать об использовании разных статинов и КОК. Механизм действия статинов на гипоталамо-гипофизарную
функцию не ясен и требует дальнейшего изучения. Вполне возможно, что индуцированное аторвастатином снижение уровня андрогенов сопряжено с положительным влиянием на функцию гипоталамо-гипофизарной системы. Подобный эффект был отмечен у женщин с СПКЯ после клиновидной резекции яичников [11]. Концепция о том, что снижение уровня ЛГ может быть опосредовано снижением андрогенов, также подтверждается исследованием, в котором лечение женщин с СПКЯ антиандрогенами привело к восстановлению чувствительности гонадотропин-рилизинг
гормона [12].
Как упоминалось ранее, СПКЯ ассоциирован с риском развития ССЗ. Для женщин с СПКЯ характерно повышение атерогенных фракций липидов, наличие эндотелиальной дисфункции, увеличение толщины интима-медиа, повышение уровней вч-СРБ и провоспалительных цитокинов [8, 22, 25]. Аторвастатин, обладающий гиполипидемическим эффектом, сохраняет свое воздействие при
сочетании с КОК, на фоне которых может изменяться липидный профиль. Проведенное исследование показало, что дроспиренонсодержащий КОК существенно не влияет на атерогенный потенциал крови, тогда как его сочетание с аторвастатином оказывает положительный эффект в виде статистически значимого понижения уровней ТГ, ХС, ЛПНП и КА (на 6%, 7, 10, 13% соответственно). На фоне комбинированной терапии на 25% снижается уровень вч-СРБ – значимого предиктора развития атеросклероза, который существенно не меняется после лечения КОК. В одном из ранее опубликованных исследований на фоне статинов и КОК оценивался уровень белка, который продуцируется эндотелиальными клетками и ассоциирован с развитием атеросклероза – растворимой формы молекулы адгезии сосудистого эндотелия (sVACM) [4]. Выявлено значительно большее снижение
уровня sVACM после комбинированной терапии дезогестрелсодержащим КОК со статином (снижение на 18%) по сравнению с монотерапией КОК (снижение на 10%) [4]. В этом же исследовании был обнаружен однонаправленный, хотя и более выраженный по сравнению с полученными нами данными, эффект снижения ЛПНП и вч-СРБ – на 20 и 45% соответственно. Результаты мета-анализа, представленные в Кохрановском обзоре 2011 г., указывают на отсутствие достоверной динамики
вч-СРБ при использовании статинов по сравнению с плацебо (MD=-2,11, 95% ДИ от -5,25 до -1,03,
р=0,19) [21]. Однако авторы делают заключение, что эти выводы основывались на анализе лишь
двух исследований, поэтому не могут считаться статистически значимыми.
Согласно результатам ряда исследований, статины способны повышать чувствительность тканей
к инсулину как за счет активации сигнальных путей действия инсулина – увеличения тирозинового фосфорилирования инсулинового рецептора и уменьшение серинового [18], так и за счет активации фосфоинозитол3-киназного пути (PI3K), ингибированного при СПКЯ [15]. Снижение ИР может быть сопряжено также с уменьшением андрогенов и с положительным влиянием на уровни ТГ и липопротеинов высокой плотности (ЛПВП) [5]. Однако в Кохрановском обзоре приводятся данные об отсутствии существенного влияния статинов на уровень инсулина натощак и ИР при сравнении с плацебо (MD=-2,04, 95% ДИ от -6,84 до -2,76, р=0,40; MD=-1,10, 95% ДИ от -2,35 до -0,15, р=0,09), а также данные об отсутствии различий комбинированной терапии КОК+статин и монотерапии КОК на уровень инсулина натощак (MD=-0,20, 95% ДИ от -3,26 до -2,86, р=0,90) [21]. Полученные нами данные также показали, что оба вида используемой терапии не оказывают влияния на показатели углеводного обмена, ИРИ и ИР, преимуществкомбинированнойтерапииневыявлено.
Выводы
1. Дополнительное применение аторвастатина усиливает антиандрогенную активность КОК. После 6 меся комбинированной терапии уровни Тс и Ас снижаются на 41 и 33%, после монотерапии – на 23 и 20% соответственно.
2. Сочетание аторвастатина с КОК оказывает положительный эффект на показатели липидного спектра крови, что проявляется статистически значимым снижением уровней ХС, ТГ, ЛПНП
и КА, которые имеют тенденцию к повышению на фоне монотерапии КОК.
3. Оба вида терапии не оказывают негативного влияния на показатели углеводного обмена,
уровни ИРИ и ИР.
4. На фоне комбинированной терапии отмечается значительное снижение (на 25%) уровня одного из предикторов формирования атеросклероза – вч-СРБ, которое существенно не меняется после лечения КОК.
Таким образом, сочетание дроспиренонсодержащего КОК с аторвастатином имеет ряд преимуществ по отношению к монотерапии КОК. Это проявляется более выраженным ингибирующим влиянием на синтез яичниковых андрогенов, положительным воздействием на показатели липидного спектра крови и уровень вч-СРБ.
Сочетанная терапия позволяет получить более выраженный антиандрогенный эффект на фоне снижения традиционных факторов риска формирования ССЗ.



