Синдром поликистозных яичников (СПКЯ) является наиболее распространенным метаболическим и эндокринным заболеванием среди женщин репродуктивного возраста. Для него характерны олигоовуляция или ановуляция, избыток андрогенов и множественные мелкие кисты яичников [1]. Это гетерогенное заболевание неясной этиологии. Имеются убедительные доказательства сложного взаимодействия между генетическими, экологическими и поведенческими факторами [2]. Несмотря на это, по крайней мере у 70% женщин заболевание остается недиагностированным [3]. СПКЯ поражает приблизительно 5–10% женщин репродуктивного возраста [4].
Женщины с СПКЯ предрасположены к висцеральному ожирению, которое оказывает паракринное и эндокринное влияние посредством секреции маркеров воспаления, таких как высокочувствительный С-реактивный белок (вчСРБ), провоспалительные цитокины и другие маркеры эндотелиального воспаления [5]. У них наблюдаются более высокие концентрации вчСРБ в сыворотке крови по сравнению с женщинами без СПКЯ [6]. вчСРБ тесно связан с сердечно-сосудистыми заболеваниями и является независимым фактором сердечно-сосудистого риска [7]. вчСРБ, особенно его активированная форма в стенке кровеносного сосуда, стимулирует экспрессию различных молекул адгезии в эндотелии [8]. Эти молекулы стимулируют воспалительные реакции в сосудах и могут ускорить развитие атеросклероза [9]. Уровень вчСРБ коррелирует с риском сердечно-сосудистых заболеваний; чем выше вчСРБ, тем выше риск [10].
Ширина распределения эритроцитов (RDW-CV) недавно была предложена в качестве нового биомаркера, отражающего провоспалительное состояние, которое, как было показано, ассоциируется с неблагоприятными исходами при различных сердечно-сосудистых заболеваниях [11]. RDW-CV может оказывать более прямое воздействие на метаболические пути сердечно-сосудистых заболеваний. В эритроцитах содержится большое количество свободного холестерина. После любого патологического изменения мембрана может способствовать развитию атеросклероза путем отложения свободного холестерина в бляшках, тем самым обеспечивая богатые липидами мембраны для образования пенистых клеток, а также путем распространения воспалительного каскада [12, 13].
Целью данного исследования явилось изучение ассоциации RDW-CV и вчСРБ как провоспалительных маркеров у женщин с СПКЯ.
Материалы и методы
Настоящее исследование случай-контроль было проведено среди женщин с СПКЯ, посещающих клинику лечения бесплодия медицинского центра Al Sadder Teaching Medical City и консультативную клинику Al-Zahraa Teaching Hospital, Al-Najaf (Ирак) с марта 2018 г. по декабрь 2019 г. Пациентки с СПКЯ, включенные в наше исследование, выразили свое устное согласие на участие в исследовании.
У 50 женщин был выявлен СПКЯ на основании Роттердамских критериев, которые включают гиперандрогению, клинические (гирсутизм или, реже, облысение по мужскому типу) и биохимические (повышенный индекс свободных андрогенов или уровень свободного тестостерона) признаки, а также поликистоз яичников, который диагностировался с помощью ультразвукового исследования (УЗИ). В контрольную группу вошли 50 здоровых женщин (нормальная овуляция без клинической или биохимической гиперандрогении). Критерием включения в исследование был репродуктивный возраст (17–38 лет), а критерии исключения были следующими.
1. Курение.
2. Гормональная или инсулинотерапия либо применение любых других препаратов, влияющих на метаболизм, репродукцию или воспаление (аспирин, статины или любые другие препараты в течение не менее 2 месяцев до исследования крови).
3. Любые известные заболевания, включая диабет, сердечно-сосудистые заболевания, болезни щитовидной железы и инфекционные заболевания.
4. Применение оральных противозачаточных средств.
5. Гематологические заболевания, такие как гемолитическая анемия и талассемия.
Во время базового обследования документировался подробный анамнез, включая возраст, менструальный анамнез, историю приема лекарств, перенесенные заболевания и курение. Для расчета индекса массы тела были измерены рост и вес. Трансвагинальное сонографическое обследование включало базовое УЗИ с использованием вагинального датчика 7,5 МГц Siemens US на 2-й день цикла для подтверждения морфологии яичников при СПКЯ, оценки общего количества и размера фолликулов в обоих яичниках и измерения толщины эндометрия. Забор венозной крови (10 мл) осуществляли во время фолликулярной фазы раннего менструального кровотечения (с 3-го по 6-й день); полученные образцы крови центрифугировали для получения сыворотки. Образцы сыворотки использовались для измерения уровней фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), пролактина, эстрадиола (Е2), общего анализа крови, вчСРБ, гемоглобина, RDW-CV и сахара крови.
При измерении ФСГ разделенные сыворотку или плазму оставляли при температуре 15–30°C менее 8 ч. Производитель рекомендует хранить замороженные образцы до 6 месяцев перед тестированием. Замороженные образцы оттаивали только один раз. Для измерения ФСГ требуется минимум 0,3 мл сыворотки. Объем пробы для индивидуального теста составляет 55 мкл и проводится отдельно. В приборе использовалась система Abbott IMx. Материалы включают: 1) 1 флакон (6,5 мл) покрытых анти-ФСГ (мышиных, моноклональных) микрочастиц в буфере со стабилизаторами белка; 2) 1 флакон (8,5 мл) анти-ФСГ (козьей) щелочной фосфатазы, конъюгированной в буфере со стабилизаторами белка; 3) 1 флакон (10 мл) 4-метилумбеллиферилфосфата, 1,2 мМ в буфере; 4) 1 флакон (13 мл) промывочного буфера, содержащего поверхностно-активное вещество; 5) 1 флакон (4 мл) калибратора IMx FSH Mode 1 (C); 6) 6 флаконов (по 4 мл) калибраторов IMx FSH; 7) 3 флакона (по 8 мл) контролей IMx FSH.
В тесте ЛГ мы использовали минимум 230 мкл плазмы/сыворотки, необходимых для измерения уровня ЛГ с помощью анализатора Сobas e 411. Предпочтительным является объем образца 460 мкл, чтобы можно было проводить повторные анализы одного образца. Сыворотка, собранная с использованием стандартных пробирок для отбора проб или пробирок, содержащих разделительный гель либо плазму Li-, Na-, NH4+ гепарин, K3-EDTA и фторид натрия/оксалата калия, считается приемлемой для выполнения теста. Все образцы, калибраторы и контрольные образцы на анализаторе были измерены в течение 2 ч при температуре 20–25°C перед измерением. Образцы транспортировали в криогенных флаконах объемом 2,0 мл с завинчивающимися крышками. Эти криопробирки маркированы в соответствии с политиками и правилами CDC и DLS. Используемое оборудование, приборы и расходные материалы: 1. анализатор Roche/Hitachi Сobas e 411 (иммуноанализ); 2. пипетка Ovation BioNatural 20–200 мкл (VistaLab Technologies, Brewster, NY); 3. ротатор для гомогенизации образцов: гематологический миксер Adams Nutator и Fisher Scientific; 4. чашки для образцов (стандартные); 5. очищенная вода; 6. калибратор: LH Calset II, Roche; 7. контроль: PreciControl Universal, Roche; 8. Elecsys SysWash: Roche; 9. советы по анализу: Roch; 10. пробирные чашки: Roche.
Измерение E2 проводили путем оценки всех образцов на приемлемость с использованием критериев, указанных в этикетке.
Все образцы размораживали при комнатной температуре: замороженные образцы сыворотки, образцы для контроля качества, рабочие растворы внутреннего стандарта и калибраторы доводят до комнатной температуры и гомогенизируют, помещая их на ротатор на средней скорости примерно на 1,5 ч. Наконечники пипеток, все образцы пациентов, образцы для контроля качества и калибраторы помещали в Hamilton Microlab STAR Let Liquid Handler. Все дополнительные реагенты размещали на приборе в указанных местах. Переносили по 200 мкл каждого калибратора (CC01-CC11), образцы пациентов, контрольные образцы и холостые пробы в соответствующие лунки 96-луночного планшета с лунками объемом 2 мл. Переносили 100 мкл рабочего раствора внутреннего стандарта на все образцы пациентов, контрольные образцы, бланки и калибраторы. Накрывали планшет для образцов с помощью ArctiSeal и давали сыворотке и рабочему раствору внутреннего стандарта уравновеситься с помощью мультивихревой мешалки в течение примерно 45 минут при комнатной температуре. Центрифугировали планшет для образцов в течение 3 минут при комнатной температуре и 2000 об./мин. Флаконы для образцов и контроля качества закрывали и хранили оставшиеся образцы и образцы для контроля качества в специально отведенном месте в морозильной камере при температуре -70°C. Оборудование: центрифуга Eppendorf (Eppendorf, Ramsey, MN), манипулятор жидкости Hamilton Microlab STARLet с 8-канальными и 96-канальными пипетками (Hamilton Company, Reno, NV), водяная баня IsoTemp (Fisher Scientific), Glas-Col MultiPulse Vortexer (Glas-Col, Terre-Hot, Indiana), многопробирочный вихревой смеситель Fisher Digital (Fisher Scientific), пипетка Eppendorf Repeater Plus (Eppendorf, Ramsey, Minnesota), Sato Label Maker CL612e и программное обеспечение для изготовления этикеток, пипетка прямого вытеснения объемом 100 мкл (Gilson, Inc.), 96-луночные планшеты с квадратными лунками объемом 2 мл (Seahorse Labware), 96-луночные, 2-мл квадратные лунки, круглые (Microliter Analytical Supplies INC), роботизированные резервуары, гофрированное дно (Thermo Scientific), ArctiSeal 96-луночный квадратный силикон с PTFE-покрытием (Arctic White LLC), Eppendorf Combitips plus с наконечниками для пипеток, 5 мл (Eppendorf, Ramsey, MN), наконечники Co-RE, 480 наконечников стандартного объема (300 мкл) с фильтрами (Hamilton Company, Рено, Невада), Orbitron Rotator II (Boekel Scientific, Feasterville, PA), Eppendorf Swingbucket Rotor (Eppendorf, Ramsey, MN), Gilson Pipetman, серийный номер: W62622K (Gilson, Inc., Middleton, WI), D1000 объемом 100—1000 мкл для пипетки Diamond (Gilson, Inc., Middleton, WI).
1 мл крови в пробирке с антикоагулянтом вставляли в компьютеризированную машину (CELL-DYN Ruby) и получали результат общего анализа крови, включающий RDW-CV примерно через 1 минуту. Для измерения вчСРБ из образца (сыворотка или плазма) брали 5 мл и добавляли в R1 (разбавитель), выжидали 30 секунд. Затем добавляли к нему 1 каплю R2 (конъюгат) и выжидали 20 секунд. После этого добавляли 1 каплю из R3 (отмывание) и выжидали 20 секунд, затем считывали результаты в мг/л. Отделенную сыворотку или плазму удаляли из клеток в течение 1 ч после сбора. По использованному набору реагентов CRPHS (300 тестов): Реагент R1. ТРИС-буфер с бычьим сывороточным альбумином и иммуноглобулинами (мышь), реагент R2. Оборудование: химический анализатор Roche Cobas 6000 (Roche Diagnostics Corporation, Индианаполис), система Millipore Elix Gulfstream Clinical 35. Очистка воды достигается обратным осмосом, электродеионизацией, бактерицидной УФ-лампой 254 нм и фильтрацией 0,22 мкм.
Нормальные референсные диапазоны для показателей, используемых в лаборатории.
- вчСРБ: концентрация вчСРБ менее 1 мг/л свидетельствует о низком риске сердечно-сосудистых заболеваний и их осложнений, 1–3 мг/л – умеренном риске, более 3 мг/л – высоком риске сердечно-сосудистых осложнений у здоровых лиц и у пациентов с сердечно-сосудистыми заболеваниями.
- ФСГ: до полового созревания 0–4 МЕ/л, в период полового созревания 0,3–10 МЕ/л, во время менструации 4,7–21,5 МЕ/л, после менопаузы 25,8–134,8 МЕ/л, фолликулярная фаза 1–9 МЕ/л, середина цикла 6–26 МЕ/л, лютеиновая фаза 1–9 МЕ/л.
- ЛГ: постменопауза 16–66 МЕ/л, фолликулярная фаза 1–12 МЕ/л, овуляторная фаза 16–104 МЕ/л, лютеиновая фаза 1–12 МЕ/л.
- Пролактин: небеременные женщины – менее 25 нг/мл, беременные женщины – от 80 до 400 нг/мл.
- Гемоглобин: от 12,1 до 15,1 г/дл.
- Эстрадиол: от 30 до 400 пг/мл – для женщин в пременопаузе, от 0 до 30 пг/мл – для женщин в постменопаузе.
- Толщина эндометрия: во время менструации 2–4 мм, пролиферативная фаза 5–7 мм, овуляторная – 11 мм, секреторная – 16 мм, в постменопаузе ≤5 мм.
- RDW-CV: 11,0–15,0%.
Статистический анализ
Статистический анализ проводился с помощью программы SPSS версии 20. Для сравнения средних значений показателей использовали t-критерий Стьюдента для независимых групп. В качестве индекса величины эффекта применялся критерий δ-Гласса (Glass's delta). Статистически значимым считалось значение p<0,05.
Результаты
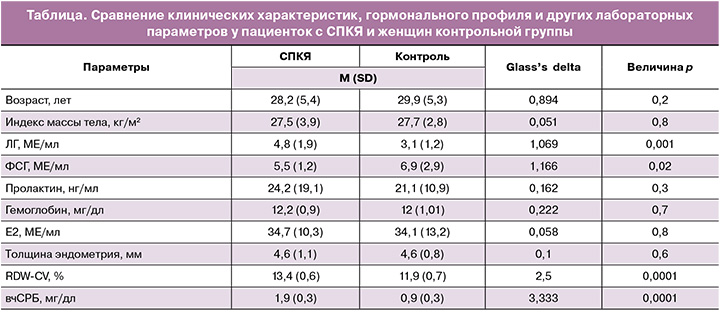
В данном исследовании приняли участие 100 женщин, включая 50 пациенток с СПКЯ и 50 здоровых женщин контрольной группы. Средний возраст больных с СПКЯ и женщин из контрольной группы составил 28,2 и 29,9 года соответственно. Средний (SD) индекс массы тела составил 27,5 (3,9) кг/м2 в группе СПКЯ и 27,7 (2,8) кг/м2 – у здоровых женщин. Значимые различия были обнаружены в уровне ЛГ, который составил 4,8 (1,9) МЕ/мл в группе СПКЯ и 3,1 (1,2) МЕ/мл – в контрольной группе (p=0,001), в то время как уровень ФСГ был значительно выше в контрольной группе [6,9 (2,9) МЕ/мл] и ниже у женщин с СПКЯ [5,5 (1,2) МЕ/мл (p=0,02)]. Не выявлено значимых различий между группами в уровнях пролактина (p=0,3), гемоглобина (p=0,7), E2 (p=0,6) и толщине эндометрия (p=0,6). Уровень RDW-CV был значительно выше у женщин с СПКЯ по сравнению с контрольной группой (13,4% против 11,9%). Уровень вчСРБ также был значительно выше у женщин с СПКЯ (1,9 мг/дл против 0,9 мг/дл) (p<0,0001) (таблица).
Обсуждение
Высокочувствительный С-реактивный белок давно используется как маркер воспаления [14]. Высокий уровень вчСРБ обнаруживается практически при любом воспалительном состоянии и может сигнализировать о повышенном риске развития всех дегенеративных заболеваний, таких как сердечно-сосудистые заболевания, рак и сахарный диабет [15]. В настоящем исследовании было установлено, что у женщин с СПКЯ уровень вчСРБ выше, чем у женщин без СПКЯ (p=0,0001). Высокие уровни вчСРБ могут объяснить, почему некоторые женщины с СПКЯ подвержены риску раннего развития сердечно-сосудистых заболеваний [16].
Verit F. (2010) провел исследование 52 пациенток с СПКЯ с нормальным уровнем инсулина и без метаболического синдрома и 48 здоровых женщин, которое показало, что у больных с СПКЯ повышен уровень вчСРБ (p<0,0001) и что вчСРБ положительно связан с индексом массы тела. Повышенный уровень вчСРБ был связан с факторами риска сердечно-сосудистых заболеваний при СПКЯ с нормальным уровнем инсулина и без метаболического синдрома. Автор рекомендовал этим пациентам более интенсивный скрининг и лечение СПКЯ [17].
Другое исследование, проведенное Ramanand S. et al., включало 30 здоровых женщин и 88 женщин с СПКЯ. Было обнаружено, что у индийских женщин с СПКЯ повышен уровень вчСРБ в сыворотке крови, что отражает ассоциацию с хроническим воспалением низкого уровня, и ожирение может усугублять эту ассоциацию. Положительная связь между вчСРБ и общим холестерином, а также липопротеином низкой плотности на фоне нормального липидного профиля свидетельствует о преобладании хронического воспаления над дислипидемией при СПКЯ [18]. Escobar-Morreale Н. et al. обнаружили, что у женщин с СПКЯ наблюдается повышение уровня циркулирующего вчСРБ, которое не зависит от ожирения. Эти данные подтверждают существующие молекулярные доказательства хронического воспаления низкого уровня, которое может лежать в основе патогенеза СПКЯ [19].
Кроме того, результаты исследования Javedani М. et al., измерявших вчСРБ у женщин с СПКЯ, показали более высокие уровни вчСРБ при СПКЯ, но различия не были статистически значимыми [20]. Кроме того, Oh J. et al. обнаружили, что СПКЯ сам по себе не коррелирует с повышенным уровнем вчСРБ, а на уровень вчСРБ при СПКЯ влияют факторы риска сердечно-сосудистых заболеваний, такие как индекс массы тела, артериальное давление и чувствительность к инсулину [21]. Iuhas C. et al. показали, что уровни вчСРБ повышены у пациентов с СПКЯ и коррелируют с ожирением, накоплением жира, а не с наличием СПКЯ как такового [22].
В настоящем исследовании было обнаружено, что RDW-CV значительно повышен у женщин с СПКЯ по сравнению с женщинами без СПКЯ (p<0,0001). RDW-CV является мерой изменчивости размеров циркулирующих эритроцитов. По сообщениям многих авторов, RDW-CV является сильным и независимым предиктором неблагоприятных исходов в популяции, и его увеличение также тесно связано с риском сердечно-сосудистой заболеваемости [23, 24].
Полученные результаты согласуются с результатами исследования Yilmaz Ö. et al., которые обнаружили, что уровень RDW-CV был выше у женщин с СПКЯ, и его высокий уровень был независимо связан с СПКЯ [25].
Zalawadiya S. et al. продемонстрировали, что RDW-CV обычно повышается при состояниях, связанных с повышенным разрушением эритроцитов (гемолитические анемии) или нарушением эритропоэза, например, при дефиците железа, фолиевой кислоты и витамина В12, а также при переливании крови. Кроме того, они подтвердили линейное увеличение RDW-CV с возрастом. Таким образом, увеличение RDW-CV может быть комплексной суррогатной мерой различных патофизиологических процессов (т.е. хронического воспаления, повышенного окислительного стресса, дефицита питательных веществ и старения), которые могут играть важную роль в этиологии и патогенезе неблагоприятных сердечно-сосудистых событий [26].
Заключение
У женщин с СПКЯ отмечается значительное повышение уровня вчСРБ и RDW-CV, что может быть индикатором риска развития сердечно-сосудистых заболеваний в будущем.



