Одной из важнейших проблем современного акушерства являются инфекционные осложнения послеродового периода, среди которых ведущее место занимает послеродовый эндометрит (ПЭ). ПЭ осложняет роды в 1–7% случаев и чаще возникает после кесарева сечения (до 27%) [1–4]. В большинстве случаев ПЭ развивается в первые 5 суток после родов [5]. Кроме того, ПЭ – наиболее частый диагноз при повторной госпитализации в послеродовом периоде: 1,8% при абдоминальном родоразрешении и 0,83% – при вагинальных родах [6]. Аспекты профилактики, ранней диагностики и прогноз заболевания остаются спорными и не до конца изученными. Многочисленные исследования посвящены изучению этиологии этого заболевания, предпринимаются попытки установить микробиологические предикторы ПЭ. В литературе дискутируется вопрос о прогностической значимости видового состава микрофлоры цервикального канала перед родами и в раннем пуэрперии для развития ПЭ [7].
Цель исследования: установить возможную взаимосвязь между выделением условно-патогенных микроорганизмов (УПМ) из цервикального канала родильниц и развитием ПЭ.
Материал и методы исследования
Обследованы 117 пациенток, поступивших для родоразрешения в ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России в период с 01.09.2012 по 30.08.2015. Родильницы разделены на две группы: I – пациентки с нормальным течением послеродового периода (n=59); II – пациентки с ПЭ (n=58). Диагноз «эндометрит» выставлен на основании международных критериев: повышение температуры тела выше 38°С, боли внизу живота, пастозность и болезненность матки при пальпации, изменение характера лохий. У всех женщин на 3-и сутки после родов взяты образцы отделяемого из цервикального канала для микробиологического исследования. Каждая группа разделена на подгруппы а – после самопроизвольных родов (Iа – n=37 и IIа – n=18) и б – после оперативного родоразрешения (Iб – n=22 и IIб – n=40). Через естественные родовые пути родоразрешены 55 пациенток, путем кесарева сечения – 62. При оперативном родоразрешении у 35 женщин I и 20 женщин II группы проведена антибиотикопрофилактика амоксициллин/клавуланатом или цефазолином. У 16 женщин с ПЭ проведено динамическое исследование микрофлоры цервикального канала в III триместре беременности и на 3-и сутки после родов и аспирата из матки на момент развития ПЭ. Отделяемое цервикального канала и аспират из матки засевали на стандартные питательные среды. Видовую идентификацию микроорганизмов проводили методом MALDI-TOF-MS с использованием времяпролетного масс-спектрометра AutoFlex III c программным обеспечением Maldi BioTyper (Bruker Daltoniks, Германия. Статистическая обработка проведена с применением пакета прикладных программ Statistica 7.0.
Результаты исследования
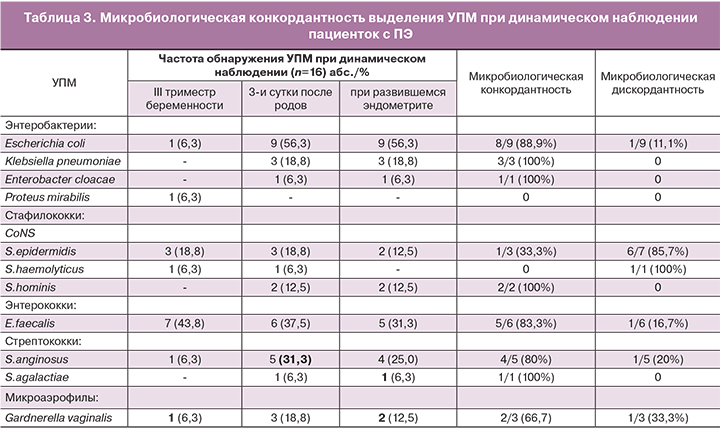
Средний возраст женщин составил 30,3±4,48 года. В группах сравнения не установлено статистически значимых отличий по соматической патологии. Привычное невынашивание беременности чаще встречалось в группах пациенток после кесарева сечения (особенно в Iб), что привело к расширению показаний для планового оперативного родоразрешения (р<0,05). В то же время в группе Iа, как и следовало ожидать, отмечалась достоверно низкая частота гинекологических заболеваний и оперативных вмешательств на органах малого таза. Во II группе было больше, чем в I, первородящих женщин (68,9 и 57,6% соответственно), чаще проводилось абдоминальное родоразрешение (68,9 против 37,3%) и антибиотикопрофилактика (60,3 и 33,9%).
Известно, что на течение послеродового периода влияют особенности беременности и родов. Сравнительная характеристика течения беременности и родов представлена в табл. 1.
Как показано в таблице, у женщин IIа группы достоверно чаще, чем у женщин Iа группы верифицированы инфекции мочевыводящих путей (р<0,05). В то же время не было статистически значимых различий в частоте других заболеваний инфекционного характера, а также проведения антибиотикотерапии у женщин всех групп (р>0,05). Отмечалось достоверно значимое увеличение продолжительности родов, длительности безводного периода у женщин II группы (р<0,05). Наличие родовых травм на развитие послеродовых осложнений значительно не влияло, но вхождение в полость матки посредством ручного обследования ее стенок, достоверно значимо повышало частоту развития эндометрита (р<0,05).
При скрининговом микробиологическом исследовании рост микроорганизмов в цервикальном канале выявлен у 94 (80,3%) родильниц. Идентификация УПМ позволила установить их принадлежность к 19 родам: Escherichia, Klebsiella, Enterobacter, Proteus, Morganella, Pseudomonas, Staphylococcus, Streptococcus, Enterococcus, Actinomyces, Corynebacterium, Alloscardavia, Рrevotella, Dialister, Peptostreptococcus, Peptoniphilus, Propionibacterium, Clostridium, Gardnerella и 32 видам. Все выделенные дрожжевые грибы отнесены к виду Candida albicans. Степень обсемененности отделяемого цервикального канала УПМ колебалась от 1 до 8 lg КОЕ/мл. Наиболее представленной была группа УПМ семейства Enterobacteriaceae (66/56,4%): Escherichia coli, Klebsiella pneumoniaе, Klebsiella oxytoca, Enterobacter cloacae, Enterobacter kobei, Proteus mirabilis, Morganella morganii c абсолютным преобладанием E.coli (53/45,3%). Второй по распространенности была группа УПМ семейства Streptococcaceae: виды рода Streptococcus – 44/37,6% с превалированием S.anginosus – 26/22,2% и S.agalactiae – 13/11,1%, а также рода Enterococcus – 41/35,0% (E.faecalis и E.raffinosus) с доминированием E.faecalis (38/32,5%). Реже выделяли стафилококки (Staphylococcus spp.) – 30/25,6% с преобладанием коагулазонегативных стафилококков (СoNS), облигатные анаэробы (16/13,7%) – Рrevotella bivia, Peptostreptococcus anaerobius, Dialister microaerophilus, Peptoniphilus harei, Propionibacterium acnes, Clostridium perfringens, Alloscardavia omnicolens, без значимого доминирования какого-либо вида (1/0,9 – 4/3,4%) и Gardnerella vaginalis – 12/10,3%. Таким образом, наиболее часто встречались E.coli (53/45,3%), E.faecalis (38/32,5%), S.anginosus (26/22,2%), S.agalactiae (13/11,1%) и G.vaginalis (12/10,3%).
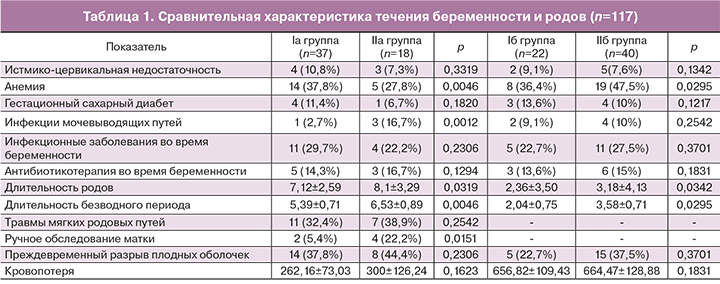
Всего выделено 222 штамма УПМ. Для установления возможной корреляции между видовым составом УПМ, выделенных при скрининговом исследовании, и развитием ПЭ проведен сравнительный межгрупповой анализ частоты выделения видов УПМ, степени обсемененности ими отделяемого цервикального канала, а также особенностей ассоциативного взаимодействия различных видов УПМ. Кроме того, изучены особенности видового состава лактобацилл в норме и при ПЭ. Так, энтеробактерии в I и II группах суммарно выделяли практически с одинаковой частотой – 55,9 и 56,9% соответственно. У пациенток с ПЭ видовой состав энтеробактерий был более разнообразным (6 видов), чем в норме (3 вида). Такие виды, как Klebsiella oxytoca (K.оxytoca), Enterobacter kobei (E.kobei), Proteus mirabilis (P.mirabilis), Morganella morganii (M. morganii) встречались только во II группе. В большинстве случаев в обеих группах энтеробактерии выделены в составе ассоциаций: 90,9 и 81,8% (I и II группы соответственно). В то же время монокультуры энтеробактерий у пациенток с ПЭ встречались в 2 раза чаще. Для оценки прогностической ценности степени обсемененности отделяемого цервикального канала отдельными видами УПМ мы сравнили частоту их выявления в низком титре (≤3lg КОЕ/мл), а также в умеренном или высоком (≥4lg КОЕ/мл) (табл. 2).
Из таблицы следует, что степень колонизации для энтеробактерий была одинаковой: 45,5% культур в обеих группах выделено в низком титре и 54,5% в умеренном или высоком. Среди энтеробактерий в обеих группах наиболее часто встречалась E.coli: у 27 (45,8%) и у 26 (44,8%) пациенток соответственно, преимущественно в составе ассоциаций (92,6 и 80,8% штаммов соответственно). В то же время в монокультуре при ПЭ этот микроорганизм выделяли в 2,5 раза чаще. Доля остальных видов энтеробактерий в обеих группах не превышала 7%, преимущественно в составе ассоциаций. Не отмечено достоверной разницы в частоте обнаружения энтерококков: 35,6 и 34,5% в I и II группах соответственно. Стрептококки у здоровых женщин суммарно выделяли чаще, чем у пациенток с ПЭ (45,8 и 29,3% соответственно) с повторением этой тенденции для основных видов – S.anginosus (21,7 и 17,2%) и S.agalactiae (15,2 и 6,9%). Все штаммы S.anginosus в обеих группах выделены в составе ассоциаций. S.agalactiae в I группе чаще высевали в ассоциации с другими УПМ (88,9%), а во II – 50% штаммов выделены в монокультуре. Облигатно-анаэробные УПМ суммарно в 2 раза чаще встречались при нормальном течении послеродового периода, но за счет представителя нормальной микрофлоры – Alloscardavia omnicolens и только в составе ассоциаций. Число штаммов, выделенных в титре ≥4lg КОЕ/мл, было выше в I группе (63,6% против 40,0%). G.vaginalis обнаружена у 11,9% пациенток I группы и у 8,6% II группы, преимущественно в высокой концентрации (соответственно 85,7 и 100,0%) и в составе ассоциаций (71,4 и 100,0%). Учитывая преимущественно ассоциированный рост УПМ, был проанализирован количественный и качественный состав. Рост микроорганизмов отсутствовал почти в 2 раза чаще у родильниц II группы (25,9%), в сравнении с I группой (13,6%). УПМ в I и II группах выявлена в 81,3 и 72,4% случаев соответственно. Монокультуры УПМ в I и II группах выделяли с одинаковой частотой: соответственно у 10 (16,9%) и 9 (15,5%) родильниц. Ассоциации УПМ обнаружены у 38 (64,4%) женщин в I и у 33 (56,9%) – во II группе (р>0,05).
Среди обследованных 117 женщин у 31 (26,5%) выделены лактобациллы. У здоровых родильниц лактобациллы выделяли в 2,8 раза чаще, а видовой состав был более разнообразным (7 видов в I группе и 4 – во II). Наиболее часто встречавшимися в составе микробиоты обеих групп были 4 вида: L. crispatus, L. jensenii, L. gasseri, и L. iners. У здоровых родильниц чаще встречались L. crispatus, L. jensenii, и L. iners.
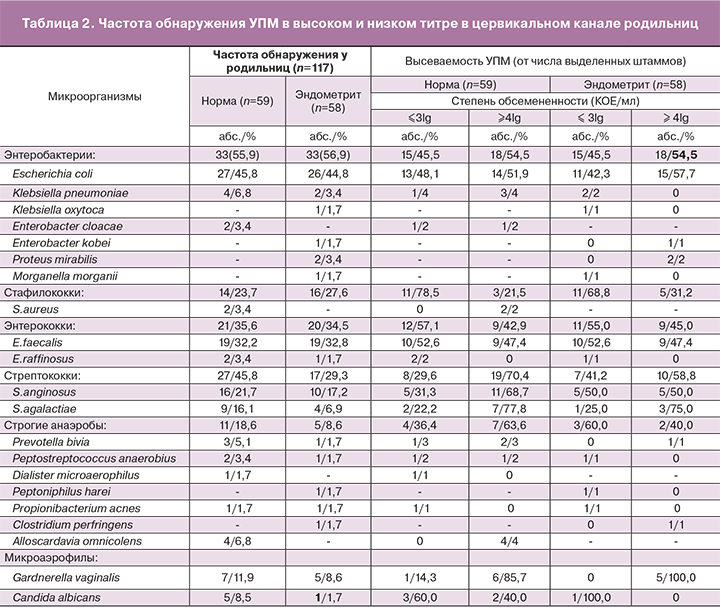
У 16 женщин, беременность которых осложнилась ПЭ, удалось проследить изменение микробного состава отделяемого цервикального канала в процессе динамического наблюдения: в III триместре беременности и на 3-и сутки после родов, а также метроаспирата на момент развития ПЭ (табл. 3).
В III триместре беременности наиболее часто выделяли E.faecalis (43,8%) и S.epidermidis (18,8%), остальные виды, в том числе и E.coli, встречались редко (по 6,3%). На третьи сутки после родов заметно выросла частота выявления энтеробактерий: E. coli (56,3%), K.pneumoniaе (18,8%), E.cloacae (6,3%), а также S.anginosus (31,3%) и G.vaginalis (18,8%). Стабильно высокой оставалась частота индикации E. faecalis (37,5%). В образцах метроаспирата преобладали E.coli (56,3%) и E.faecalis (31,3%). Анализ повторяемости отдельных видов в различные периоды наблюдения показал, что E.coli, наиболее часто выделяемая при ПЭ (у каждой второй женщины), в 8 из 9 случаев обнаружена повторно. Таким образом, микробиологическая конкордантность выделения из метроаспирата и из цервикального канала на 3-и сутки после родов для E.coli составила 88,9%. Что касается E.faecalis, встречавшегося при эндометрите у каждой третьей родильницы, то повторяемость его выделения у одних и тех же женщин отмечена в 5 из 6 случаев (83,3%), в том числе у 3 (50%) женщин – в течение всего наблюдения. Из 6 случаев выявления стрептококков микробиологическая конкордантность отмечена в 83,3% случаев, причем в одном случае S.anginosus высевался в течение всего наблюдения. G.vaginalis повторно выделена у 2 из 3 женщин (66,7%), в том числе у одной пациентки во все периоды динамического наблюдения. Напротив, максимальная микробиологическая дискордантность отмечена для СoNS: S. epidermidis (85,7%) и S.haemolyticus (100%). Суммарно частота совпадения этиологически значимых при ПЭ УПМ, выделенных из метроаспирата и цервикального канала на 3-и сутки после родов составила 81,2% (13/16). У каждой четвертой женщины идентичные УПМ обнаружены во все периоды наблюдения, начиная с III триместра беременности.
Обсуждение
Известно, что определяющим фактором в развитии ПЭ является восходящее инфицирование послеродовой матки УПМ, значительно реже реализуются гематогенный, лимфогенный и интраамниальный пути инфицирования. Послеродовым инфекциям половых путей часто сопутствуют инфицирование плаценты, травмы половых путей или эпизиотомия после вагинальных родов или раневая инфекция после кесарева сечения [3, 8]. Также микроорганизмы могут проникать в матку эндогенно при транслокации из естественных локусов их обитания: половых путей, кишечника или кожи или экзогенно при вагинальных инфекциях и нарушении асептики в процессе различных манипуляций [9]. Особое место занимает предрасположенность к инфекции половых путей в случае снижения уровня иммунной защиты макроорганизма, что способствует чрезмерной бактериальной колонизации родовых путей [3, 8, 10]. Анализ анамнестических данных, течения родов и послеродового периода в нашем исследовании показал, что группы сравнимы по значительному количеству параметров, однако достоверные различия касались существенного увеличения продолжительности родов, длительности безводного промежутка и частоты ручного обследования послеродовой матки у женщин II группы (р<0,05). Что касается инфекционной патологии во время беременности, то у женщин IIа группы достоверно чаще верифицированы инфекции мочевыводящих путей, чем у женщин Iа группы (р<0,05). В то же время не отмечалось статистически значимых различий в частоте других заболеваний инфекционного генеза, а также проведения антибиотикотерапии во время беременности у женщин сравниваемых групп (р>0,05).
Наиболее частыми возбудителями ПЭ бактериальной природы, по данным литературы, являются представители УПМ факультативно-анаэробного и облигатно-анаэробного происхождения: стрептококки групп A, B, D, энтерококки, стафилококки (S. аureus, S. еpidermis), пептострептококки, клостридии, E. coli, K. pneumoniae, виды Enterobacter и Proteus, Pseudomonas aeruginosa, Haemophilus influenzae, бактероиды, фузобактерии и G. vaginalis. Установлена роль генитальных микоплазм и абсолютных патогенов (Сhlamydia trachomatis, Neisseria gonorrhoeae) [2, 6]. Проведенное нами исследование показало, что цервикальный канал на 3-и сутки после родов у здоровых родильниц и родильниц с ПЭ, развившимся на 3–10-е сутки, колонизируют УПМ аналогичного видового спектра. Следовательно, выделенные микроорганизмы можно рассматривать, как потенциальные возбудители ПЭ. Цервикальный канал родильниц анатомически представляет входные ворота для колонизации раневой поверхности послеродовой матки микрофлорой нижних отделов гениталий: влагалища (преимущественно УПМ) и цервикса (УПМ и абсолютными патогенами, тропными к эпителию цервикального канала), а также экзогенными госпитальными патогенами при интравагинальных процедурах. Для прогностической оценки скринингового микробиологического исследования при ПЭ проведен сравнительный межгрупповой анализ видового состава микрофлоры цервикального канала в раннем послеродовом периоде, ассоциативных взаимоотношений в составе микробиоты и количественных характеристик отдельных ее составляющих.
Рост УПМ отсутствовал почти в 2 раза чаще у родильниц II группы (25,9%) в сравнении с I группой (13,6%), преимущественно за счет дефицита лактобацилл. Анализ частоты обнаружения и видового состава лактобацилл в группах сравнения показал, что у здоровых родильниц лактобациллы выделяли в 2,8 раза чаще, а видовой состав был более разнообразным. Наиболее часто в составе микробиоты обеих групп были 4 вида: L. crispatus, L. jensenii, L. gasseri, и L. iners. В литературе дискутируется вопрос о роли видового состава лактобацилл у здоровых женщин и при инфекционной патологии влагалища [11, 12]. Динамическое наблюдение за микробиотой влагалища в течение беременности показывает, что максимальная стабильность нормобиоты обеспечивается видами L. crispatus, L. jensenii и L.vaginalis [13, 14]. J.P. Ghartey и соавт. продемонстрировали, что максимальное сдерживание пролиферации E. coli у беременных наблюдается в случае колонизации влагалища L. crispatus [15]. Можно полагать, что более частое присутствие лактобацилл в цервикальном канале здоровых родильниц сдерживает процесс колонизации УПМ, а также блокирует пролиферацию УПМ при ассоциативной колонизации и таким образом препятствует развитию ПЭ. Кроме того, большая частота «стерильных» посевов у пациенток с ПЭ не исключает присутствия патогенов, индикация которых не проводилась в нашем исследовании, в частности генитальных микоплазм. В литературе имеются сообщения об их возможной этиологической роли при ПЭ в 3,2 – 19,4% случаев [4, 5]. Также следует принимать во внимание возможность эндогенного пути распространения инфекции на послеродовую матку, и в этом случае индикация истинного возбудителя на территории цервикального канала маловероятна. Установлено, что на 3-и сутки после родов у здоровых родильниц чаще, чем при ПЭ, выделяли УПМ, преимущественно в составе поликомпонентных ассоциаций, однако разница оказалась недостоверной (р>0,05). Следует отметить, что в сравниваемых группах абдоминальное родоразрешение проводили почти в два раза чаще во II группе (68,9 против 37,3%), соответственно чаще в этой группе проводили и антибиотикопрофилактику (60,3 и 33,9%). Это также может объяснять меньшую частоту «стерильных» посевов, большую частоту выделения УПМ и лактобацилл в группе здоровых родильниц. Отсутствие достоверных различий в характере микрофлоры в группах сравнения ставит под сомнение прогностическую значимость в развитии ПЭ скринингового микробиологического исследования микрофлоры цервикального канала на 3-и сутки после родов. Реализация инфекционного процесса определяется не только наличием микробного фактора. УПМ могут колонизировать полость матки в послеродовом периоде, но трансформация бактериальной колонизации в гнойно-воспалительный процесс определяется функциональным состоянием поверхностных тканей матки, состоянием локального иммунитета и иммунологической реактивностью макроорганизма [5], которые во многом связаны с генетической предрасположенностью и наличием факторов риска. В последние годы появилась возможность изучения эффекторов иммунной системы: экспрессии Toll-like рецепторов, природных антимикробных пептидов, присутствующих в эндометрии, в том числе β-дефензинов 1-4, ингибиторов секреторной лейкоцитарной протеазы, лактоферрина, лизоцима, играющих существенную роль в противостоянии микробной колонизации слизистой оболочки матки [16, 17]. В то же время обращает на себя внимание то, что такие виды УПМ, как K. oxytoca, E. kobei, P. mirabilis, M. morganii, часто ассоциируемые с нозокомиальными инфекциями, занимающими отдельную нишу в этиологии ПЭ [6], встречались только во II группе. Кроме того, монокультуры энтеробактерий у пациенток с эндометритом выделяли в 2 раза чаще. Во II группе 50% штаммов S. agalactiae, рассматриваемого как фактор риска послеродовых инфекционных осложнений [11], также выделены в монокультуре. Обращают на себя внимание анамнестические сведения о большей частоте мочевых инфекций в группе ПЭ, традиционно ассоциируемых с E. coli и K. pneumoniaе. Частое выявление этих видов в цервикальном канале у пациенток с ПЭ позволяет рассматривать бактериурию подобной этиологии как фактор инфекционного риска. Для подтверждения этого предположения целесообразно параллельное детальное изучение штаммов – возбудителей мочевых инфекций и ПЭ (генетической идентичности и факторов патогенности). Поэтому пациентам из группы риска инфекционных осложнений исследование микрофлоры цервикального канала во время беременности может быть весьма полезным. Подтверждением этого тезиса являются результаты динамического наблюдения за состоянием микробиоты влагалища в третьем триместре беременности, цервикального канала на 3-и сутки после родов и метроаспирата во время развившегося эндометрита 16 пациенток с верифицированным диагнозом ПЭ. Показано, что среди наиболее часто выделенных УПМ при развившемся эндометрите максимальная микробиологическая конкордантность отмечена для K.pneumoniae (100%), E.coli (88,9%), E.faecalis (83,3%). Учитывая, что E.faecalis перед родами выделяли у 43,8% женщин и микробиологическая конкордантность в послеродовом периоде составила 83,3%, по-видимому, присутствие этого микроорганизма в цервикальном канале перед родами также можно рассматривать как фактор риска развития ПЭ. Однако для подтверждения этого предположения требуются динамическое наблюдение на большей популяции женщин.
Выводы
- Отсутствие достоверных различий в характере микрофлоры (видовом составе УПМ, степени обсемененности и ассоциативных взаимоотношениях) в группах сравнения ставит под сомнение прогностическую значимость скринингового микробиологического исследования цервикального канала на 3-и сутки после родов.
- Достоверно значимое увеличение продолжительности родов, длительности безводного периода, инфекций мочевыводящих путей, более частое ручное обследование послеродовой матки у женщин с ПЭ являются факторами риска, предполагающими целесообразность проведения микробиологического скрининга.
- Микробиологическое исследование отделяемого цервикального канала в раннем послеродовом периоде целесообразно проводить избирательно, ориентируясь на пациенток с отягощенным акушерским анамнезом из группы риска инфекционных осложнений и пациенток со сниженными показателями иммунитета.
- Большая частота выделения лактобацилл в цервикальном канале здоровых родильниц, возможно, сдерживает процесс колонизации УПМ, а также блокирует их пролиферацию и таким образом препятствует развитию ПЭ. Это свидетельствует о необходимости своевременной коррекции вагинальной микрофлоры во время беременности.



