Наружный генитальный эндометриоз (НГЭ) представляет собой одну из наиболее актуальных проблем современной гинекологии. В структуре гинекологической патологии НГЭ занимает 3-е место и поражает до 50% женщин с сохраненной менструальной функцией [1–5]. НГЭ характеризуется дисменореей, диспареунией, хронической тазовой болью и бесплодием, нередко отрицательно влияя на психоэмоциональное состояние женщин, значительно снижая качество жизни [6, 7].
Выраженное негативное влияние НГЭ на качество жизни больных, их репродуктивную функцию, нарушение адаптации больных в обществе, растущие затраты на лечение определяют социальное значение заболевания и важность его изучения [8, 9].
Несмотря на многочисленные теории, описывающие патогенез эндометриоза, существует недостаток знаний о развитии заболевания в организме женщины [10–14]. Значительное внимание в настоящее время уделяется роли иммунной системы в развитии эндометриоза. У больных с генитальным эндометриозом наблюдаются существенные изменения как местных факторов иммунитета, так и иммунологических компонентов в циркулирующей крови [15, 16]. Имеются немногочисленные данные о роли интерлейкина (IL)-8 и полиморфизма его гена при НГЭ [17].
В этой связи целью исследования явилось изучение продукции IL-8 и полиморфизма 251T>A гена IL-8 у пациенток репродуктивного возраста с НГЭ.
Материалы и методы
Под наблюдением находились 71 пациентка с НГЭ, которые были распределены на две группы: 1-я группа – пациентки с I–II стадиями НГЭ (n=31); 2-я группа – пациентки с III–IV стадиями НГЭ (n=40).
В контрольную группу вошли 24 пациентки, проходившие обследование в отделении оперативной гинекологии НИИАП ФГБОУ ВО «РостГМУ» Минздрава России, которым была проведена диагностическая лапароскопия, исключившая диагноз НГЭ.
Критерии включения пациенток в исследование: репродуктивный возраст 18–49 лет, наличие жалоб на бесплодие и/или болевой синдром, индекс массы тела 18,5–25 кг/м2, нормальная температура тела, лапаро- и гистероскопия с морфологической верификацией диагноза НГЭ.
Критерии исключения из исследования: пубертатный и перименопаузальный возраст пациенток, злокачественные новообразования, тяжелая экстрагенитальная патология в стадии декомпенсации, острые инфекционные заболевания или обострение их хронических форм.
Определение содержания IL-8 в сыворотке крови и перитонеальной жидкости проводили методом иммуноферментного анализа c использованием наборов фирмы Bendermedsystems (Австрия).
Определение аллельных вариантов генов IL-8 проводили методом полимеразной цепной реакции с последующим рестрикционным анализом с помощью коммерческой тест-системы для молекулярно-генетического анализа, разработанной ГосНИИгенетика (Москва).
Статистический анализ
Для формирования базы данных и проведения статистического исследования использовали возможности табличного процессора Excel 2006 и пакетов прикладных программ («Мегастат» и Statistica 6.0). При определении обоснованности различия исследуемых групп применялся критерий Манна–Уитни с поправкой Бонферрони, при использовании которой традиционный уровень ошибки 1 типа делится на количество сравнений. Число пар сравнения рассчитывалось по формуле m=n(n–1)/2, где n – количество групп, поэтому критическая величина уровня значимости (р) в нашем исследовании равна 0,02. Данные представлены в виде медианы (Me) и квартилей Q1 и Q3. Определение статистически значимых различий между сравниваемыми группами по частотам генотипов и аллелей исследуемых генов производили с помощью критерия Фишера или χ2 по стандартной формуле.
Результаты и обсуждение
При выполненной лапароскопии частота эндометриоидных кист в нашем исследовании оказалась наиболее высокой и составила 66,2%, что подтверждает несвоевременность диагностики эндометриоза яичников. Поверхностные очаги эндометриоза на яичниках были обнаружены в 23,9% случаев. На брюшине малого таза эндометриоз был обнаружен: в 71,8% случаев – в прямокишечно-маточном углублении, в 57,7% – на крестцово-маточных связках, тогда как в пузырно-маточном пространстве – в 40,8% случаев.
При проведении гистероскопий гиперпластический процесс эндометрия имел место в одинаковом проценте случаев (70%) в обеих клинических группах с НГЭ и был гистологически подтвержден. В результатах морфологического исследования преобладала простая гиперплазия без атипии.
При гистологическом исследовании удаленных во время операции эндометриоидных гетеротопий было обнаружено, что частота выявления фиброза и склероза у пациенток 2-й группы (с III–IV стадией НГЭ) была статистически значимо выше, чем у пациенток 1-й группы (с I–II стадией НГЭ) – 28/40 (70%) против 4/31 (12,9%), р=0,01, что, по-видимому, является исходом воспалительного процесса. Также имеет значение статистически значимое увеличение частоты выявления таких показателей, как гемосидероз – 31/40 (77,5%) и ангиоматоз – 15/40 (37,5%) у пациенток с тяжелыми формами НГЭ (2-я группа) по сравнению с пациентками с I–II стадиями НГЭ (1-я группа) – 4/31 (12,9%) и 1/31 (3,2%) соответственно (p=0,01), что свидетельствует о прогрессировании заболевания.
Провоспалительные цитокины являются основными медиаторами и коммуникаторами иммунной системы, инициируют и усиливают воспалительные ответы на инфекцию или травму, способны рекрутировать иммунные клетки в места повреждения и стимулировать их к синтезу дополнительных цитокинов.
Дисрегуляция цитокинов может считаться важным аспектом патогенеза эндометриоза. Однако их роль в выживании эндометриоидных поражений остается недостаточно понятной. Частично это связано с тем, что эти модуляторы представляют собой плейотропные белки, которые обладают разнообразными функциями.
Важными факторами, участвующими в воспалении, связанном с эндометриозом, являются хемокины, в частности, IL-8. IL-8 индуцирует хемотаксис нейтрофилов и других иммунных клеток, а также является мощным ангиогенным агентом, принимает участие во всех процессах развития заболевания: адгезии, инвазии, имплантации эктопической ткани. Кроме того, IL-8 играет роль в росте и поддержании внематочной ткани эндометрия, напрямую влияя на пролиферацию клеток эндометрия. IL-8 может также защищать эктопические клетки от гибели в результате апоптоза [18, 19].
Результаты изучения медианных значений IL-8 в исследуемых группах представлены в таблице.
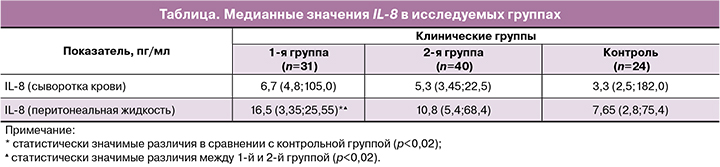
У женщин в 1-й группе (на ранних стадиях эндометриоза) по сравнению с контрольной и 2-й группами отмечается статистически значимое повышение содержания IL-8 в перитонеальной жидкости (р=0,01), причем показатели в 1-й группе превышали показатели во 2-й группе в 1,5 раза (р=0,01) (табл.). В сыворотке крови статистически значимых различий между группами выявлено не было.
Согласно современным представлениям, патогенез эндометриоза может быть связан с экспрессией воспалительных медиаторов, индукцией иммунного ответа, а уровень их экспрессии зависит от аллельного варианта гена в генотипе. Особое значение приобретает исследование генов, кодирующих сигнальные молекулы и обуславливающих согласованную работу различных систем и органов [20–22].
Поскольку IL-8 способствует пролиферации и адгезии клеток эндометрия и ангиогенезу, избыток этого цитокина может приводить к росту эндометриоидных очагов и локальной неоваскуляризации. В этой связи было интересно изучить зависимость риска развития эндометриоза от наличия полиморфизма в гене IL-8. Результаты изучения частоты полиморфизма 251T>A гена IL-8 у пациенток представлены на рисунке.
При исследовании распределения полиморфизма 251T>A гена IL-8 нами не было выявлено статистически значимых различий между пациентками 1-й и 2-й групп.
При анализе частоты генотипа Т/Т гена IL-8 выявлено, что в 1-й и 2-й группах по сравнению с контрольной группой он встречался статистически значимо чаще – в 9,3 и 10,7 раза соответственно, χ2=8,94 (р=0,01) и χ2= 8,94 (р=0,01).
При исследовании полиморфизма 251T>A установлено, что у пациенток с НГЭ частота аллеля А была статистически значимо ниже, а аллеля Т – выше, чем в контрольной группе (χ2=7,52 при р=0,007, OШ=2,9 (95% ДИ 1,35;6,5) и χ2=15,23 при p=0,01, OШ=4,4 (95% ДИ 2,05;9,45) соответственно) (рис. 1).

НГЭ является одним из наиболее распространенных гинекологических заболеваний, поражающих женщин репродуктивного возраста, связан с повышением уровня провоспалительных цитокинов в перитонеальной среде.
Мы обнаружили, что уровень IL-8 повышается в перитонеальной жидкости женщин, преимущественно с I–II cтадией эндометриоза. Наши результаты указывают на локальную дисрегуляцию IL-8 на ранних стадиях эндометриоза. Повышение уровня IL-8 может приводить к развитию пролиферации эндотелиальных клеток, ингибированию процессов апоптоза [23]. IL-8 может выступать в качестве аутокринного фактора роста в эндометрии и способствует порочному кругу прикрепления клеток эндометрия, что может привести к трансформации из острой стадии воспаления в хроническую. Полученные данные указывают на решающее участие IL-8 в формировании эндометриоидных поражений. Поскольку IL-8 способствует пролиферации и адгезии клеток эндометрия и ангиогенезу, избыток этих цитокинов может способствовать росту и локальной неоваскуляризации. Мы предположили, что полиморфизм гена IL-8, ассоциированный с повышенной продукцией этого цитокина, может играть роль в росте и поддержании эктопической ткани эндометрия, детерминируя более выраженную воспалительную реакцию.
Полученные данные показывают, что распределение аллельных вариантов генов IL-8 среди пациенток с различными стадиями НГЭ характеризуется преобладанием генотипов T/T полиморфизма 251T>A. Таким образом, выявление носительства полиморфизма 251T>A гена IL-8 может служить маркером повышенного риска развития эндометриоза у пациенток репродуктивного возраста.
Заключение
Повышение уровня IL-8 в перитонеальной жидкости, наличие полиморфного маркера 251T>A гена IL-8 ассоциировано с риском развития НГЭ у пациенток репродуктивного возраста.



