В настоящее время одним из основных и наиболее эффективных методов лечения бесплодия является экстракорпоральное оплодотворение (ЭКО). Несмотря на усовершенствование эмбрионального этапа программы ЭКО, позволяющего выбрать для переноса в полость матки эмбрионы высокого качества, результативность ЭКО остается достаточно низкой [1, 2]. Очевидно, что невысокая эффективность программ ЭКО связана, в основном, не с нарушением взаимодействия гамет, а с потерями на этапе имплантации эмбриона [3].
Полноценная имплантация и последующее развитие плода обеспечиваются за счет динамического равновесия экспрессии различных генов в эндометрии под контролем не только стероидных гормонов, но и различных биологически активных молекул, в том числе и иммунных факторов [4]. Присутствие в семенной плазме (СП) широкого спектра иммуномодулирующих молекул придает ей уникальные свойства и свидетельствует о потенциальной роли СП в регуляции репродуктивной функции [5].
Успешное применение вспомогательных репродуктивных технологий (ВРТ) свидетельствует о том, что контакт женского репродуктивного тракта с СП не является обязательным условием наступления беременности. Однако в многочисленных экспериментах продемонстрировано, что содержащиеся в СП биологически активные молекулы участвуют в формировании оптимального иммунологического фона, необходимого для успешной имплантации и обеспечения иммунной толерантности матери к отцовским антигенам [6].
Таким образом, накопленный опыт позволяет рассматривать применение СП с целью локальной физиологической стимуляции женского репродуктивного тракта в цикле ЭКО/ИКСИ как обоснованный и эффективный подход повышения эффективности лечения бесплодия [7].
Однако имеющиеся литературные данные о влиянии аппликации СП на эффективность программ ЭКО носят противоречивый характер. В то время, как некоторые исследователи не находят положительного влияния введения СП партнера [8], другие подтверждают благоприятный эффект аппликации СП на исходы циклов ВРТ [9–11].
Известно, что СП представляет собой сложную смесь цитокинов и других биологически активных молекул, следовательно, влияние СП на рецептивность эндометрия может определяться уровнем содержания различных иммуномодулирующих факторов [12, 13]. Цитокины продуцируются различными типами клеток мужского репродуктивного тракта, в частности клетками Лейдига и Сертоли, тестикулярными лейкоцитами, а также клетками предстательной железы и семенных пузырьков [14]. Основным фактором, определяющим абсолютное содержание цитокинов в СП, является длительность воздержания [14].
Одним из наиболее значимых факторов СП является трансформирующий фактор роста β1 (TGF-β1), который играет важную роль в формировании иммунной толерантности матери к антигенам плода [15]. TGF‑β синтезируется клетками добавочных мужских половых желез – простаты и семенных пузырьков [16].
В научных публикациях имеются сообщения о разнонаправленности действия некоторых цитокинов при иммунорегуляции. Одним из таких цитокинов, обладающим антагонистическим действием в отношении TGF‑β1, является присутствующий в СП интерлейкин 18 (IL‑18), провоспалительный цитокин, первоначально идентифицированный, как интерферон-γ – индуцирующий фактор [17–20]. Было установлено, что присутствие IL-18 в маточных смывах связано со снижением вероятности имплантации [21].
Недавно было высказано предположение о том, что СП может оказывать не только позитивное влияние на репродуктивную функцию женщин, но и в ряде случаев, приводить к нарушениям имплантации [22].
Таким образом, нельзя исключить, что характер влияния СП на репродуктивную функцию женщин может определяться цитокиновым профилем СП. Исследования, посвященные изучению взаимосвязи цитокинового профиля СП и исходов программы ЭКО, отсутствуют. Поэтому целью настоящего исследования явилось изучение зависимости эффективности программы ЭКО/ИКСИ с применением аппликации СП партнера от содержания цитокинов TGF‑β1 и IL‑18 в семенной плазме.
Материал и методы исследования
В исследование были включены супружеские пары, обратившиеся в отделение вспомогательных технологий в лечении бесплодия ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России (n=71). Все пациентки, соответствующие критериям включения, предоставили письменное информированное согласие.
Критериями включения пар в исследование явились: трубный фактор бесплодия, возраст пациентки не более 40 лет, нормальный овариальный резерв, не более 2 предшествующих безуспешных циклов ЭКО, нормальное анатомическое строение матки, отсутствие системных аутоиммунных заболеваний. Критериями не включения были наружный и внутренний эндометриоз III и IV стадии, миома матки больших размеров, патозооспермия III–IV степени, злокачественные новообразования любой локализации, пороки развития внутренних половых органов.
Для стимуляции функции яичников был использован стандартный протокол с рекомбинантным фолликулостимулирующим гормоном и антагонистами гонадотропин-рилизинг-гормона (ГнРГ). При проведении стандартной программы ЭКО всем пациенткам в день трансвагинальной пункции яичников вводили СП супруга в объёме 0,5 мл в задний свод влагалища. С целью получения СП часть эякулята супруга, полученного в день трансвагинальной пункции яичников, подвергали центрифугированию при оборотах 18 000g в течение 10 минут. Супернатант в объеме 0,5 мл вводили в задний свод влагалища сразу после забора ооцитов, оставшуюся часть СП замораживали. Беременность определялась как возрастание уровня β-субъединицы хорионического гонадотропина в сыворотке крови более 100 МЕ/л на 14-й день после переноса эмбриона с последующей визуализацией плодного яйца при вагинальном ультразвуковом исследовании на 21-й день после переноса эмбриона.
Концентрацию цитокинов TGF-β1 и IL-18 в СП оценивали с помощью проточной цитофлуорометрии и флуоресцентных микросфер, используя коммерческие наборы Human TGF- β1 FlowCytomix Simplex Kit и Human IL-18 FlowCytomix Simplex Kit (Bender MedSystems, Австрия) и проточный цитофлуориметр FACSCalibur (Becton Dickinson, США). Концентрации TGF‑β1 (сумма свободного и латентного TGF-β1, нг/мл) и IL-18 (пг/мл) в каждом образце были вычислены с помощью специального программного обеспечения FlowCytomix Pro 3.0 Software, (Bender MedSystems, Austria).
Были определены следующие показатели: концентрация цитокинов TGF-β1 и IL-18, общее содержание TGF-β1 и IL-18 в эякуляте (концентрация TGF-β1 и IL-18 × объем эякулята) и соотношение концентраций TGF-β1/IL-18 (TGF-β1/IL-18 коэффициент).
Статистическая обработка результатов проводилась с использованием пакета прикладных программ Microsoft и MedCalc. При характеристике выборок, удовлетворяющих критериям нормального распределения, использовали среднее значение и стандартное отклонение. Для выборок, не удовлетворяющих критериям нормального распределения, использовали значение медианы и указывали максимальное и минимальное значение соответствующих показателей. Для определения достоверности различия значений в двух независимых выборках использовали непараметрический критерий Манна–Уитни.
Результаты исследования
В результате лечения бесплодия методом ЭКО с использованием аппликации СП в репродуктивный тракт женщины беременность наступила у 45,1% пациенток. В соответствии с результатами лечения бесплодия были сформированы две группы: 1-я группа – пациентки с успешным исходом лечения (n=32), 2-я группа – пациентки с отрицательным результатом лечения (n=39).
При оценке клинико-анамнестических данных, параметров фолликулогенеза, оогенеза и раннего эмбриогенеза у пациенток исследуемых групп статистически значимых отличий выявлено не было, группы были однородны и сопоставимы по анализируемым параметрам (таблица). Статистически значимых различий по основным параметрам спермограммы половых партнеров пациенток не выявлено.
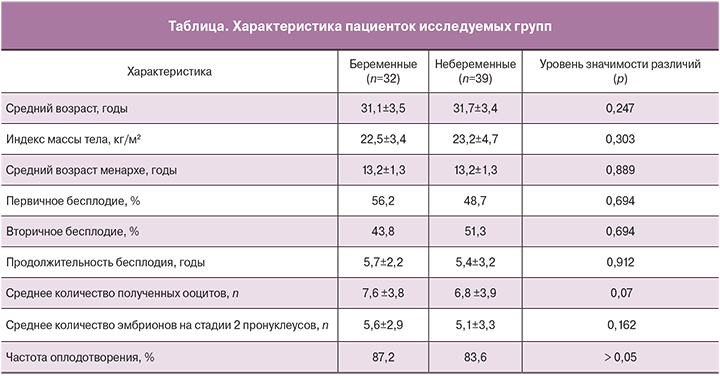
Установлено, что концентрация TGF-β1 в СП партнеров пациенток с успешным и неуспешным исходами программы ЭКО не различалась (р=0,796, рис. 1А). Концентрация IL-18 в СП половых партнеров у пациенток с наступившей беременностью была значимо ниже по сравнению с аналогичными показателями в группе женщин с неуспешным исходом лечения и составила 313,6±131,8 и 387,5±1215,0 пг/мл соответственно (р=0,018, рис. 1Б). В то же время, соотношение TGF-β1/IL-18 в группе пациенток с успешным исходом лечения было значимо выше по сравнению с аналогичным показателем в группе женщин с неудачной попыткой ЭКО и составило 470±228 и 363±146 соответственно (р=0,02, рис. 1Д).
 При оценке уровня цитокинов TGF-β1 и IL-18 во всем объеме СП, полученном при эякуляции, было установлено, что содержание как IL-18, так и TGF-β1 у партнеров пациенток с успешным исходом лечения было значимо ниже по сравнению с аналогичным показателем у партнеров женщин с отрицательным результатом лечения (р=0,0001; р=0,04 соответственно, рис. 1В,Г).
При оценке уровня цитокинов TGF-β1 и IL-18 во всем объеме СП, полученном при эякуляции, было установлено, что содержание как IL-18, так и TGF-β1 у партнеров пациенток с успешным исходом лечения было значимо ниже по сравнению с аналогичным показателем у партнеров женщин с отрицательным результатом лечения (р=0,0001; р=0,04 соответственно, рис. 1В,Г).
Была выявлена значимая положительная корреляционная связь между общим содержанием TGF-β1 и IL-18 в эякуляте половых партнеров пациенток с наступившей беременностью (r=0,448; p=0,010) и женщин с неудачным исходом лечения (r=0,679; p<0,0001).
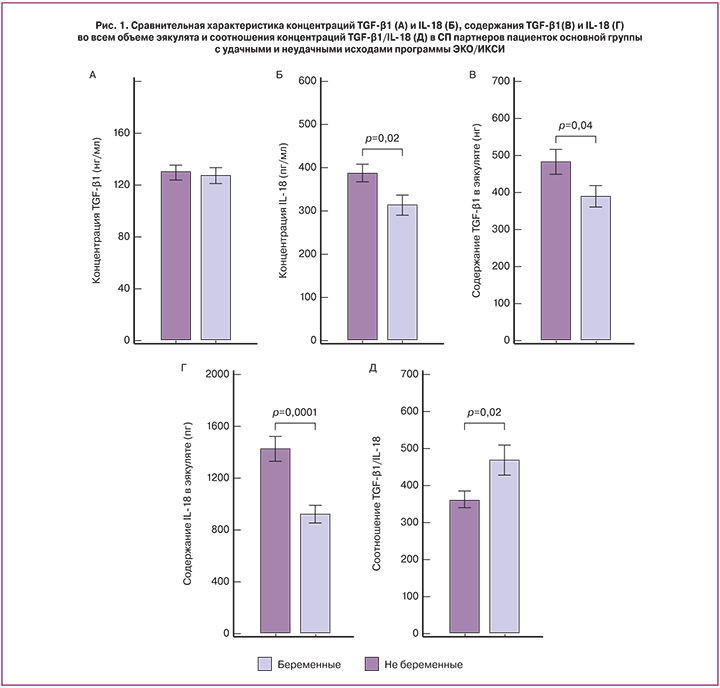
Для оценки клинической значимости определения уровня исследованных цитокинов в СП полового партнера с целью прогнозирования исходов программы ЭКО/ИКСИ, был проведен анализ полученных результатов с помощью построения характеристических кривых (Receiver Operating Characteristics – ROC) (рис. 2).
Согласно полученным данным, содержание IL-18, концентрация IL-18, соотношение TGF-β1/IL-18 и содержание TGF-β1 в эякуляте являются значимыми предикторами успеха исходов лечения бесплодия методом ЭКО/ИКСИ.
Наиболее значимым прогностическим критерием исхода лечения бесплодия методом ЭКО с применением аппликации СП явилось содержание IL-18 во всем объеме СП. Площадь под характеристической кривой составила 0,749, чувствительность и специфичность теста составили 0,94 и 0,51 соответственно. У пациенток, эякулят партнеров которых содержал относительно низкое количество IL-18 (<1432,4 пг), вероятность наступления беременности была в 6,7 раза выше по сравнению с пациентками, в СП половых партнеров которых отмечался относительно высокий уровень IL-18 (>1432,4 пг) и составляла 61,2 и 9,1% соответственно.
Обсуждение
В представленной работе впервые показана ассоциация между уровнем цитокинов в СП половых партнеров и репродуктивным успехом у пациенток, проходивших лечение методом ЭКО/ИКСИ с применением аппликации СП в день трансвагинальной пункции яичников. У пациенток с успешным исходом лечения концентрация IL-18 в СП партнера была значимо ниже по сравнению с аналогичным показателем половых партнеров женщин, у которых беременность не наступила. Таким образом, высокий уровень IL-18 ассоциирован с неблагоприятным исходом лечения. Эти данные согласуются с результатами предыдущих исследований, которые продемонстрировали, что, несмотря на важную роль IL-18 в процессе ангиогенеза в эндометрии, необходимого для успешной имплантации, повышенный уровень данного цитокина в смывах из полости матки может стать причиной нарушения процесса имплантации [21].
Раннее было показано, что повышенный уровень IL-18 в сперме связан с урогенитальной инфекцией и патозооспермией [19, 20]. Известно, что лейкоцитоспермия является неспецифическим лабораторным маркером латентного воспалительного процесса в мужском урогенитальном тракте. Однако в данном исследовании статистически значимых различий между основными параметрами спермы в исследуемых группах выявлено не было, при этом лейкоцитоспермия являлась критерием исключения. Кроме того, концентрации IL-18 в СП половых партнеров пациенток с успешным исходом лечения и женщин с неудачной попыткой ЭКО, совпадали с аналогичными показателями в СП фертильных мужчин, приведенных в ряде предыдущих исследований [19, 20].
Следовательно, маловероятно, что повышенный уровень IL-18 в СП партнеров в группе женщин с отрицательным результатом лечения отражал наличие скрытой урогенитальной инфекции у половых партнеров пациенток.
Концентрации TGF-β1 в СП партнеров пациенток с успешным и неудачным исходами программ ЭКО не различались. На первый взгляд, результаты представленной работы противоречат современным представлениям о ведущей роли TGF-β1 в СП, как фактора, обеспечивающего эффективность имплантации. Полученные данные о высоких значениях соотношения TGF-β1/IL-18 у пациенток с успешным исходом лечения по сравнению с аналогичным показателем в группе женщин с неудачной попыткой ЭКО свидетельствуют о значимости TGF-β1 в репродуктивном процессе. Однако, влияние данного цитокина на исходы программы ЭКО/ИКСИ зависит от присутствия IL-18 и реализуется в том случае, если концентрация TGF-β1 существенно (более чем в 454 раза, согласно данным ROC анализа) превышает концентрацию IL-18.
В представленной работе продемонстрировано, что эффективность репродуктивных технологий зависит от общего уровня цитокинов во всем объёме эякулята. Ранее было показано, что половая жизнь в перитрансферный период при проведении программы ЭКО благоприятно влияет на результаты лечения [23]. Возможно, что воздействие СП на исходы программы ЭКО может реализовываться не только при применении аппликации СП в день трансвагинальной пункции яичников, но и при поступлении СП в репродуктивный тракт женщины при предшествующих сексуальных отношениях с биологическим отцом в цикле ЭКО.
Среди различных механизмов, которые могли бы объяснить доставку компонентов СП к эндометрию после полового контакта или аппликации СП, ключевую роль, вероятно, играет система противоточного обмена между венами влагалища и артериями матки [24]. Возможно, именно этот способ доставки цитокинов СП в верхние отделы репродуктивного тракта предполагает абсорбцию данных молекул во влагалище и, благодаря обмену между венозными сосудами влагалища и артериальными сосудами матки, передачу цитокинов, в частности, IL-18 и TGF-β1, интенсивность которой пропорциональна общему содержанию этих цитокинов в эякуляте.
В представленной работе продемонстрировано, что количественное определение цитокинов СП, поступающей в женские половые пути, имеет клиническое значение для прогнозирования вероятности наступления беременности.
Заключение
Таким образом, эффективность реализации репродуктивной функции женщин в программе ЭКО с применением аппликации СП в день трансвагинальной пункции яичников зависит от индивидуальных иммуномодулирующих свойств СП полового партнера. Выявленные взаимосвязи между исходами программы ЭКО с применением аппликации СП и иммуномодулирующими свойствами СП половых партнеров пациенток свидетельствуют о целесообразности персонифицированного назначения аппликации СП партнера в программе ЭКО/ИКСИ.
Изучение роли иммунных факторов СП при имплантации и дальнейшем развитии беременности может явиться основой для разработки новых терапевтических методов повышения эффективности лечения бесплодия методом ЭКО.



