Миома матки и гиперплазия эндометрия являются актуальной проблемой современной гинекологии [1, 2]. Данные заболевания встречаются у женщин всех возрастных групп [1, 3]. У женщин репродуктивного возраста миома матки регистрируется с частотой 25%, гиперплазия эндометрия – от 10 до 50% [1–5]. Сочетание миомы матки с гиперплазией эндометрия регистрируется у 30–35% пациенток репродуктивного возраста, в период менопаузы – у 72,7–100% [6]. В медицине проблема пролиферативных заболеваний матки имеет большое медико-социальное значение, что обусловлено сложностью лечения, нарушением репродукции, тяжелыми последствиями для пациенток, возможностью формирования злокачественных опухолей эндометрия [7, 8], повторными рецидивами заболевания.
До сих пор не существует единого мнения о механизмах развития пролиферативных заболеваний матки [5, 9]. Достижения молекулярной генетики доказали роль генетических факторов в развитии данных заболеваний [10, 11]. Важную роль в развитии пролиферативных заболеваний матки играют гены факторов роста. Вследствие воспалительных процессов зачаток миомы матки инфильтрируется макрофагами, выделяющими факторы некроза опухоли, интерлейкины [12]. Эти вещества изменяют экспрессию гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ), что стимулирует гиперпродукцию трансформирующего фактора роста (TGF)-β клетками опухоли. TGF-β может повышать эффекторную активность ГМ-КСФ. Воздействием на фибробласты TGF-β стимулирует экспрессию в них фактора роста, вызывающего выработку экстрацеллюлярного матрикса (СТGF). Фибробласты под влиянием TGF-β становятся миофибробластами, участвующими в образовании компонентов соединительной ткани. Фактор некроза опухоли (TNF)-α, синтезируемый макрофагами, конкурентным путем может блокировать сигнальный путь между ТGF-β и СТGF, так как место связывания ТNF-α и ТGF-β с промотором СТGF общее [13, 14].
Цель исследования: изучить ассоциации полиморфных вариантов генов факторов роста с развитием сочетания миомы матки и гиперплазии эндометрия.
Материалы и методы
В исследование включены женщины с сочетанием миомы матки и гиперплазии эндометрия (n=193) и женщины контрольной группы (n=789), являющиеся русскими жительницами Центрального Черноземного региона России, не имеющие родства [15]. Исследуемые выборки формировались в отделении гинекологии ОГБУЗ БОКБ Святителя Иоасафа. Критерием включения в группу больных являлось наличие сочетания миомы матки и гиперплазии эндометрия, верифицированных эхографическими и гистероскопическими методами. Диагноз подтверждался морфологически. Контрольная группа формировалась из здоровых женщин, проходивших плановую диспансеризацию в отделении Перинатального центра. Каждая женщина дала письменное разрешение на проведение исследования.
Для молекулярно-генетического тестирования использовали геномную ДНК, выделенную стандартным методом фенольно-хлороформной экстракции из лейкоцитов периферической крови. Пациенткам с сочетанием миомы матки и гиперплазии эндометрия и в группе контроля проводилось генотипирование 5 полиморфных локусов генов факторов роста: EGF c.-382А>G rs4444903 (эпидермальный фактор роста), ТGFβ-1 c.-1347Т>С rs1800469 (трансформирующий фактор роста β-1), IGF1 c.*2716G>А rs6214 (инсулиноподобный фактор роста 1), VЕGF c.-958С>Т rs833061 (фактор роста эндотелия сосудов), FGFR2 c.109+906Т>С rs2981582 (рецептор фактора роста фибробластов). Выбор этих SNP для исследования обусловлен (согласно [16]) их значимым регуляторным потенциалом.
Исследование полиморфных локусов генов факторов роста осуществлялось методом полимеразной цепной реакции с использованием олигонуклеотидных праймеров и зондов, синтезированных ООО «Синтол» (Russian).
Статистический анализ
Изучены частоты аллелей и генотипов в сравниваемых группах. Их анализ в исследуемых группах больных и контроля проводили в таблицах сопряженности 2×2 с применением критерия χ2. Ассоциации аллельных вариантов с развитием заболевания оценивали с помощью показателя отношения шансов (ОШ) и его 95% доверительного интервала (ДИ). Статистическую обработку полученных данных проводили в программе STATISTICA for Windows 10.0.
Проведено изучение связи комбинаций генетических вариантов (аллели и генотипы) рассматриваемых локусов с развитием сочетанной патологии с использованием программы АРSampler (https://sourceforge.net/projects/apsampler/), применяющей метод Монте-Карло–Марковских цепей и байесовскую непараметрическую статистику [17, 18]. За статистически значимый принимали уровень pperm<0,05.
Влияние полиморфизмов на экспрессию генов изучали с использованием базы данных программы GTExportal (https://www.gtexportal.org/). В работу включались материалы с p<8×10-5, FDR≤0,05. Влияние аллеля на изменение экспрессии генов определяли по критерию β [10]. Регуляторные эффекты полиморфных локусов выявляли по данным программы SNPinfo (https:// npinfo.niehs.nih.gov/).
Результаты и обсуждение
Данные о частотах аллелей и генотипов в исследуемых выборках представлены в таблицах 1 и 2. Распределение частот аллелей и генотипов всех генов соответствует равновесию Харди–Вайнберга.

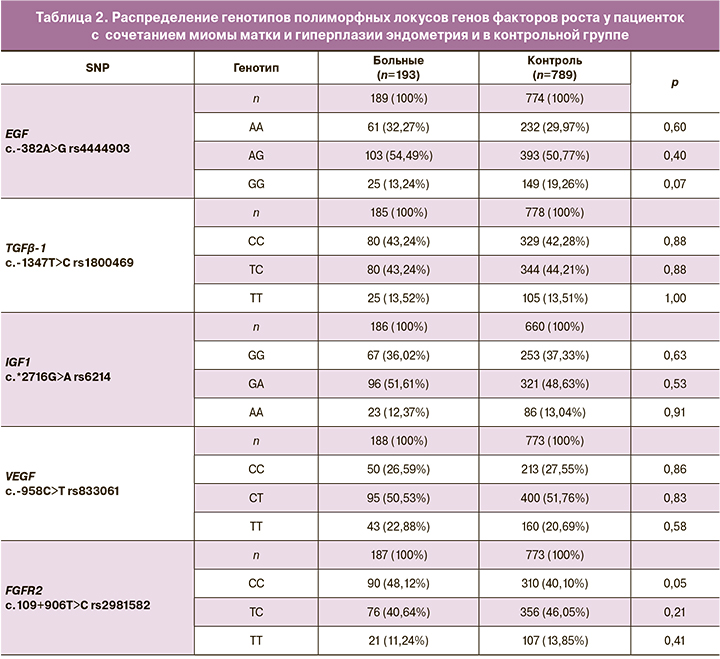
Анализ распределения частот аллелей и генотипов изучаемых полиморфных маркеров генов факторов роста в исследуемых группах показал, что у женщин с сочетанием миомы матки и гиперплазии эндометрия генотип СС rs2981582 FGFR2 встречается с частотой 48,12%, что выше аналогичного показателя в контрольной группе, где частота данного генотипа составляет 40,11% (ОШ=1,38; 95% ДИ 0,99–1,93; p=0,05; pperm=0,05).
По другим исследуемым полиморфизмам генов факторов роста в исследуемой выборке больных достоверных различий в распространенности аллелей и генотипов не обнаружено (p>0,05).
Установлено, что сочетание генетических вариантов G rs4444903 EGF, С rs1800469 ТGFβ-1, G rs6214 IGF1 и Т rs2981582 FGFR2 в группе больных (22,85%) и в контрольной группе (33,07%) имеет статистически значимые различия. Такая комбинация аллелей выступает протективным фактором развития сочетания миомы матки и гиперплазии эндометрия (ОШ=0,59; 95% ДИ 0,40–0,88; р=0,005; pperm=0,08).
Выявлено, что сочетание аллелей А гена rs4444903 EGF и С гена rs1800469 ТGFβ-1 наблюдается у 77,91% женщин с сочетанием миомы матки и гиперплазии эндометрия, что достоверно выше аналогичного показателя контрольной группы – 70,06%. Такая комбинация аллелей служит фактором риска развития миомы матки в сочетании с гиперплазией эндометрия (ОШ=1,50; 95% ДИ 1,02–2,21; р=0,02; pperm=0,03).
Ген FGFR2, по данным литературы, обеспечивает регуляцию клеточной пролиферации, дифференцировки, миграции клеток [19]. Генетический полиморфизм rs2981582 FGFR2, по данным литературы, имеет ассоциации с развитием рака молочной железы [20] и поджелудочной железы [19].
При помощи онлайн-программы GTExportal (http://www.gtexportal.org/) установлено, что 3 изученных полиморфизма значимо ассоциированы (p<8×10-5; FDR≤0,05) с уровнем экспрессии mRNA (cis-eQTL) 8 различных генов в разных тканях и органах.
Установлено, что полиморфный вариант A rs4444903 гена EGF ассоциирован с повышенной экспрессией гена EGF в гипофизе (β=0,65; р=1,8e-22; FDR≤0,05), скелетной мускулатуре (β=0,11; р=0,000046; FDR≤0,05), клетках культивированных фибробластов (β=0,20; р=0,000051; FDR≤0,05) (рисунок).

Полиморфный вариант A гена rs4444903 EGF ассоциирован с низким уровнем экспрессии гена GAR1 в базальных ганглиях головного мозга (β=-0,27; р=0,000018; FDR≤0,05).
Полиморфизм rs1800469 гена TGFb1 ассоциирован с низкой экспрессией гена B9D2 в культивированных клетках фибробластов (β=-0,15; р=0,000021; FDR≤0,05), снижает уровень экспрессии гена EXOSC5 в сердечной ткани (β=-0,23; р=1,4e-9; FDR≤0,05), скелетной мускулатуре (β=-0,11; р=5,5e-8; FDR≤0,05), и гена TMEM91 в культивированных клетках фибробластов (β=-0,092; р=0,0000027; FDR≤0,05).
Полиморфный вариант С rs833061 гена VEGFА ассоциирован с высоким уровнем экспрессии гена VEGFA в ткани щитовидной железы (β=0,11; р=0,00015; FDR≤0,05).
Данные базы GTExportal свидетельствуют о значимом регуляторном потенциале изучаемых полиморфизмов.
Полиморфный локус rs4444903 гена EGF расположен в регионе энхансера экзонного сплайсинга (ESE) серин-аргинин-насыщенного протеина (spr55) (score=3,78) и в регионе энхансера экзонного сплайсинга серин-аргининового фактора сплайсинга (SC35) (score=2,94). Аллель А rs4444903 гена EGF является сайтом связывания транскрипционных факторов АР4_01 (Core Match Score=1), CACD_01 (Core Match Score=0,850), CEBP_Q3 (Core Match Score=0,986), DSP_Q6 01 (Core Match Score=0,914), FAC1_01 (Core Match Score=0,808) и др. Регуляторный потенциал A rs4444903 гена EGF равен 0,12.
Регуляторный потенциал (RegPotential), согласно базе данных SNPinfo локуса rs1800469, равен 0,22. Аллель А гена rs1800469 ТGFβ-1 является сайтом связывания транскрипционных факторов AIRE_02 (Core Match Score=0,648), AP4_01 (Core Match Score=0,778), AREB6_02 (Core Match Score=1,0), SARNT_01 (Core Match Score=0,792) и др.
Полиморфизм С rs6214 гена IGF1 является сайтом связывания микро-РНК has-miR-542-3p (score=140) и has-miR-570 (score=140).
Регуляторный потенциал гена VEGF c.-958С>Т rs833061 (RegPotencial) равен 0,215. Аллель С гена rs833061 VEGF является сайтом связывания транскрипционных факторов AP2_Q6 (Core Match Score=0,953), ATF6_01 (Core Match Score=0,8), BRCA_01 (Core Match Score=0,994).
Ген ТGFβ-1 играет важную роль в регуляции процессов клеточной пролиферации, дифференцировки, миграции клеток [21, 22]; с этим может быть связано его влияние на развитие миомы матки в сочетании с гиперплазией эндометрия. Согласно литературным данным, ТGFβ-1 служит важным фактором регуляции экспрессии других факторов роста [23]. ТGFβ-1 синтезируется моноцитами, макрофагами, T- и B-лимфоцитами. Повышение ТGFβ-1 наблюдается в секреторную фазу цикла [24]. Согласно данным литературы, полиморфный вариант T rs1800469 ТGFβ-1 приводит к повышению уровня экспрессии ТGFβ-1 [23, 25].
Генетический полиморфизм EGF c.-382А>G rs4444903, входящий в состав рисковой комбинации, может влиять на взаимодействие EGF со своим рецептором и стимулировать, таким образом, процессы внутриклеточного фосфорилирования белков, влияя на пролиферацию и дифференцировку клеток эндометрия [26, 27].
Данные литературы свидетельствуют о связи IGF1 с повышенной пролиферацией, ростом опухолей эндометрия, миом и лейомиосарком [28]. Некоторые исследования указывают на повышение IGF1 в гиперплазированном эндометрии [29]. Аллельный вариант А rs6214 IGF1 вызывает снижение экспрессии белка, а аллельный вариант G данного гена, входящий в состав рисковой комбинации, наоборот, вызывает увеличение экспрессии белка.
Заключение
Таким образом, результаты работы свидетельствуют о важном значении полиморфных локусов генов факторов роста EGF c.-382А>G rs4444903, ТGFβ-1 c.-1347Т>С rs1800469, IGF1 c.*2716G>А rs6214, VEGF c.-958С>Т rs833061, FGFR2 c.109+906Т>С rs2981582 в формировании сочетания миомы матки и гиперплазии эндометрия. Генотип СС rs2981582 FGFR2 является фактором риска развития сочетания миомы матки с гиперплазией эндометрия (ОШ=1,38). Фактором риска развития заболевания является и комбинация аллелей А rs4444903 EGF и С rs1800469 ТGFβ-1 (ОШ=1,50). Протективное значение для развития сочетания миомы матки и гиперплазии эндометрия имеет комбинация 4 генетических маркеров G rs4444903 EGF, С rs1800469 ТGFβ-1, G rs6214 IGF1 и Т rs2981582 FGFR2 (ОШ=0,59). Изученные SNP имеют значимый регуляторный потенциал, располагаются в регионах энхансеров экзонного сплайсинга, являются сайтами связывания транскрипционных факторов, ассоциированы с влиянием на уровень экспрессии mRNA восьми генов в разных тканях и органах.



