На сегодняшний день гнойно-воспалительные послеродовые заболевания (ГВПЗ) не имеют тенденции к снижению и составляют от 5 до 26% всех осложнений послеродового периода [1–3]. Септические осложнения в акушерстве в последние годы вышли на третью позицию по частоте и составили в общей структуре причин материнской смертности 12% [4–8]. Сепсис является крайне негативным отсроченным осложнением ГВПЗ, требующим своевременной диагностики и незамедлительного лечения [9–12].
Ведущую роль в структуре ГВПЗ играет послеродовый эндометрит (ПЭ), который диагностируется более чем в 40% всех случаев послеродовых осложнений [13–18]. В Европе и США частота ПЭ после вагинальных родов составляет 1–3%, в России – от 2 до 5%; после планового оперативного родоразрешения в странах Европы и в США – от 5 до 15%, в России – от 10 до 15% [13–15, 19–21].
Следует обратить внимание на эволюцию клинической картины и течения ГВПЗ во временном аспекте. Так, еще в 1996 г. было проанализировано 3 288 562 историй родов, при этом частота ГВПЗ составила 21,7%, тогда как за период 1984–1988 гг. – всего лишь 10%. Однако на фоне уменьшения общего количества всех ГВПЗ возросла частота ПЭ – с 33,2 до 39,5%; при этом в 92,4% случаев ПЭ протекал по классической клинической форме [11, 12, 22, 23].
На особенности течения ГВПЗ оказывает влияние ряд особенностей микробиологического спектра; отмечается полиэтиологичность патогенов (в особенности энтеробактерий и их ассоциаций), сосуществующих в виде биопленок, которые обладают повышенной резистентностью к основным антибактериальным препаратам [24]. Кроме того, по данным ряда авторов, условно-патогенные микроорганизмы также могут быть возбудителями послеродовых инфекционных заболеваний на фоне кровопотери, особенно во время абдоминального родоразрешения, и при состоянии локальной иммуносупрессии [10, 24–28]. Повсеместное применение в акушерской практике широкого спектра антисептических и антибактериальных средств, повышение антибиотикорезистентности и вирулентности микроорганизмов приводят к увеличению процента стертых и абортивных форм послеродовых заболеваний, диагностика которых часто бывает затруднена [29, 30].
Также следует отметить, что за последние годы частота оперативной активности в родах имеет тенденцию к повышению. Так, в учреждении I уровня оказания акушерской помощи хирургические способы родоразрешения составляют 19,0–24,2%, на II уровне – 30–37%, на III уровне – 35–40%, а в специализированных научных центрах – до 70% [12]. Кесарево сечение (КС), несмотря на применение современного шовного материала и антибиотикопрофилактики, остается серьезным фактором риска возникновения ГВПЗ [20, 21]. Так, по данным ряда авторов, частота встречаемости эндометрита после оперативного родоразрешения составляет от 2,5 до 20%, при этом при патологических родах – 10–20%, а у женщин с высоким инфекционным риском – 13,3–54,3% [16, 22, 27, 31].
По данным отечественных авторов, частота ПЭ в общей популяции родильниц составляет после самопроизвольных родов (СР) 3–8%, после КС – 10–20% [16, 22], а частота акушерского перитонита после КС в родовспомогательных стационарах колеблется от 0,1 до 1,5%. Чаще всего эта патология развивается после оперативного родоразрешения (98%); при этом послеродовый эндомиометрит является одной из основных причин генерализации инфекции и формирования неполноценного рубца на матке [16, 21, 23].
Таким образом, в связи с перинатальной направленностью современного акушерства и снижением общего состояния здоровья женщин репродуктивного возраста значительно выросла частота абдоминального родоразрешения, что создает дополнительный риск для возникновения интраоперационных и послеоперационных осложнений [22]. Так, по мнению зарубежных и отечественных авторов, общая частота всех осложнений при абдоминальном родоразрешении составляет 16,3–21,4% [16, 22].
Значительное влияние на частоту послеродовых инфекционных осложнений оказывают уровень социально-экономического развития региона и организация медицинской помощи [22, 27]. При этом острым является вопрос системной организации медицинской помощи пациенткам с осложнениями послеродового периода. Так, родильницы лечатся в гинекологических стационарах, где нет условий для адекватного послеродового ухода и совместного пребывания матери и новорожденного. Также отсутствуют стандартизованные подходы к выполнению хирургических вмешательств при послеродовых осложнениях; при этом преобладают радикальные вмешательства на фоне недостаточного применения эндоскопических технологий [19, 32].
В исследованиях Обоскаловой Т.А. и Глухова Е.Ю., направленных на изучение региональных особенностей ГВПЗ, приводятся данные о системе профилактики ГВПЗ в родовспомогательных учреждениях Екатеринбурга и программе оказания медицинской помощи женщинам с осложнениями пуэрперия [33]. Так, с 2006 г., когда в городе Екатеринбурге произошло улучшение финансирования родильных домов, увеличилась доставка медикаментозных средств, расходных материалов и была усовершенствована техника абдоминального родоразрешения, частота тяжелых гнойно-септических осложнений, которые в том числе заканчивались органоуносящими операциями, достоверно снизилась практически в 2 раза. Однако ввиду увеличения частоты абдоминального родоразрешения (с 14,8 до 31,2% за период с 1998 по 2013 гг.) отметилась тенденция к увеличению случаев таких осложнений, как нагноение послеоперационной раны на передней брюшной стенке и несостоятельность рубца на матке (в 2 раза) [33].
Авторы показали, что для профилактики ГВПЗ важна определенная организационная структура родильных домов, предусматривающая максимальное разобщение рожениц и родильниц друг от друга, но при этом обеспечивающая совместное пребывание матери и ребенка. Актуальным является и наличие в роддоме взаимозаменяемых, циклически функционирующих подразделений высокого инфекционного риска: палат реанимации и интенсивной терапии, операционных, родовых [33].
Именно на основании новых данных об особенностях ГВПЗ в региональном аспекте в дальнейшем возможна разработка организационных мероприятий акушерско-гинекологической службы города и края, что позволит снизить частоту тяжелых форм послеродовых осложнений.
Цель исследования: изучить особенности анамнеза и клинической картины у больных с ГВПЗ по материалам г. Красноярска и Красноярского края.
Материалы и методы
На клинических базах Красноярского государственного медицинского университета имени проф. В.Ф. Войно-Ясенецкого проведено ретроспективное описательное эпидемиологическое исследование клинико-анамнестических данных 387 историй родов пациенток с различными осложнениями позднего послеродового периода и 446 историй родильниц с ПЭ за временной интервал 2017–2022 гг.
Первая группа исследования была выделена для определения структуры осложнений послеродового периода, оценки соматического статуса и клинико-анамнестических данных общей когорты родильниц по архивным данным родильных домов г. Красноярска. По данным второй группы проводилась оценка клинической картины и анамнеза, особенностей течения ПЭ в зависимости от способа родоразрешения; при этом эта группа была разделена на две подгруппы: было проанализировано 205 историй родильниц после СР и 241 – после КС. Архивные данные набирались в архивах КГБУЗ «Красноярская межрайонная клиническая больница скорой медицинской помощи имени Н.С. Карповича», Краевой клинической больницы, родильного дома № 1, КГБУЗ «Красноярская межрайонная клиническая больница №4» (рис. 1).
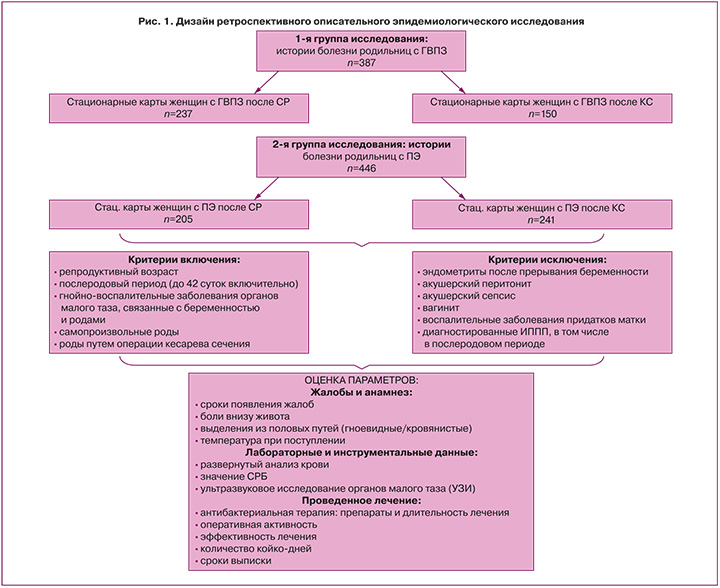
Критерии включения: репродуктивный возраст, послеродовый период (до 42 суток включительно), гнойно-воспалительные заболевания органов малого таза, связанные с беременностью и родами, СР или роды путем КС.
Критерии исключения из исследования: эндометриты после прерывания беременности, акушерский перитонит, акушерский сепсис, вагинит, воспалительные заболевания придатков матки, диагностированные инфекции, передающиеся половым путем, в том числе в послеродовом периоде.
В ходе исследования оценивались клинико-анамнестические (сроки появления жалоб, боли внизу живота, выделения из половых путей (гноевидные/кровянистые), температура при поступлении), лабораторные и инструментальные данные (развернутый анализ крови, значение С-реактивного белка, ультразвуковое исследование органов малого таза (УЗИ)), а также был проведен анализ проводимого лечения и его эффективности в группах сравнения (рис. 1).
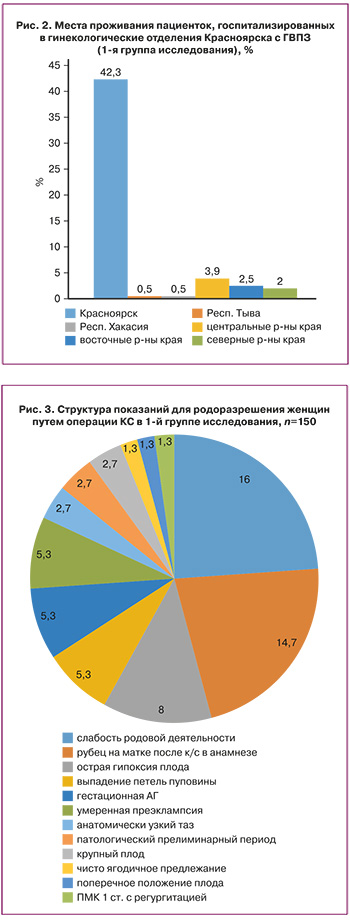
Географический разброс мест проживания пациенток представлен на рисунке 2. Следует отметить, что преобладающее количество родильниц с осложнениями послеродового периода (42,3% (164/387)) были из г. Красноярска.
Статистический анализ
Произведен с использованием программы IBM SPSS Statistics. Определение необходимого объема выборки проводилось с использованием табличного метода. Оценка нормальности распределения производилась с помощью вычисления критерия Колмогорова–Смирнова с поправкой Лиллиефорса с уровнем критической значимости р>0,05, в этом случае распределение признака считалось подчиняющимся закону нормального распределения. Описательная статистика представлена в виде качественных данных, представленных в %.
Для описания количественных данных, имеющих нормальное распределение, были использованы среднее арифметическое (М) и стандартное отклонение (SD), представленные в формате М (SD). При распределении признаков, отличающемся от нормального, они были описаны в виде медианы (Me) и интерквартильного интервала в формате Me (Q1; Q3).
Результаты
При анализе клинико-анамнестических данных пациенток 1-й группы было отмечено, что средний возраст родильниц с ГВПЗ составил 27,9 (27,4; 28,5) года. Родоразрешение этих женщин было произведено в среднем при сроке беременности 39,5 недели (38,3; 40,5), при этом 38,8% (150/387) были родоразрешены оперативным путем, а в 61,2% (237/387) случаев были СР. Следует отметить, что лишь в 33,9% случаев (131/387) пациентки переводились с ГВПЗ из родильных домов в гинекологические стационары, в остальных случаях (66,1%) родильницы были госпитализированы из дома бригадой скорой помощи или в результате их самообращения в стационар (256/387).
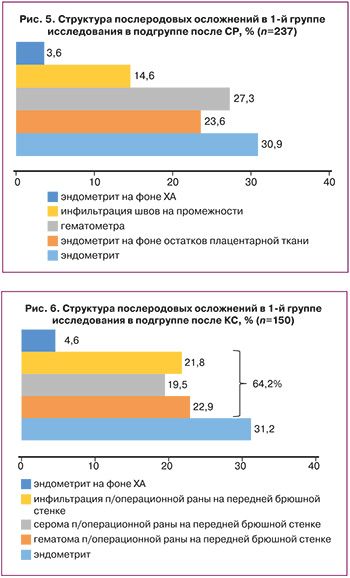
В структуре показаний к проведению оперативного родоразрешения в 1-й группе исследования лидирующую позицию занимали слабость родовой деятельности – 16% (24/150), рубец на матке после КС в анамнезе – 14,7% (22/150) и острая гипоксия плода – 8% (12/150); при этом преждевременный разрыв плодных оболочек имел место у 33,3% (50/150) пациенток (рис. 3).
По результатам гистологического заключения анализа плацент при клинически диагностированном хориоамнионите (15% (58/387)) диагноз был подтвержден в 3,5% случаев у родильниц после СР и в 4,6% – после абдоминального родоразрешения.
При изучении частоты сопутствующих соматических заболеваний у женщин исследуемых групп было отмечено, что наиболее часто встречались пиелонефрит (30,8% (119/387)) и ОРВИ (51,3% (199/387)), тогда как на долю COVID-19 пришлось лишь 2,6% (10/387) случаев (рис. 4).

Осложнения позднего послеродового периода в группе родильниц с ГВПЗ имели место у 25,9% (100/387) пациенток. В структуре осложнений позднего послеродового периода лидирующее место занимают эндометрит (36,7% (142/387)), нагноение раны промежности (11,1% (43/387)), а также гематометра (33,6% (130/387)), которая может рассматриваться как фактор риска развития эндометрита; при этом на фоне остатков плацентарной ткани она диагностировалась в 23,6% (31/130) случаев.
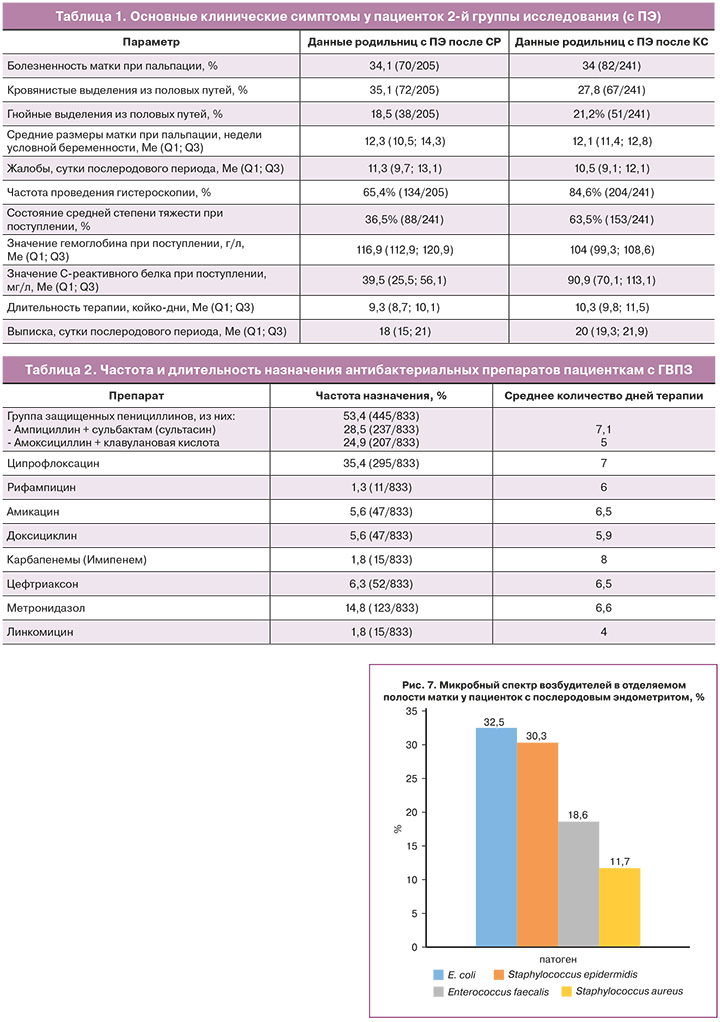
Наиболее частыми осложнениями в 1-й группе женщин после СР были: гематометра (27,3% (66/237)) и остатки плацентарной ткани (24% (57/237)), тогда как у пациенток после КС наиболее часто были диагностированы осложнения послеоперационной раны на передней брюшной стенке, частота которых составила 64,2% (96/150), из них: в 21,8% (21/96) – инфильтрация, в 19,8% (19/96) – серома, в 22,9% (22/96) – гематома (рис. 5, 6).
Все пациентки из родильных домов с вышеперечисленными осложнениями переводились в гинекологические отделения многопрофильных стационаров.
Средний возраст больных с ПЭ (2-я группа исследования), госпитализированных в гинекологические отделения г. Красноярска, составил 28,1 (27,2; 29,2) года, при этом первые роды были у 17,7% (79/446), вторые – у 7,2% (32/446), третьи – у 2,5% (11/446) и лишь у одной пациентки – шестые. Жалобы, с которыми пациентки были госпитализированы в стационар, манифестировали в среднем на 10,8 (9,9; 11,9) сутки послеродового периода. Следует отметить преобладание стертой формы ПЭ, при которой лишь в трети случаев диагностировались болезненность матки при пальпации (в 34,1% (70/205) после СР и в 34% (82/241) после КС), кровянистые выделения из половых путей (в 35,1% (72/205) после СР и в 27,8% (67/241) после КС), при том, что гноевидные выделения из половых путей, больше характерные для классической формы эндометрита, отмечались лишь у 18,5% (38/205) пациенток с ПЭ (табл. 1) после СР и несколько чаще – после абдоминального родоразрешения (21,2% (51/241)).
Во 2-й группе удовлетворительное состояние при поступлении было лишь у 38,1% (170/446) женщин, состояние средней тяжести – у 57,4% (256/446), тяжелое состояние было диагностировано у 1,1% (5/446), сепсис – у 3,4% (15/446); при этом в группе пациенток с ПЭ после КС значимо чаще отмечалось состояние средней степени тяжести (63,5% (153/241)), чем у женщин после СР (36,5% (88/241)).
По результатам показателей гемостаза выявлено несколько повышенное значение фибриногена – 4,7 г/л и несколько ускоренное протромбиновое время – 15,7 с. При этом следует отметить, что имеются статистически значимые различия в группе после КС и СР по уровням гемоглобина (в группе с СР – 116,9 (112,9; 120,9) г/л, в группе после КС – 104 (99,3; 108,6) г/л) и С-реактивного белка (в группе с СР – 39,5 (25,5; 56,1) мг/л, в группе после КС – 90,9 (70,1; 113,1) мг/л) при поступлении; при этом в группе пациенток после КС, осложнившегося в позднем послеродовом периоде эндометритом, были более низкие показатели гемоглобина, что объясняется объемом кровопотери, и более высокие показатели С-реактивного белка (p<0,0001).
По результатам УЗИ органов малого таза, выполненного при поступлении больных в стационар, обращают на себя внимание субинволютивные размеры матки, средние параметры которой составили: длина 77,2 (61,8; 93,4) мм, толщина 57,2 (48,4; 66,0) мм, ширина 76,7 (64; 88,4) мм.
Согласно данным ряда авторов, первые клинические симптомы ПЭ после оперативных родов появляются на 6±2 сутки послеродового периода, в то время как после спонтанных родов – на 4±2 сутки [17, 23, 34]. По результатам проведенного нами исследования ПЭ был диагностирован на 10,8 (9,9; 11,9) сутки, при этом после КС клиническая картина появлялась несколько раньше (на 10,5 (9,1; 12,1) сутки), чем после СР (на 11,3 (9,7; 13,1) сутки). Таким образом, дебют клинической картины ПЭ, как правило, возникает тогда, когда родильница уже находится вне родовспомогательного учреждения, что может приводить к несвоевременному обращению пациентки за медицинской помощью, запоздалой диагностике и развитию тяжелых форм ГВПЗ.
Характерной особенностью послеродовых инфекционных заболеваний в настоящее время является их полиэтиологичность. По литературным данным, ведущее место в этиологической структуре принадлежит условно-патогенным микроорганизмам: неферментирующим грамотрицательным палочкам (преимущественно Escherichia coli, Klebsiella pneumoniae), энтерококкам (преимущественно Enterococcus faecalis), стафилококкам (преимущественно Staphylococcus aureus, Staphylococcus haemolyticus), находящимся в матке в большинстве случаев в массивном количестве в виде аэробно-анаэробных ассоциаций [18, 21, 28, 29].
По результатам собственного анализа микробного спектра в очаге воспаления было выявлено, что наиболее часто встречающимися возбудителями ПЭ являются Escherichia coli (32,5% (145/446)), Staphylococcus epidermidis (30,3% (135/446)), Enterococcus faecalis (18,6% (83/446)), Staphylococcus aureus (11,7% (52/446)). Монокультуры грамположительных микроорганизмов наблюдались в 38,1% (170/446) случаев, грамотрицательных – в 44,2% (197/446), а смешанная грам-плюс и грам-минус флора была диагностирована в 17,7% (79/446) случаев (рис. 7, 8).

При изучении антибиотикорезистентности к антимикробным препаратам наиболее часто встречающихся патогенов было отмечено, что Escherichia coli была устойчива к ампициллину в каждом третьем случае (35,8% (52/145), в 21,4% (31/145) – к доксициклину, при этом у 21,4% (31/145) штаммов Escherichia coli выявлена продукция β-лактамаз расширенного спектра (БЛРС) – фермента, разрушающего цефалоспорины I–V поколений. Устойчивость Escherichia coli к гентамицину и амикацину составила 31,7% (46/145) и 33% (48/145) соответственно.
Staphylococcus epidermidis в 45,9% (62/135) случаев обладал резистентностью к эритромицину и практически в равных долях – к ципрофлоксацину и левофлоксацину – 16,3% (22/135) и 14,8% (20/135) соответственно. Устойчивость к цефокситину в 15,6% (21/135) (MRSE) свидетельствует о резистентности ко всем В-лактамным антибиотикам, кроме цефтаролина и цефтобипрола.
Следует отметить, что еще в 1992 г. результаты антибиотикограммы отделяемого полости матки у родильниц с ПЭ были следующими: грамотрицательные микроорганизмы были наиболее чувствительны к гентамицину (72,8%), карбенициллину (70,9%), мономицину (64,1%), канамицину (62,7%), левомицетину (57,8%). Стафилококки наиболее чувствительны к гентамицину (83,5%), карбенициллину (79,7%), тетрациклину (75,8%), оксациллину (75,1%), метициллину (67,6%); при этом наиболее чувствительными оказались микроорганизмы стрептококковой группы: от 36% (к мономицину) до 96,3% (к ампициллину) [30, 35–38].
Однако проведенные нами исследования микробного спектра из полости матки позволили констатировать наличие резистентности Escherichia coli к ампициллину у каждой третьей больной, а БЛРС+ Escherichia coli, которые высеваются по результатам бактериального посева в 21,4% случаев, обладают расширенным спектром резистентности в отношении группы пенициллинов и цефалоспоринов I– IV поколения. В то же время ингибитор-защищенные пенициллины назначались практически в каждом втором клиническом случае (в 53,4%).
В ходе ретроспективного анализа нами было отмечено, что среднее количество дней антибактериальной терапии родильниц с ГВПЗ, включая ПЭ, составило 7,9 (7,4; 8,4), при этом в преобладающем проценте клинических случаев назначались ингибитор-защищенные пенициллины – 53,4% (238/446), в 11,2% была назначена монотерапия, в остальных случаях – в комбинации с ципрофлоксацином.
Поскольку забор содержимого из полости матки проводился до начала антибиотикотерапии, результаты бактериологического посева и антибиотикограммы в последующем служили основанием для корректировки антибактериальной терапии. При этом схемы менялись в 30% (134/446) случаев, назначались: цефтриаксон (в 6,3% (28/446)), доксициклин (в 5,6% (25/446)) и метронидазол (в 14,8% (66/446)) (табл. 2). Однако в 11,7% (52/446) случаев по результатам бактериального посева роста микрофлоры выявлено не было.
Сопутствующая терапия назначалась в виде утеротоников в течение 8,6 дня (окситоцин) в 58,9% (263/446) случаев, надропарина кальция (фраксипарин) – в течение 7,9 дня в 46,4% (207/446) и препаратов железа (сорбифер) – в течение 9,6 дня в 43,1% (192/446), на фоне чего показатели гемоглобина статистически значимо повышались c 111,2 до 118,3 г/л.
В результате проведенного анализа оперативной активности в отношении родильниц 1-й группы с ГВПЗ было определено, что у 45,5% (176/387) в позднем послеродовом периоде была проведена гистероскопия, а практически у трети пациенток (31,7% (123/387)) – вакуум-аспирация полости матки по поводу гематометры и остатков плацентарной ткани. В среднем гистероскопия проводилась на 14,5 (12,3; 16,5) сутки послеродового периода, при этом в 1,7% (3/176) случаев она сочеталась с лапароскопией по поводу подозрения на расхождение швов после абдоминального родоразрешения по данным УЗИ. Следует отметить, что в группе женщин с ПЭ после абдоминального родоразрешения гистероскопия проводилась значимо чаще (в 84,6% (204/241) случаев), чем в группе больных с ПЭ после СР (65,4% (134/205)).
Общий срок госпитализации пациенток с ГВПЗ составил в среднем 9,9 (9,4; 10,4) койко-дней; при этом пациентки с ПЭ после КС статистически значимо дольше получали стационарное лечение – 10,3 (9,8; 11,5) суток, чем женщины после СР – 9,3 (8,7; 10,1) койко-дня. Выписка родильниц после проведенной консервативной терапии в среднем проводилась на 18 (15; 21) сутки послеродового периода, а после оперативного лечения – на 20 (19,3; 21,9) сутки. Размеры матки после лечения по данным УЗИ органов малого таза уменьшились на 54,6%, количество лейкоцитов в клиническом анализе крови при выписке составило 6,2 (5,5; 6,8)×109/л, а уровень С-реактивного белка – 17,7 (5,9; 33,2) мг/л.
Все пациентки с ГВПЗ выписывались из стационара в удовлетворительном состоянии под амбулаторное наблюдение врача акушера-гинеколога.
Таким образом, в общей структуре всех факторов риска развития ПЭ лидирующую позицию занимает КС, несмотря на использование современного шовного материала и легитимные схемы антибиотикопрофилактики и терапии. Результатами проведенного исследования было доказано, что большее количество ГВПЗ диагностируется у женщин, родоразрешенных путем операции КС; при этом ведущую роль в структуре ГВПЗ занимает ПЭ, на который приходится 36,7% всех случаев послеродовых осложнений, тогда как в группе родильниц после абдоминальных родов лидирующую строчку занимают осложнения послеоперационной раны на передней брюшной стенке (64,2%).
Следует отметить, что симптомы ПЭ появляются в среднем на 11-е сутки послеродового периода, когда родильницы уже находятся вне родовспомогательного учреждения. Клиническая симптоматика ПЭ после операции КС манифестирует на 10-е сутки, что на сутки раньше, чем у пациенток после СР. Ввиду преобладания стертых клинических форм достаточно часто диагностика ГВПЗ запаздывает, приводя в 57,4% к состоянию средней степени тяжести, а в 3,4% – к развитию сепсиса.
Обращает на себя внимание оперативная активность в группе пациенток с ПЭ после абдоминального родоразрешения: практически в каждом втором случае (45,4%) проводится гистероскопия; при этом частота хирургического лечения составляет 84,6%, что значимо выше, чем в группе женщин с ПЭ после СР (65,4%).
В спектре патогенов, выделенных из полости матки, лидирующую позицию занимает грамотрицательная флора (в 44,2%), а среди наиболее часто выявляемых микроорганизмов диагностируются Escherichia coli (32,5%; среди них в 21,4% это БЛРС+Escherichia coli), Enterococcus faecalis (18,6%), Staphylococcus epidermidis (30,3%).
Также обращает на себя внимание резистентность выделенных Escherichia coli к ампициллину (в 35,8%). В то же время следует помнить о том, что БЛРС+Escherichia coli, высеваемая в 21,4%, имеет расширенный спектр резистентности, что может обусловливать неэффективность терапии пенициллинами и цефалоспоринами I–IV поколений. Однако наиболее частые схемы антибиотикотерапии, по данным нашего исследования, включали именно назначение препаратов группы защищенных пенициллинов (53,4%).
Заключение
Таким образом, ПЭ после абдоминальных родов протекает несколько тяжелее, чем у родильниц после СР: клиническая картина манифестирует на сутки раньше, больные при поступлении имеют более высокие показатели воспалительных маркеров и чаще имеют сопутствующую анемию (особенно в случае экстренного родоразрешения), антибактериальная терапия проводится дольше, чем женщинам с ПЭ после СР, а оперативная активность в отношении таких больных составляет 84,6% (в отличие от 65,4% у родильниц после СР).
С учетом постепенного роста числа резистентных микроорганизмов проблема антибиотикорезистентности с каждым днем становится все острее; при этом именно оптимизация использования противомикробных средств – ключевой приоритет глобальной стратегии борьбы с развитием супербактерий.
В этой связи требуются проведение дальнейших исследований, направленных на изучение региональных особенностей микробного пейзажа в очаге воспаления с определением антибактериальной чувствительности и резистентности выделенных микроорганизмов к современным антибактериальным препаратам, а также оценка иммунологической резистентности макроорганизма на местном и системном уровнях. Данные исследования помогут в перспективе разработать рациональные схемы антибактериальной терапии и иммунокоррекции больных с ГВПЗ, снизить частоту их тяжелых деструктивных форм, сохранить репродуктивную функцию, а также достичь значительного социально-экономического эффекта за счет сокращения длительности терапии и сроков госпитализации данной категории больных.



