Проблема своевременной диагностики и лечения гнойно-воспалительных послеродовых заболеваний (ГВПЗ) является одной из актуальных в современной практике акушера-гинеколога. Лидирующую позицию в общей структуре ГВПЗ занимает послеродовый эндометрит (ПЭ), частота которого колеблется в диапазоне 15–50% [1, 2]; при этом в группе женщин после операции кесарева сечения (КС) эта патология может достигать 55–85% [3, 4].
Согласно литературным данным, за последние десятилетия наметилась тенденция к развитию стертых форм ПЭ, при которых классические клинические проявления имеют место лишь у трети больных [5]. Также следует отметить, что, как правило, жалобы и симптомы манифестируют уже после того, как родильница покидает стены родовспомогательного учреждения, что приводит к запоздалой диагностике и отсроченному лечению [6].
Согласно клиническим рекомендациям (2016), по течению выделяют 3 формы ПЭ: легкую, средней тяжести и тяжелую; а также существует стертая форма ПЭ, при которой первые симптомы могут появляться лишь к 7-м суткам пуэрперия [7]. При этом ПЭ после оперативных родов выделяют отдельно, так как в таком случае он протекает значительно тяжелее, и в клинической картине могут появляться такие симптомы, как вздутие живота, задержка стула и отхождения газов, снижение количества выделяемой мочи за сутки [7].
Практически в каждом втором случае ПЭ (51%) имеет место сниженная сократительная способность миометрия, что укладывается в такое понятие, как субинволюция матки (СИМ) – состояние более медленного возвращения исходных размеров и объема матки в послеродовом периоде и в течение 6 недель после родов [7, 8]. В основе развития данного патологического состояния лежит недостаточная сократительная способность миометрия в пуэрперальном периоде, которая может быть обусловлена рядом факторов: в 86,6% – нарушением оттока содержимого из полости матки; из них на спазм внутреннего зева приходится 20,9%, гиперанте- или ретрофлексию матки – 11,9%, наличие большого количества децидуальной ткани, оболочек и/или крупных сгустков крови – 52,2%, задержку частей плаценты – 1,5% [7–9]. Следует отметить, что больший процент этих осложнений приходится на оперированный орган, а в 13,4% случаев – это идиопатическое нарушение сократимости при отсутствии на это видимых причин [7–9].
Горин В.С. и соавт. (2011) предложили классификацию СИМ, основанную на данных гистероскопии. Авторы выделяют 2 типа СИМ: первый тип обусловлен наличием сгустков крови в полости матки (по сути – гематометра/лохиометра), второй определяется на фоне остатков плацентарной ткани [10]. Однако следует понимать, что наличие децидуальной ткани заведомо формирует инфекционно-воспалительный процесс в полости матки, что в ряде случаев позволяет рассматривать СИМ как предстадию ПЭ.
Также существует еще одна классификация, согласно которой выделяют два типа СИМ в зависимости от причинных факторов: истинная субинволюция, которая имеет место после родов крупным плодом или многоплодной беременности, а также у женщин с высоким паритетом, и инфицированная – развивается на фоне формирующегося инфекционного процесса в матке при длительном безводном промежутке, многоводии, хориоамнионите и т.д. [10, 11]. Вероятно, первый тип можно рассматривать как самостоятельную форму осложнения послеродового периода, второй – как предстадию формирования ПЭ.
Таким образом, вокруг причастности СИМ к развитию ПЭ имеется ряд контраверсионных мнений. Так, некоторые авторы считают СИМ предстадией развития эндометрита [10, 11], другие относят ее к самостоятельной нозологической единице, так как клиническая картина и патоморфологические изменения не коррелируют с таковыми при классических формах ПЭ [11, 12]. Следует отметить, что в классификации ВОЗ 9-го пересмотра имеется указание на СИМ, однако в МКБ-10 ее относят к категории О90.8, которая включает в себя другие осложнения послеродового периода, не классифицированные в других рубриках, а в рубрикаторе МКБ 11-го пересмотра – к категориям JB44.Y (другие уточненные осложнения послеродового периода) или JB44.Z (осложнения послеродового периода, неуказанные).
Частота встречаемости СИМ в структуре всех осложнений пуэрперия достаточна высока: так, на долю данной патологии приходится от 11 до 51,5% всех осложнений у родильниц [13]. По данным эхографии и гистероскопии СИМ встречается у 10–31% родильниц; при этом в 15–86,7% случаев СИМ манифестирует в развернутую клиническую картину эндометрита [13, 14]. Следует обратить внимание на то, что зачастую под субинволютивными изменениями матки могут понимать такие состояния, как лохиометра/гематометра, которые, по сути, отражают гистопатические изменения матки в случае ее сниженной сократительной способности.
В отношении основных причин формирования СИМ в отечественной и зарубежной литературе имеется не так много данных. Так, принято считать, что в основе сократительной гипофункции миометрия лежит ряд соматических (сопутствующий инфекционно-воспалительный и эндокринный статус), возрастных (юные и возрастные) и конституциональных факторов (ожирение); а также определяющую роль играет течение беременности (преэклампсия, многоводие, многоплодие, крупный плод и др.) и родов (роды быстрые, затяжные, преждевременные или оперативные, аномалии родовой деятельности, повышенная кровопотеря и др.) [15–17].
Однако в последние десятилетия появляется все больше исследований, доказывающих генетические, клеточно-молекулярные и морфологические причины развития субинволютивных изменений послеродовой матки [10]. Так, результатами ряда исследований было доказано, что в субинволютивном миометрии, в сравнении с нормальным, имеют место гипотрофия миоцитов и их сниженное количество на единицу общей площади миометрия [17, 18]. Также имеется ряд работ, в которых под СИМ понимают субинволюцию сосудов плацентарного ложа; при этом отмечается экспрессия гена онкобелка Bcl-2, ингибирующего апоптоз [18, 19]. Важной считается роль телоцитов в электропроводимости сигналов по гладкомышечным волокнам миометрия. Располагаясь между кровеносными сосудами, миоцитами и нервными окончаниями, представленные клетки (ранее имели название «интерстициальные кохаль-подобные клетки») инициируют медленную волну, которая запускает механизм сокращения. Однако при их повреждении (воспаление или гибель) нарушается процесс проведения импульса, что приводит к неполноценной сократительной функции, а как следствие – к развитию СИМ [20–22].
Также немаловажное значение в адекватной сократительной способности послеродового миометрия отводится и его рецепторному аппарату. В миометрии находятся следующие рецепторы: к эстрогенам, прогестерону, простагландину, окситоцину и гистамину, α- и β-адрено- и м-холинорецепторы. Снижение их экспрессии может быть следствием как аномальной родовой деятельности, так и сокращения синтеза многофункционального белка β-аррестина, ответственного за продукцию окситоцина [23, 24]; причем сокращающее действие окситоцина на матку определяется уровнем окситоциновых рецепторов и связано с ц-АМФ и кальцием [25].
Особую категорию родильниц с признаками СИМ составляют женщины после оперативного родоразрешения. В идеальных условиях при адекватной регенеративной функции эндометрия полость матки после родов должна самостоятельно элиминировать децидуальную и некротическую ткань. Так, в норме хорошую сократительную способность миометрия в пуэрперальный период отражают обильные кровянистые выделения из половых путей в течение первых 5 суток послеродового периода, которые в последующем (с 6–10-го дня) приобретают коричневатый цвет, однако их обильность должна сохраняться; к 15-м суткам лохии становятся умеренными желтоватого цвета, а к третьей неделе – слизистыми. Однако если эвакуация содержимого из полости матки задерживается (сгустки крови, остатки плацентарной ткани, ригидность цервикального канала после КС), то формируется инфекционный процесс, который при отсутствии своевременной диагностики и профилактики может привести к развитию ПЭ [26, 27]. Следует отметить, что у родильниц с эндометритом после абдоминальных родов нормальное обратное развитие матки имеет место лишь в 46–67,2% случаев [27–29].
Таким образом, влияние всех факторов, участвующих в формировании СИМ, до конца не изучено. Тем не менее с позиции клинической практики является важным определение места СИМ в общей структуре осложнений пуэрперия, так как очень часто имеет место подмена понятия «субинволюции матки» на «послеродовый эндометрит», и наоборот.
Цель исследования: изучить клинико-анамнестические, лабораторные и инструментально-диагностические особенности течения СИМ у женщин после самопроизвольных и оперативных родов.
Материалы и методы
С учетом актуальности диагностики и выбора стратегии ведения родильниц с субинволютивными изменениями матки на клинических базах Красноярского государственного медицинского университета имени проф. В.Ф. Войно-Ясенецкого за период с 2019–2022 гг. был проведен ретроспективный анализ 100 историй болезни больных с легкой клинической формой ПЭ и 100 историй болезни женщин, у которых в пуэрперии был поставлен диагноз СИМ (рис. 1).
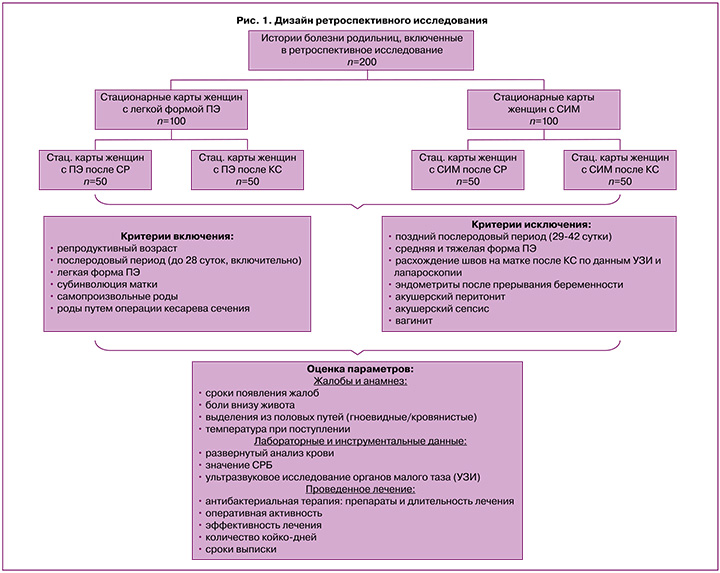
В каждой группе исследования были выделены 2 подгруппы (n=50) в зависимости от метода родоразрешения.
Критериями включения были определены следующие параметры: репродуктивный возраст, послеродовый период (до 28 суток включительно), наличие диагноза легкой формы ПЭ или СИМ, самопроизвольные роды (СР) или роды путем КС.
Критерии исключения из исследования: поздний послеродовый период (29–42-е сутки), средняя и тяжелая форма ПЭ, расхождение швов на матке после абдоминальных родов по данным ультразвукового исследования (УЗИ) и последующей лапароскопии, эндометриты после прерывания беременности, акушерский перитонит, акушерский сепсис, вагинит, воспалительные заболевания придатков матки, диагностированные инфекции, передающиеся половым путем, в том числе в послеродовом периоде.
В ходе исследования оценивались клинико-анамнестические (сроки появления жалоб, боли внизу живота, выделения из половых путей (гноевидные/кровянистые), температура при поступлении), лабораторные и инструментальные данные (развернутый анализ крови, значение С-реактивного белка (СРБ), УЗИ органов малого таза), а также был проведен анализ проводимого лечения и его эффективности в группах сравнения (рис. 1).
Статистический анализ
Статистический анализ произведен с использованием программы IBM SPSS Statistics. Определение необходимого объема выборки проводилось с использованием табличного метода. Оценка нормальности распределения производилась с помощью вычисления критерия Колмогорова–Смирнова с поправкой Лиллиефорса с уровнем критической значимости р>0,05, в этом случае распределение признака считалось подчиняющимся закону нормального распределения. Описательная статистика представлена в виде качественных данных, представленных в виде %.
Для описания количественных данных, имеющих нормальное распределение, были использованы среднее арифметическое (М) и стандартное отклонение (SD), представленные в формате М (SD). При распределении признаков, отличающемся от нормального, они были описаны в виде медианы (Me) и интерквартильного интервала в формате Me (Q1; Q3).
Для сравнения трех и более независимых групп по одному количественному признаку при отсутствии нормального распределения применяется ранговый анализ вариаций по Краскелу–Уоллису. Для выявленных статистически значимых различий проводился апостериорный анализ или попарное сравнение групп с помощью критерия Манна–Уитни с поправкой Бонферрони для уточнения того, между какими именно группами имеются статистически значимые различия.
Результаты
Средний возраст родильниц в группе с СИМ и в группе с ПЭ был сопоставим и составил 28,5 (23,8; 35) и 27 (23; 33,3) года соответственно; при этом срок беременности на момент родоразрешения был идентичным (на 39,4 (38,6; 40) и 39 (39; 41) неделе гестации). Следует отметить, что в группе пациенток с СИМ СР наступали у 65/100 (65%) родильниц, а КС проводилось в 35/100 (35%) случаев (при этом у 16/35 (45,7%) оно было экстренным), тогда как в группе родильниц с легкой формой ПЭ несколько чаще были СР (54/100 (54%) случаев), а КС выполнялось у 46/100 (46,2%) родильниц (р>0,05).
В структуре показаний для абдоминального родоразрешения у пациенток с СИМ лидирующие позиции занимали рубец на матке после предыдущих родов – 26/100 (26%) и слабость родовой деятельности – 21/100 (21%); тогда как в группе сравнения самым частым показанием для выполнения абдоминального родоразрешения была слабость родовой деятельности – у 16/100 (16%), при этом преждевременный разрыв плодных оболочек имел место у 33% (33/100) женщин (рис. 2, 3).
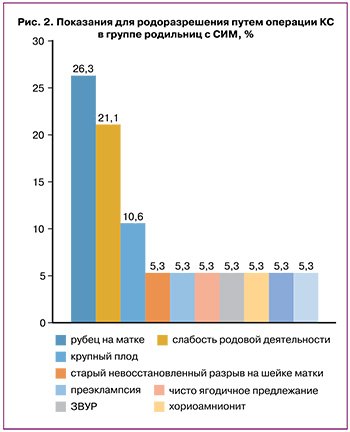
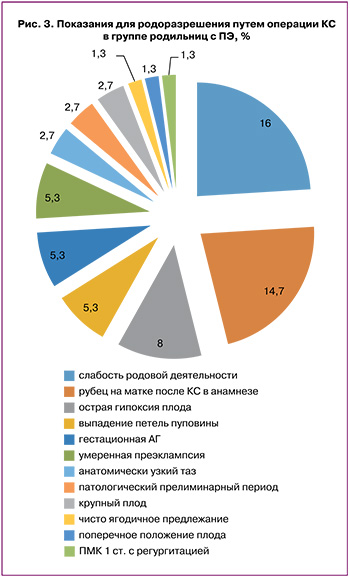
При оценке паритета родов группы сравнения были сопоставимы, при этом у женщин с СИМ первые роды были у 44/100 (44%), вторые – у 39/100 (39%), третьи – у 13/100 (13%), четвертые – у 4/100 (4%); а у пациенток с ПЭ первые роды были у 42/100 (42%) родильниц, вторые – у 34/100 (34%), третьи – у 24/100 (24%) (р>0,05).
При анализе структуры осложнений во время родов было выявлено, что у пациенток с СИМ слабость родовой деятельности диагностировалась у 7/100 (7%), гипоксия плода – у 8/100 (8%), преждевременный разрыв плодных оболочек – у 1/100 (1%), хориоамнионит – в 2/100 (2%) случаев. При изучении хирургической активности в родах в этой же группе было отмечено, что вскрытие плодного пузыря проводилось в 5/100 (5%), а вакуум-экстракция плода – у 4/100 (4%) рожениц. У пациенток с ПЭ слабость родовой деятельности диагностировалась у 8/100 (8%), у 8/100 (8%) – преэклампсия, а у каждой четвертой – 25/100 (25%) – гипоксия плода (р>0,05).
При изучении данных анамнеза в группах исследования было отмечено, что у родильниц с СИМ в анамнезе чаще встречалась слабость родовой деятельности (21,2% против 16%) как показание к выполнению абдоминального родоразрешения (p=0,031), что, несомненно, отражает сниженную сократительную способность матки и непосредственно влияет на возникновение субинволютивных изменений в послеродовом периоде.
В группе женщин с СИМ жалобы в среднем наступали на 13-е сутки послеродового периода (после СР – на 13 (9,8; 17,6), после КС – на 13 (11; 19,8) соответственно). В группе сравнения клинические проявления после СР родильницы отмечали раньше: на 9 (6; 13,3) сутки, а после абдоминальных родов – на 8 (8; 12,8) (р<0,05).
У женщин с СИМ среди клинических проявлений лидировали: болезненность матки при пальпации (в 18/100 (18%) случаев), кровянистые выделения из половых путей (у 41/100 (41%)), тогда как частота жалоб на гноевидные выделения из половых путей не превышала 24% (24/100). При этом наличие вышеперечисленных жалоб у четверти пациенток с субинволютивными изменениями послеродовой матки позволяет отнести такую форму СИМ к инфицированной, что, несомненно, является высоким фактором риска формирования ПЭ.
В группе сравнения температура при поступлении составляла в среднем 38,5 (38; 38,5)°C, что несколько больше, чем у родильниц с СИМ (p=0,62). Боли внизу живота отмечали 94/100 (94%) родильниц с ПЭ, кровянистые выделения – 89/100 (89%); у каждой второй были гноевидные выделения из половых путей – 55/100 (55%), что встречалось статистически значимо чаще, чем у женщин в группе с СИМ (p<0,05).
При оценке результатов развернутого анализа крови при поступлении в стационар у родильниц с СИМ обращает на себя внимание относительно невысокий лейкоцитоз – 9,4 (7,6; 11,9)×109/л, СРБ – 55,9 (29,8; 80,3) мг/л, СОЭ – 35 (25; 43) мм/ч, а также наличие анемии легкой степени у большинства родильниц этой группы (отмечена в 54/100 (54%) случаев); при этом среднее значение гемоглобина составило 118,5 (106,8; 126) г/л. У женщин с ПЭ при поступлении были отмечены значимо более высокие показатели лейкоцитов (11 (8,6; 14,4)×109/л), СРБ (43 (9; 105,7) мг/л) и СОЭ (47,5 (32,8; 60) мм/ч), а также более низкие значения гемоглобина, особенно в группе после абдоминальных родов (106 (96; 119) г/л), p<0,05.
Всем родильницам до и после лечения проводилась ультразвуковая оценка размеров, объема и содержимого полости матки. Так, при поступлении по результатам УЗИ размеры матки в группе пациенток с СИМ составили: длина 96 (80,5; 106) мм, ширина 74 (64; 85) мм, толщина 90 (80; 99) мм, расширение полости матки за счет гетерогенного аваскулярного содержимого до 15,5 (9,7; 27,8) мм, объем матки – 301,3 (213,4; 415) см3. Следует отметить, что наличие гематометры/лохиометры было диагностировано практически у каждой третьей больной с СИМ (26/100 (26%)).
У женщин с ПЭ данные УЗИ при поступлении были примерно теми же, что и у пациенток в группе сравнения, и имели следующие значения: длина – 89 (83,5; 108) мм, ширина – 66 (59,5; 75) мм, толщина – 88 (72; 105,5) мм, расширение полости матки до 12,5 (6,5; 15) мм, общий объем матки – 325,8 (180,2; 476,3) см3 (p>0,05). При этом следует отметить, что у пациенток с ПЭ частота субинволютивных изменений матки была диагностирована в 78/100 (78%) случаев. Обращает на себя внимание тот факт, что объем матки был значимо меньше в подгруппах женщин с СИМ и ПЭ после абдоминальных родов (p<0,05).
В группе женщин с СИМ антибактериальная терапия проводилась у 75/100 (75%) родильниц, при этом среднее количество дней антибактериальной терапии составило 4,5 (2,3; 7), а наиболее часто назначаемыми препаратами были: метронидазол (58/100 (58%)), цефтриаксон (в 32/100 (32%)), амоксициллин + клавулановая кислота (у 10/100 (10%)). Всем родильницам проводилась утеротоническая терапия с положительным эффектом.
В ходе ретроспективного анализа было отмечено, что средние количества дней антибактериальной терапии у женщин с СИМ и ПЭ были сопоставимы (таблица), при этом в группе с ПЭ в половине случаев (54/100 (54%)) в схемах антибактериальной терапии назначались ингибитор-защищенные аминопенициллины, в 36% (36/100) – ципрофлоксацин, в 10/100 (10%) – цефалоспорины в сочетании с метронидазолом.
При оценке проводимого лечения у родильниц с СИМ было отмечено, что оперативные вмешательства имели место лишь у четверти больных этой группы: гистероскопия проводилась у 26/100 (26%), при этом у 3/100 (3%) родильниц во время гистероскопии визуализировались остатки плацентарной ткани в полости матки. В 2% (2/100) случаев гистероскопия сочеталась с диагностической лапароскопией; при этом показанием для ее проведения было подозрение на несостоятельность рубца на матке по данным УЗИ в группе женщин после абдоминальных родов.
В группе женщин с ПЭ гистероскопия была проведена у 45% (45/100) больных, а у каждой третьей из них (32/100 (32%)) – вакуум-аспирация содержимого полости матки по поводу гематометры и остатков плацентарной ткани. В среднем гистероскопия проводилась на 16 (13; 18) сутки послеродового периода; при этом в 2/100 (2%) случаях она сочеталась с лапароскопией. Следует отметить, что в группе женщин с ПЭ после абдоминального родоразрешения гистероскопия проводилась значимо чаще – в 43/50 (86%), чем в группе больных с ПЭ после СР – 33/50 (66%), р=0,041.
В группе с СИМ и у пациенток с ПЭ размеры и объем матки по УЗИ на фоне проводимой консервативной терапии статистические значимо уменьшились; при этом к моменту выписки общий объем сократился в среднем на 40–50% (p<0,05). Следует отметить, что положительная динамика от лечения была сопоставимой в обеих группах (р>0,05), что подтверждает высокую рецептивную активность миометрия к утеротоническим средствам как у женщин с СИМ, так и у пациенток с ПЭ.
При сравнении двух групп родильниц с СИМ были выявлены статистически значимые различия клинико-анамнестических данных и лабораторных показателей в зависимости от метода родоразрешения (таблица). Так, у пациенток в группе после абдоминальных родов несколько реже встречались кровянистые выделения из половых путей (в 22/50 (44%)), однако болезненность матки при пальпации отмечали 9/50 (18%) родильниц после КС; тогда как в группе женщин с СИМ после СР таких жалоб не встречалось. При оценке лабораторных показателей обращают на себя внимание несколько более высокие показатели лейкоцитов, СРБ и СОЭ в группе женщин с СИМ после оперативных родов; при этом показатели гемоглобина у них был ниже, чем в группе сравнения. При оценке ультразвуковых данных обращает на себя внимание статистически значимо меньший объем матки в группе женщин после операции КС (289,1 против 314,8 см3), р=0,043.
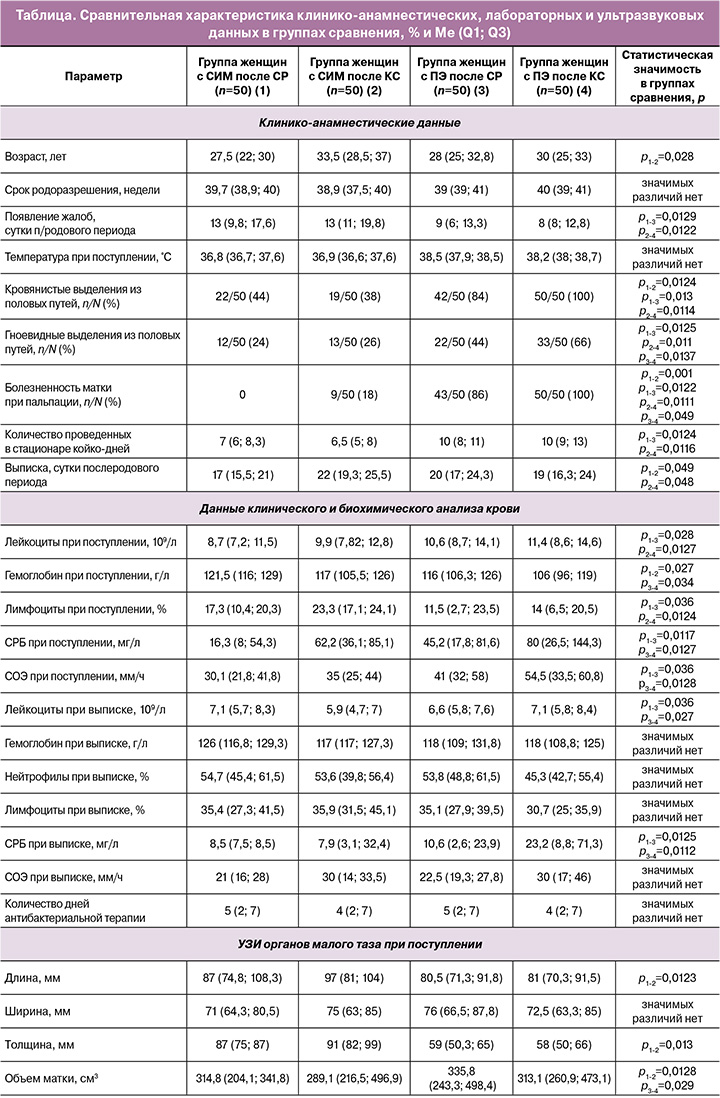
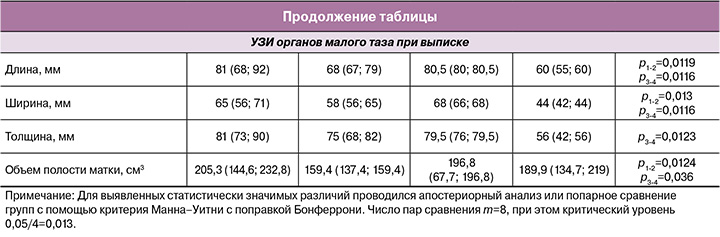
Полученные результаты позволяют сделать вывод о том, что проводимый механический массаж матки после извлечения плода во время выполнения операции КС положительно влияет на количество лохий, размеры и объем матки в послеродовом периоде. Однако наличие самого факта оперативного родоразрешения является ведущим фактором инфекционного риска, что подтверждают показатели как развернутого, так и биохимического анализа крови. Представленные данные позволяют отнести СИМ после операции КС к предстадии ПЭ и классифицировать данную субинволюцию как инфицированную.
Обсуждение
Несомненно, что женщины с субинволютивными изменениями матки имеют ряд схожих клинико-анамнестических особенностей, характерных для ПЭ. Однако у пациенток с диагностированным ПЭ имеется более выраженная клиническая и лабораторная симптоматика: жалобы появляются практически на 4 дня раньше, частота кровянистых и гноевидных выделений, а также болезненность матки при пальпации встречаются значимо чаще (в 86–100%), чем у пациенток с СИМ (p<0,05). По результатам клинического и биохимического анализа крови в группе родильниц с ПЭ (особенно после операции КС) отмечены более высокие показатели лейкоцитов, СРБ и СОЭ и более низкие показатели гемоглобина, что обусловлено большей кровопотерей, особенно в случае экстренного родоразрешения.
Однако при анализе данных УЗИ малого таза было выявлено, что объем матки у родильниц, родоразрешенных оперативным путем, был значимо меньшим, чем у женщин после СР (p<0,05). На основании полученных данных можно сделать выводы о том, что ручной массаж матки после извлечения плода во время КС может стимулировать сократительную способность миометрия, что приводит к уменьшению ее размеров и объема.
Несомненно, знание особенностей течения СИМ (ранняя манифестация, данные бимануального исследования и УЗИ, субклинические проявления) позволит своевременно принять профилактические меры для профилактики развития в последующем гнойно-воспалительных осложнений.
На сегодняшний день имеется ряд профилактических мероприятий, направленных на предупреждение прогрессирования процесса и развития гнойно-воспалительных осложнений у женщин с субинволютивными изменениями матки. Так, достаточно широко применяют физические методы воздействия на сократительную способность миометрия (электростимуляция, электрофорез, диадинамические токи и др.) [22, 23]; также существуют методики комплексной профилактики СИМ с применением физиотерапии переменным магнитным полем низкой частоты и синусоидально-модулированным током в сочетании с внутримышечным введением окситоцина по 2,5 МЕ через 30 минут по 4 инъекции [27, 28]. Однако целесообразность применения утеротонических средств для улучшения сократительной способности миометрия в случае субинволютивных изменений матки (в особенности в случае истинной СИМ) имеет ряд контраверсионных мнений, которые базируются на сниженной экспрессии окситоциновых рецепторов в такой матке [23].
Также ряд авторов предлагают хирургические методы опорожнения полости матки в случае гемато- или лохиометры, такие как выскабливание полости и аппаратную вакуум-аспирацию содержимого полости матки под контролем гистероскопии [28, 30, 31]. При этом аппаратную вакуум-аспирацию рекомендуется использовать при наличии гетерогенной взвеси по данным УЗИ, а выскабливание полости – при наличии более плотных структур. На сегодняшний день рекомендовано проведение любых внутриматочных вмешательств под контролем гистероскопии [7].
Таким образом, СИМ с позиции диагностики является достаточно сложным изолированным заболеванием пуэрперия, однако, несмотря на ряд схожих с ПЭ клинико-диагностических параметров, далеко не всегда замедленное обратное развитие матки приводит к формированию инфекционного процесса.
Заключение
Таким образом, СИМ имеет ряд клинико-лабораторных особенностей, которые позволяют ее относить к изолированному осложнению пуэрперия. Наличие воспалительных изменений в анализах крови подтверждает преобладание инфекционного компонента над сниженной сократительной функцией миометрия у пациенток с ПЭ после КС; тогда как у женщин после СР преобладает сниженная сократительная функция миометрия без явных клинических проявлений и воспалительных изменений в анализах крови. Результаты представленного исследования еще раз подчеркивают необходимость своевременной диагностики субинволютивных изменений матки.



