Наличие дополнительной эктопической ткани яичника наблюдают в медицинской практике сравнительно редко, и, как правило, это явление возникает вследствие нарушений, происходящих во время эмбриогенеза. По данным мировой литературы, частота встречаемости данной патологии варьирует в диапазоне от 1 до 29 000–700 000 клинических случаев [1–4].
Необходимо дифференцировать между собой такие понятия, как «добавочный» и «дополнительный (эктопический)» яичник. Для добавочного яичника характерно присутствие дополнительной яичниковой ткани, расположенной рядом или примыкающей к нормальному яичнику. Термин «эктопический яичник», впервые предложенный в 1959 г. Wharton L.R., включает в себя наличие третьего яичника, который не связан с широкой связкой матки, собственной связкой или воронко-тазовой связкой нормального яичника, а также имеет свое кровоснабжение [5, 6]. В настоящее время в литературе описано 44 случая эктопического яичника, которые в основном являлись интраоперационной находкой или были диагностированы во время аутопсии. Типичные места локализации дополнительного третьего яичника: брыжейка кишечника, сальник, позадиматочное пространство, сигмовидная кишка или такие отдаленные области, как околопочечное, поддиафрагмальное пространство и парааортальная клетчатка [7].
Cruikshank S. (1990) предложил несколько механизмов формирования эктопического третьего яичника, основанных на эмбриологических нарушениях. Яичники развиваются из первичных половых клеток (гоноцитов), которые образуются во внезародышевой энтодерме желточного мешка, откуда они мигрируют в половые валики. Гоноциты оказывают индуктивное воздействие на целомический эпителий, приводящий к формированию овариальной ткани. Если миграция некоторых гоноцитов нарушена, они оказывают свое влияние на окружающий эпителий, вследствие чего и развивается эктопическая яичниковая ткань [8, 9]. Альтернативой данной теории является миграция клеток полового валика. Механизм теории до конца не изучен. Предположительно, клетки полового бугорка проходят по тому же пути, как и гоноциты, в различные эктопические ткани. Данную теорию подтверждает то, что эктопический яичник может располагаться в области забрюшинного пространства [10]. В ряде случаев наличие эктопической овариальной ткани выявлено у пациенток, которым ранее были проведены оперативные вмешательства на органах малого таза. Исследования Camilleri A.P. et al. (1976) показывают, что при экспериментальной трансплантации овариальной ткани нормальная брюшина не была подвержена имплантации яичника по сравнению с рубцовой тканью [11].
Принимая во внимание данные мировой литературы, предложена следующая классификация, позволяющая разделить более точно такие понятия, как истинный эктопический, дополнительный и добавочный яичник [5, 8, 10, 12, 13].
1. Эктопический яичник. Этот термин был предложен Lachman и Berman в 1991 г. и описывает наличие дополнительной овариальной ткани в сочетании с двумя нормальными и типично расположенными яичниками. Lachman M.F. предложил разделить понятие «эктопический яичник» на следующие подтипы: (1) яичниковые импланты посттравматического характера; (2) яичниковые импланты поствоспалительного характера и истинная (эктопическая) овариальная ткань.
2. Дополнительный яичник. Этот термин определяет наличие овариальной ткани, полностью отделенной от нормально расположенных яичников.
3. Добавочный яичник. Данное понятие включает в себя наличие дополнительной овариальной ткани, примыкающей к нормально расположенному яичнику.
4. Аутоампутированный яичник. Этот термин был впервые предложен Sebastian J.A. et al. в 1973 г. и характеризуется образованием дополнительной овариальной ткани вследствие перекрута яичника с последующей его реимплантацией в брюшной полости.
В 36% наблюдений отмечено сочетание эктопического яичника с врожденными аномалиями развития маточных труб и матки (однорогая матка, двурогая матка, внутриматочная перегородка, аплазия матки). Также у данной группы пациенток встречаются сочетанные пороки мочевыделительной системы (агенезия почки и мочевого пузыря). В литературе описывают случаи новообразований, исходящих из третьего яичника, а именно: эндометриомы, дермоидные кисты, муцинозные цистаденомы, опухоли Бреннера, фибромы, папиллярные серозные аденокарциномы. Добавочный яичник приводит к избыточной секреции эстрогенов, а, в свою очередь, состояние гиперэстрогении может провоцировать развитие злокачественных процессов [7, 14, 2, 3, 4]. Li Zang et al. (2017) описали случай развития стероидно-клеточной опухоли в эктопическом яичнике, что было диагностировано после проявления клинических симптомов (выраженная гиперандрогения и синдром Иценко–Кушинга) [3]. Bayramov V. et al. (2009) приводят в пример случай внематочной беременности, которая развилась из яичникового импланта. Яичниковый трансплантат находился на серозном покрове ректосигмоидного отдела толстой кишки и был представлен тканью с кистозным образованием [15].
Постановка данного диагноза затруднительна, что связано с отсутствием патогномоничных симптомов, свойственных данной аномалии развития яичника. Функционирующий эктопический яичник может приводить к нарушению менструального цикла, развитию болевого синдрома [6]. В литературе также описаны случаи перекрута ножки опухоли, исходящей из третьего яичника [16]. Начиная с 1864 г., было зарегистрировано менее 50 случаев эктопического яичника, и лишь в двух из них диагноз был установлен до проведения операции. Как правило, это была случайная находка или гистологический диагноз после исследования удаленного образования из брюшной полости [16].
Хирургическая тактика в отношении данной аномалии развития яичников остается дискутабельным вопросом. Ряд авторов считают необходимым удаление эктопического яичника ввиду риска развития злокачественных опухолей. Yogini D.K. (2017) предлагает использовать эктопический яичник в качестве дополнительного источника получения ооцитов у пациенток со сниженным овариальным резервом во время проведения программы экстракорпорального оплодотворения [13, 17, 18].
По данным мировой литературы, у пациенток с агенезией матки в 20% случаев наблюдают эктопически расположенный яичник, при этом второй яичник имеет типичную локализацию в малом тазу. При однорогой матке частота встречаемости эктопического яичника составляет 42%. Яичник может располагаться в паховом канале, в верхнем и среднем этажах брюшной полости. Также определяется аплазия почки и маточного рога на одноименной стороне [19]. По результатам поиска в системах Google Scholar, Medscape и PubMed описано только два случая эктопического третьего яичника у пациенток с аплазией матки и влагалища (синдром Майера–Рокитанского–Кюстера–Хаузера). Частота данного вида аномалии развития составляет 1:4000–5000 новорожденных девочек. Как правило, во всех случаях при аплазии матки и влагалища, независимо от степени развития рудиментов матки, имеются маточные трубы и яичники нормальных размеров [20–22].
В настоящее время существует множество хирургических методов создания искусственного влагалища. Известной является хирургическая методика брюшинного кольпопоэза – операция Давыдова С.Н., который впервые описал ее в 1969 г., выполняемая путем чревосечения в три этапа [23]. В нашем центре оперативное лечение проводится по методике, предложенной Адамян Л.В. в 1992 г., при которой производятся идентификация подвижной и свободной части брюшины малого таза и создание купола неовлагалища лапароскопическим доступом с параллельным выполнением тоннелирования между уретрой, мочевым пузырем и прямой кишкой со стороны промежности [24]. Несмотря на большой накопленный клинический опыт оперативного лечения более 600 пациенток с аплазией матки и влагалища, нами впервые диагностировано наличие третьего яичника при типично расположенных и функционирующих двух яичниках.
Клиническое наблюдение сочетания синдрома Майера–Рокитанского–Кюстера–Хаузера и эктопического яичника
 Письменное информированное согласие пациента получено.
Письменное информированное согласие пациента получено.
Пациентка А., 22 лет, поступила в отделение оперативной гинекологии ФГБУ «Национальный медицинский исследовательский Центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» с жалобами на невозможность жить половой жизнью и периодические боли внизу живота. Диагноз при поступлении: «Порок развития половых органов. Аплазия матки и влагалища».
Из анамнеза: наследственность не отягощена, в детском возрасте перенесла скарлатину, ветряную оспу. Из соматических заболеваний выявлен хронический гастрит в стадии ремиссии. Оперативные вмешательства на органах брюшной полости и малого таза не проводились. Травмы отрицает.
Общий осмотр: телосложение правильное. Конституциональный тип нормостенический. Рост 164 см. Вес 52 кг. Индекс массы тела 18 кг/м2.
Анамнез заболевания: порок развития половых органов впервые выявлен в возрасте 16 лет, когда пациентка обратилась к гинекологу по месту жительства в связи с отсутствием менструации. Попыток половой жизни не было.
При гинекологическом осмотре: наружные половые органы развиты правильно. Наружное отверстие уретры расположено типично, дорсальнее от него, на расстоянии до 1,0 см определяется гипоплазированнное гименальное кольцо, в середине которого имеется углубление до 1,0 см, заканчивающееся слепо замкнуто. При ректальном исследовании матка не пальпируется, придатки нормальных размеров.
По данным ультразвукового исследования органов малого таза: аплазия матки и влагалища (синдром Майера–Рокитанского–Кюстера–Хаузера). Правый яичник 2,6×2,0×1,8 см. Фолликулярный аппарат слабо выражен. Левый яичник 2,1×1,5×1,6 см. Фолликулярный аппарат слабо выражен.
По данным ультразвукового исследования почек и надпочечников: нефроптоз справа, неполное удвоение чашечно-лоханочной системы правой почки. Область надпочечников без видимой патологии.
При кариотипировании хромосомные аберрации не выявлены. Кариотип 46 XX.
При исследовании гормонального профиля: 17-ОН-прогестерон – 3,32 нмоль/л, дегидроэпиандростерона сульфат – 9,1 мкмоль/л, тестостерон – 1,26 нмоль/л, индекс свободного тестостерона – 3,0%, антимюллеров гормон – 3,31 мг/мл, фолликулостимулирующий гормон – 6,79 мМЕ/мл, лютеинизирующий гормон – 2,84 мМЕ/мл.
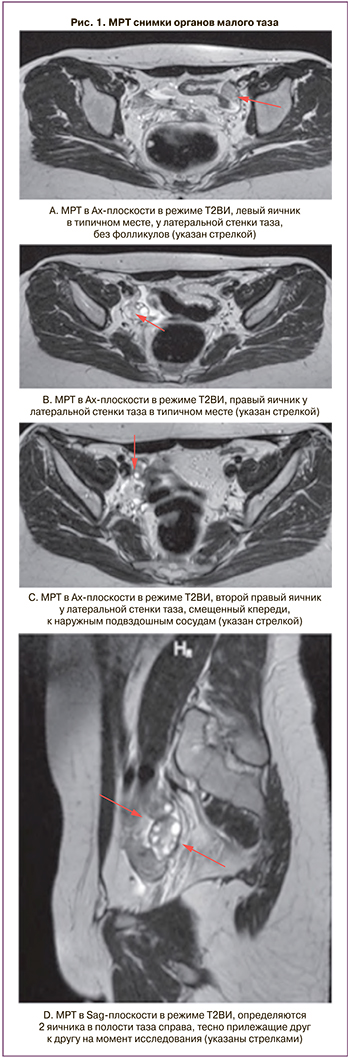
По данным магнитно-резонансной томографии (МРТ) в малом тазу определяются правый и левый яичники, расположенные в типичном месте. Также у латеральной стенки таза справа визуализируется смещенный кпереди к наружным подвздошным сосудам третий яичник (рис. 1).
Пациентка поступила для проведения планового оперативного лечения: создания искусственного влагалища из тазовой брюшины с лапароскопической ассистенцией (по методике академика РАН Адамян Л.В, 1992 г.).
Лапароскопию выполняли в условиях эндотрахеального наркоза по стандартной закрытой методике. После опорожнения мочевого пузыря, через разрез в области пупка в положении для литотомии в брюшную полость вводили иглу Вереша и с помощью инсуффлятора Endoflator (Karl Storz GmbH & Co., Германия) осуществляли наложение пневмоперитонеума с давлением в 12 мм рт.ст. После наложения пневмоперитонеума через тот же разрез вводили троакар диаметром 11 мм (Karl Storz GmbH & Co., Германия). После извлечения стилета в гильзу троакара вводили лапароскоп Hopkins II (0°) (Karl Storz GmbH & Co., Германия), и больную переводили в положение Тренделенбурга (15–20°). Для дополнительных проколов брюшной стенки использовали вторичные троакары в подвздошных областях диаметром 5 мм и 12 мм с винтовой нарезкой (Karl Storz GmbH & Co., Германия).
При ревизии органов брюшной полости и малого таза было обнаружено: матка аплазирована, имеются маточные рудименты, расположенные у стенок малого таза размерами 1,5×1,0×1,0 см. Левые придатки расположены высоко в левом боковом канале. Левый яичник размерами 2,0×1,5×1,5 см, с невыраженным фолликулярным аппаратом (рис. 2A). Рядом с левым яичником расположена гипоплазированная левая маточная труба. От правого маточного рудимента краниальнее и латеральнее отходит собственная связка правого яичника. Правый яичник расположен в типичном месте, размерами 2,0×2,0×1,5 см, с выраженным фолликулярным аппаратом (рис. 2B). От правого яичника краниальнее и латеральнее отходит складка брюшины с сосудистым компонентом длиной до 3,5 см, которая переходит в дополнительный яичник. Дополнительный яичник размерами 2,0×1,5×1,5 см содержит доминантный фолликул размерами до 1,0 см, расположен в проекции наружных подвздошных сосудов на расстоянии 2,5 см каудальнее и латеральнее от бифуркации правой общей подвздошной артерии (рис. 2C). Правая воронко-тазовая связка соединена с верхним полюсом дополнительного яичника. Из правого маточного рудимента отходит правая маточная труба длиной до 10,0 см, расположенная близко к стенке таза. Фимбриальный отдел определяется у верхнего полюса дополнительного яичника. При ревизии органов брюшной полости патологических изменений не выявлено.

Лапароскопическим доступом вскрыта тазовая брюшина дугласовой ямки в поперечном направлении между прямой кишкой, рудиментарным мышечным тяжом и рудиментами крестцово-маточных связок. Острым и тупым путем ретроградно препарирован тоннель между мочевым пузырем и прямой кишкой лапароскопическим доступом. Тоннель препарирован до слизистой преддверия влагалища. На пластиковом влагалищном зонде произведен разрез слизистой в области купола рудиментарного влагалища в поперечном направлении длинной до 3–4 см. Края слизистой фиксированы к краям разреза брюшины отдельными викриловыми швами № 9, наложенными лапароскопическим доступом (рис. 3).
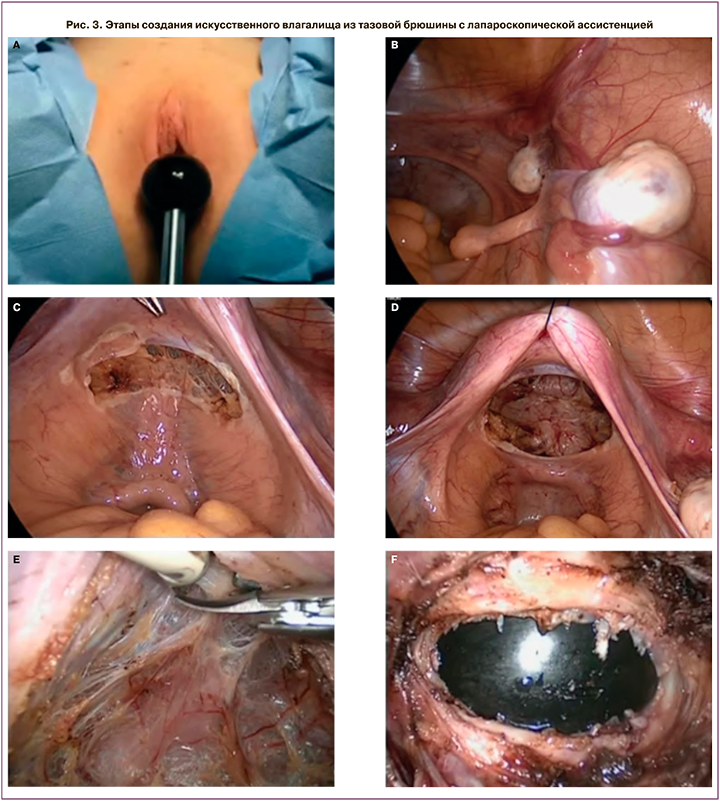
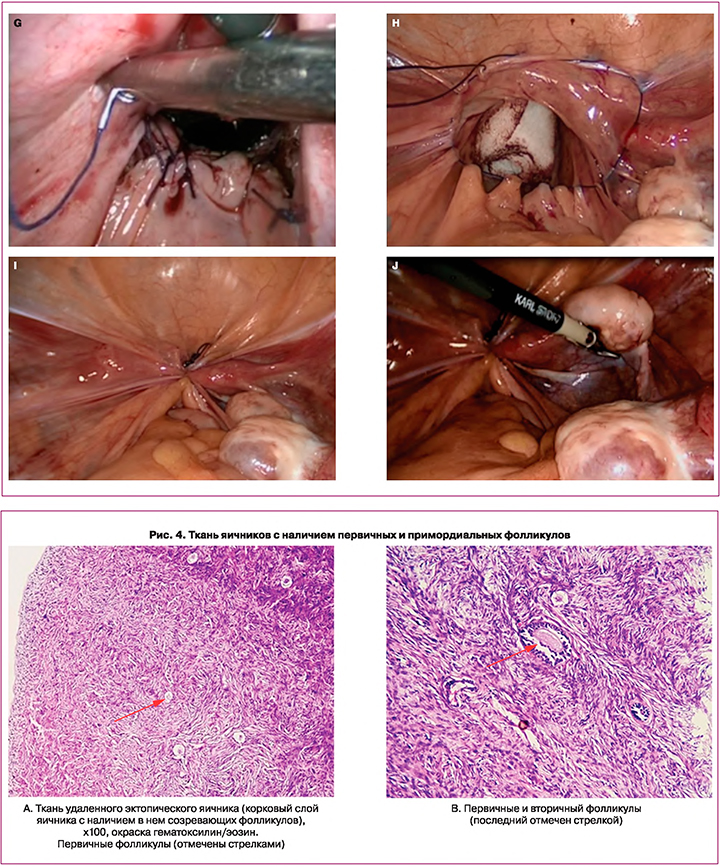
В неовлагалище введен тампон с вазелиновым маслом. С помощью кисетного шва сформирован купол неовлагалища. Принимая во внимание редкий клинической случай, с диагностической целью выполнена биопсия яичников, материал отправлен на патоморфологическое и генетическое исследование.
Было выполнено патоморфологическое исследование удаленных образований. При макроскопическом описании: биоптат эктопического яичника представлен плотным, белесоватым кусочком ткани размерами 0,5×0,5 см. «Жировая подвеска» – два фрагмента фиброзно-жировой ткани размерами 3,2×1,5×1,0 см и 3,0×1,0×1,0 см.
При микроскопическом описании: в материале с маркировкой «жировая подвеска» определяется жировая ткань с включением фиброзных волокон. Биоптат эктопического яичника – ткань яичников с наличием первичных и примордиальных фолликулов (рис. 4).
Проведено исследование по выявлению ДНК гена половой принадлежности (SRY) методом полимеразной цепной реакции. По результатам исследования мутаций SRY-гена не выявлено.
Послеоперационный период протекал без осложнений, проводились антибактериальная, инфузионная, симптоматическая терапия. В удовлетворительном состоянии пациентка была выписана на 7-е сутки после операции под наблюдение гинеколога.
Обсуждение
Эктопический яичник – это редко встречающееся в гинекологической практике состояние, для описания которого используются различные синонимичные термины, такие как дополнительный яичник, добавочный яичник и аутоампутированный яичник. Этиология развития эктопии яичниковой ткани до конца не выяснена и остается дискутабельным вопросом. Предложены следующие основные механизмы: эмбриологический и приобретенный (вследствие ранее проведенного оперативного лечения или врожденного перекрута яичника) [5, 8, 9, 13]. В описанном нами клиническом случае третий яичник, вероятно, развился ввиду нарушений, происходящих во время эмбриогенеза. В пользу этой теории свидетельствует наличие сочетанного врожденного порока развития внутренних половых органов, отсутствие в анамнезе оперативных вмешательств, а также локализация яичника (на уровне наружных подвздошных сосудов, на расстоянии около 4,0 см от основного правого яичника) и его собственное кровоснабжение.
Наличие врожденной аномалии развития яичников (эктопического, дополнительного, добавочного) имеет, как правило, бессимптомное течение. Эктопический яичник может обладать как функционально положительным потенциалом (большое количество антральных фолликулов и высокий показатель антимюллерова гормона), так и быть источником злокачественных новообразований и ургентных состояний в гинекологической практике. Необходим индивидуальный подход к тактике ведения такой группы пациенток. Hyo Sook Bae et al. (2013) описали клинический случай развития серозной папиллярной карциномы, исходящей из эктопического яичника, с множественными метастазами на брюшине малого таза, маточных трубах и двух типично расположенных яичниках у пациентки с синдромом Майера– Рокитанского–Кюстера–Хаузера [22].
Так, в случае сопутствующего распространенного наружного генитального эндометриоза, гормонзависимого рака молочной железы у пациенток в постменопаузе с более высоким риском развития рака яичников может быть рекомендовано профилактическое удаление эктопически расположенной овариальной ткани. У женщин с низким овариальным резервом, а также в рамках подготовки к проведению программы экстракорпорального оплодотворения эктопический яичник может быть использован как источник получения большего количества ооцитов [6].
При проведении клинико-гормонального обследования пациентки нами были определены сывороточные уровни гонадотропинов и антимюллерова гормона, соответствующие средним значениям для женщин репродуктивного возраста. Микроскопическое описание удаленного биоптата третьего яичника показало наличие коркового слоя с первичными и вторичными фолликулами, что говорит о нормальном функциональном резерве дополнительного яичника. Также при МРТ и ревизии брюшной полости нами была детально описана топография третьего яичника, что позволяет проводить регулярно ультразвуковой мониторинг состояния эктопического яичника. Учитывая наличие у пациентки сочетанного порока развития матки, в последующем возможно использовать эктопический яичник при пункции фолликулов.
Заключение
В данной статье мы представили нетипичный редкий клинический случай сочетания эктопического яичника с аплазией матки и влагалища (синдромом Майера–Рокитанского–Кюстера–Хаузера). На основании вышеизложенного можно сказать, что дифференциальная диагностика является первостепенной задачей для клиницистов. Различные клинико-морфологические варианты эктопического яичника требуют прецизионного внимания как со стороны акушеров-гинекологов, так и затрагивают интересы врачей смежных специальностей.



