Первая попытка реконструкции влагалища была предпринята двести лет назад, в 1817 году, когда французский хирург Гийом Дюпюитрен (фр. Guillaume Dupuytren) впервые провел операцию пациентке с агенезией мюллеровых протоков [1]. В настоящее время хирургический кольпопоэз выполняют, прежде всего, при врожденной аплазии влагалища и матки – синдроме Майера–Рокитанского–Кюстнера–Мюллера–Хаусера, частота которого составляет 1 случай на 4000–5000 новорожденных девочек. Также операция может быть показана пациенткам с травматическим повреждением влагалища или его удалением в результате онкологических заболеваний [2].
За прошедшее время было разработано около двадцати методов кольпопоэза, в том числе с использованием аутотканей – тазовой брюшины, кожи, сигмовидной кишки и др. Данные операции являются травматичными, обладают высоким риском возникновения осложнений в послеоперационном периоде (рубцовые изменения влагалища, слизистые выделения, кровотечение, болевой синдром) и не всегда сопровождаются выраженным и продолжительным эффектом [2, 3].
В литературе также описаны результаты исследований с использованием аллогенных и ксеногенных материалов – децеллюляризированной амниотической мембраны, дермы, подслизистой оболочки тонкой кишки, матрикса влагалища [3, 4]. К несомненным достоинствам данных биоматериалов следует отнести их высокую биосовместимость, к недостаткам – значительное снижение механической прочности ткани после трансплантации, структурное и функциональное несоответствие ткани влагалища, опасность переноса вирусных и прионных заболеваний, отсутствие стандартизации вследствие использования различных протоколов децеллюляризации и высокую стоимость [5].
Развитие тканевой инженерии позволило значительно расширить возможности создания артифициальных органов, в том числе и влагалища. Пионером в этой области является Энтони Атала (Anthony Atala), под чьим руководством еще в 2003 году было создано искусственное влагалище на основе полигликолидного матрикса, заселенного эпителиальными и гладкомышечными клетками влагалища кролика [6]. В 2014 году были опубликованы результаты пилотного клинического исследования с использованием аутогенных клеток человека [7]. Важно заметить, что в данном исследовании в качестве носителя была использована подслизистая оболочка тонкой кишки свиньи, а не полигликолидный матрикс. Возможно, эта замена связана со слишком быстрым сроком резорбции полигликолидного матрикса in vivo и несоответствием его структуры строению нативной ткани, что оставляет открытым вопрос о выборе оптимального носителя для инженерии влагалища.
С нашей точки зрения перспективным материалом для тканевой инженерии влагалища может стать поликапролактон, биосовместимый и недорогой синтетический полимер, срок резорбции которого в организме значительно превышает показатели других алифатических полиэфиров – полилактидов и полигликолидов. С помощью технологии электроформования (электроспиннинга) из поликапролактона можно изготовить волокнистый материал с заданными структурными и биомеханическими свойствами, максимально близкими к матриксу нативной ткани [8]. Продемонстрирована возможность использования такого материала для тканевой инженерии объемных дермальных эквивалентов [9], кровеносных сосудов [10], связок [11] и других органов. Первым этапом всех подобных исследований является моделирование артифициального органа in vitro, результатом которого становится оценка биосовместимости матрикса, выбор метода соединения компонентов тканеинженерной конструкции, верификация соответствия полученной конструкции структуре моделируемого органа.
Целью настоящей работы стало получение тканеинженерной конструкции на основе поликапролактонового носителя, эпителиальных и стромальных клеток человека для создания искусственного влагалища.
Материал и методы исследования
Получение и характеристика первичной культуры эпителиальных клеток влагалища человека
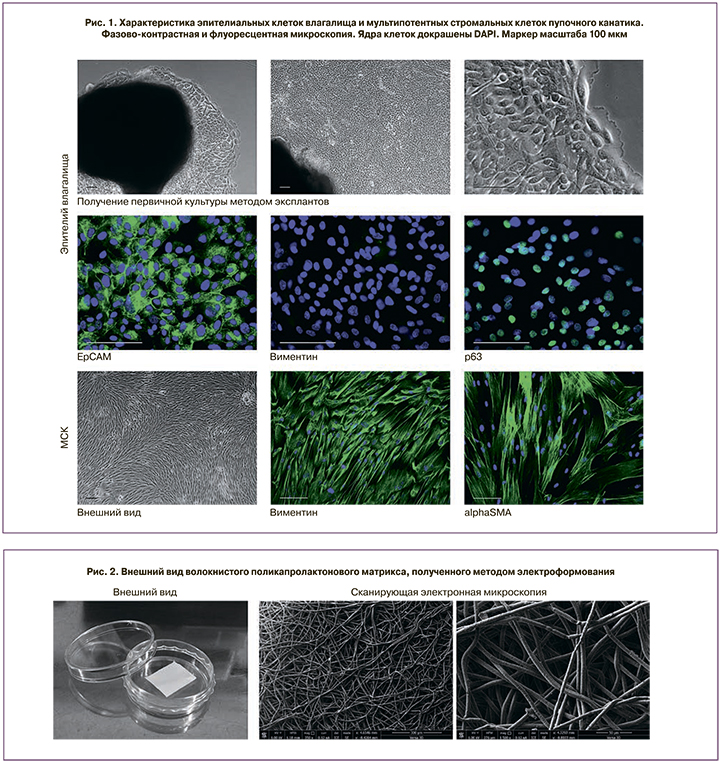
Для получения культуры эпителиальных клеток влагалища проводили поверхностную биопсию (5×5 мм) стенки влагалища женщин репродуктивного возраста (n=4). Первичную культуру выделяли методом эксплантов. Клетки культивировали в среде 199 (ПанЭко, Россия), содержащей 10% эмбриональной телячьей сыворотки (PAA, США) и 1% культуральной добавки для роста эпителия молочной железы человека (Thermo Fisher Scientific, США).
Чистоту выделения эпителиальных клеток подтверждали с помощью иммуноцитохимического окрашивания с антителами к молекуле клеточной адгезии эпителия EpCAM (Santa Cruz Biotechnology, США) и виментину (Abcam, США). Экспрессию маркера клеток базального слоя эпителия выявляли при окрашивании с антителами к р63 (Abcam, США).
Получение и характеристика культуры мультипотентных стромальных клеток человека
В качестве стромальных клеток для заселения конструкции использовали мультипотентные стромальные клетки (МСК), выделенные из интерваскулярной стромы пупочного канатика человека ферментативным методом. Клетки культивировали в среде DMEM/F12 (ПанЭко, Россия), содержащей 10% эмбриональной телячьей сыворотки (PAA, США).
Специфическую экспрессию белков цитоскелета подтверждали с помощью иммуноцитохимического окрашивания с антителами к виментину (Abcam, США) и гладкомышечному актину αSMA (Abcam, США).
Получение и характеристика поликапролактонового матрикса
Волокнистый материал на основе поликапролактона (Mn 80 кДа, Sigma-Aldrich, США) получали методом электроформования. Морфологию поверхности материала изучали с помощью сканирующего электронно-ионного микроскопа Versa 3D DualBeam (FEI, США) в режиме высокого вакуума с использованием ICE-детектора вторичных электронов. Диаметр волокон определяли с помощью программы ScopePhoto Image Software (ScopeTek, Китай). Исследования механических характеристик матрикса проводили на разрывной машине Инстрон-5965 (Instron, США).
Оценка цитотоксичности поликапролактонового матрикса
Цитотоксичность матрикса оценивали с помощью колориметрического МТТ-теста и метода прямого контакта с использованием кальцеина-АМ и йодида пропидия (Santa Cruz Biotechnology, США).
Создание тканеинженерной конструкции
Непосредственно перед заселением носителя эпителиальные клетки метили витальным красителем РКН67 (свечение в зеленой области спектра), а МСК – красителем РКН26 (свечение в желто-оранжевой области спектра) (SigmaAldrich, США). После отмывки красителя клетки ресуспендировали в ростовой среде до конечной концентрации 1×106 клеток в 1 мл. Для равномерного заселения стромальными клетками всей толщи конструкции использовали капиллярный метод, для заселения эпителиальными клетками поверхностного слоя конструкции – статичный метод [12].
Через 48 часов проводили прижизненную съемку поверхности заселенных образцов с помощью флуоресцентного микроскопа Leica DM 4000 B (Leica Microsystems, Германия). Далее края конструкции соединяли в виде полого цилиндра, переносили в среду для заключения Tissue-Tek OCT Compound (Sakura Finetek, США) и замораживали при -70°С. Для визуализации клеток на поперечных криосрезах использовали совмещенные изображения флуоресцентной и темнопольной микроскопии. Морфометрическое исследование проводили с помощью программного обеспечения LAS AF v.3.1.0 build 8587 (Leica Microsystems, Германия).
Результаты и обсуждение
Получение и характеристика первичной культуры эпителиальных клеток влагалища человека
Получение первичной культуры эпителиальных клеток влагалища оказалось одним из наиболее трудных этапов исследования. Большинство описанных ферментативных методик изолирования клеток из биоматериала были малоэффективны и приводили к появлению гетерогенных культур, что подтверждают результаты других исследователей, работавших с эпителиальными клетками влагалища и шейки матки [13, 14].

При использовании метода эксплантов миграция клеток из прикрепленных к подложке фрагментов ткани начиналась на 3–5-е сутки культивирования, а на 7–10-е сутки плотный монослой клеток покрывал всю поверхность лунки культурального планшета (рис. 1). Иммуноцитохимическое окрашивание выявило экспрессию эпителиального маркера EpCAM и не обнаружило экспрессию маркера клеток мезенхимального происхождения виментина. Важно заметить, что 68,8±5,0% всех клеток экспрессировали маркер р63 (рис. 1), который характерен для базального слоя эпителия влагалища и шейки матки, но не эпителия матки [15]. Данный маркер экспрессируется также клетками базального слоя буккального эпителия [16], что гипотетически делает возможным использование этого доступного аутогенного многослойного плоского эпителия для тканевой инженерии влагалища при полной аплазии органа и, соответственно, отсутствии аутогенного эпителия влагалища.
Получение и характеристика культуры мультипотентных стромальных клеток человека
В качестве клеток стромы искусственного влагалища можно использовать аутогенные гладкомышечные клетки стенки самого органа (при его сохранности) [5, 7]. Для этого требуется проведение глубокой биопсии, поэтому в нашем пилотном эксперименте гладкомышечные клетки были заменены на МСК пупочного канатика, имеющие сходный фенотип. В цитоскелете МСК присутствуют виментиновые промежуточные филаменты, характерные для клеток мезенхимального происхождения, а также пучки микрофиламентов, состоящие из гладкомышечного актина α (рис. 1), что позволяет использовать по отношению к ним термин «миофибробластоподобные стромальные клетки» (англ. myofibroblast-like stromal cells) [17]. Заселение имплантатов МСК стимулирует их васкуляризацию и интеграцию с окружающими тканями за счет активации прорегенераторных М2 макрофагов в области трансплантации [18], поэтому использование доступных аутогенных МСК для тканевой инженерии влагалища наравне с гладкомышечными клетками может значительно повысить биосовместимость конструкции.
Получение и характеристика поликапролактонового матрикса
Поликапролактоновый матрикс представляет собой пластину белого цвета с хорошими манипулятивными свойствами: материал можно резать, сгибать, сшивать и т.п. На электронной сканирующей микрофотографии видна волокнистая структура материала (рис. 2), напоминающая децеллюляризированный матрикс ткани. Сравнительная характеристика этих двух материалов представлена в таблице.
Как видно из таблицы, поликапролактоновый матрикс имеет сходное с внеклеточным матриксом строение, однако значительно уступает по показателю механической прочности. При этом следует учитывать, что прочность биологических протезов значительно падает даже при увлажнении материала (например, для однослойной подслизистой оболочки тонкой кишки этот показатель уменьшается с 20,6 МПа до 7,2 МПа [20]), а также в процессе ремоделирования in vivo (для восьмислойной субмукозы падение прочности может достигать 50% за 10 дней) [21].
Прочность синтетического матрикса снижается значительно медленнее: на первом, достаточно длительном, этапе разрушения поликапролактона происходит постепенное уменьшение молекулярной массы полимера без изменения его физико-механических свойств и деформации конструкции [19].
Проведенные исследования показали полное отсутствие цитотоксических свойств поликапролактона: материал не влиял на динамику роста клеточных культур и не приводил к гибели адгезированных на его поверхности клеток.
Таким образом, нетканый поликапролактоновый матрикс, обладая сходными с матриксом нативной ткани структурными свойствами, имеет ряд важных преимуществ: длительный срок биорезорбции, который можно регулировать за счет изменения молекулярной массы полимера, пролонгированную механическую прочность in vivo, отсутствие токсичных продуктов распада, низкую иммуногенность. Поликапролактон одобрен FDA для биомедицинского применения [19].
Создание тканеинженерной конструкции
После заселения стромальные клетки, несущие метку РКН26, были равномерно распределены в матриксе толщиной 1500 мкм. Эпителиальные клетки, несущие метку РКН67, располагались плотным пластом на внутренней поверхности конструкции, погружаясь на глубину 88,9±32,5 мкм (рис. 3), что приблизительно равно суммарной толщине базального и промежуточного слоев эпителия влагалища. Таким образом, полученная конструкция близка по своей архитектонике и клеточному составу нативному влагалищу. Эффективность данной конструкции для тканевой инженерии влагалища будет изучена в дальнейших экспериментах in vivo.
Заключение
Полученная в нашем исследовании конструкция для пластики влагалища на основе поликапролактонового волокнистого материала, сходного по строению с внеклеточным матриксом ткани, обеспечивает эффективное заселение стромальных и эпителиальных клеток и может рассматриваться как основа для тканевой инженерии любого трубчатого органа. В зависимости от задачи можно подбирать клеточный состав, изменять толщину слоя и ориентацию клеток в пространстве, задавая направление волокон и физико-механические свойства матрикса в процессе формирования материала. Развитие клеточных технологий, материаловедения и тканевой инженерии делает возможным создание биосовместимых искусственных органов человека и прорыв в области регенеративной медицины.



