Задержка роста плода (ЗРП) остается актуальной проблемой акушерства и перинатологии, являясь одной из основных причин перинатальной заболеваемости и смертности, а также отдаленных осложнений [1–4]. ЗРП осложняет от 10 до 15% всех беременностей – это потенциальная причина преждевременных родов, преэклампсии (ПЭ) и мертворождений. ЗРП характеризуются высоким риском развития неблагоприятных исходов как в неонатальном периоде, так и в отдаленном будущем. Наиболее значимым ранним последствием является высокая перинатальная смертность у доношенных и недоношенных детей.
Дети, рожденные с дефицитом веса при рождении, имеют высокий риск перинатальной заболеваемости. К ранним осложнениям относят: гипоксию и асфиксию новорожденных, атрофию тимуса и длительную иммунологическую недостаточность, обусловленную гипогаммаглобулинемией, склонность к гипотермии, гипербилирубинемию, высокий риск гипогликемии, развитие некротизирующего энтероколита, ретинопатии новорожденных, частое развитие коагулопатии – описаны случаи тяжелого легочного кровотечения у таких детей [4, 5]. Для ЗРП характерно увеличение риска развития респираторного дистресс-синдрома и бронхолегочной дисплазии, частоты применения искусственной вентиляции легких [6]. Немаловажной отдаленной проблемой детей, малых к сроку гестации, является церебральный паралич, развитие инвалидности в детстве, нарушение роста, задержка неврологического и интеллектуального развития.
Давно признано, что последствия ЗРП могут длиться всю жизнь. Они не только повышают риск неблагоприятного перинатального исхода, но и имеют серьезные отдаленные последствия. Показано, что на протяжении взрослой жизни многократно повышен риск преждевременной смерти, нарушений мозгового кровообращения, серьезных сердечно-сосудистых заболеваний и метаболических нарушений [7, 8].
На сегодняшний день ни в отечественных источниках, ни в зарубежных руководствах нет единого взгляда на классификацию ЗРП. Одним из наиболее распространенных является выделение ранней и поздней формы ЗРП в зависимости от гестационного срока, когда она была диагностирована. Пороговым общепризнан срок 32 недели беременности [2].
Основная сложность в ведении беременности с ранней ЗРП – это контроль за состоянием плода и выбор оптимального метода и срока родоразрешения. То есть баланс между преждевременным родоразрешением и рождением недоношенного новорожденного с всеми осложнениями недоношенности, а с другой стороны – при пролонгировании беременности существенно повышается риск антенатальной гибели плода и серьезного гипоксического повреждения головного мозга в условиях плацентарной недостаточности.
Поиск актуальных маркеров, отражающих состояние плода, и помогающих в принятии клинического решения – актуальная задача, решению которой посвящено наше исследование.
В последние годы появилось множество данных, подтверждающих, что задержка роста плода вызвана дисбалансом в высвобождении в материнский кровоток плацентарных регулирующих факторов ангиогенеза, характеризующимся повышенными концентрациями антиангиогенных факторов, таких как растворимая fms-подобная тирозинкиназа 1 (sFlt-1, также обозначаемый как sVEGFR-1), и снижением концентрации проангиогенных факторов, таких как фактор роста плаценты (PlGF) [9], которые непосредственно участвуют в патогенезе ЗРП.
В настоящее время диагностические критерии и методы контроля основываются на ультразвуковом исследовании, допплерометрии и КТГ-мониторировании.
Но эта стратегия игнорирует основной патологический процесс в плаценте, который приводит к неадекватному снабжению растущего плода кислородом и нутриентами.
Следовательно, эти диагностические ограничения могут привести к распознаванию ЗРП на поздней стадии заболевания, препятствуя его ранней диагностике, оптимальному лечению и потенциально приводя к серьезным осложнениям для плода.
Целью данного исследования было установление пороговых значений ангиогенных маркеров (sFlt-1, PlGF и их соотношения) для прогнозирования ухудшения состояние плода при его задержке роста. Установленные пороговые величины позволят определить объем и частоту УЗ-исследования, допплер-исследования и КТГ-мониторинга, а также определить оптимальный срок родоразрешения.
Материалы и методы
Проведено проспективное обследование 80 беременных. Исследование проводилось на базе Перинатального Центра ГБУЗ «ГКБ им. С.С. Юдина ДЗМ».
Информированное согласие получено от каждой женщины для участия в исследовании и забора проб венозной крови.
Исследование было одобрено Локальным комитетом по этике ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет) от 23.01.2019 г., выписка из протокола № 01-19.
Основную группу составили 45 пациенток с ранней формой ЗРП. Критериями включения явились пациентки в возрасте старше 18 лет с одноплодной беременностью в сроке гестации от 20 недель до 36 недель и 6 дней с отягощенным течением данной беременности в виде ЗРП. ЗРП диагностировалась по снижению предполагаемой массы плода (ПМП) меньше 10 перцентили и нарушению кровотока в АП (повышение PI в АП).
Группу контроля составили 35 пациенток в возрасте старше 18 лет с одноплодной беременностью в сроке гестации от 20 недель до 36 недель и 6 дней с физиологическим течением беременности.
Критерии невключения пациенток в исследование: возраст младше 18 лет, многоплодная беременность, курение, биохимические маркеры и УЗ-маркеры хромосомных аномалий в I и II триместрах беременности, наличие ПЭ (использованы критерии клинических рекомендаций МЗ РФ «Гипертензивные осложнения во время беременности, родов и послеродового периода. Преэклампсия. Эклампсия» от 07 июня 2016 г. № 15-4/10/2-3483).
Критерии исключения пациенток из исследования: отказ от дальнейшего участия в исследовании.
Всем пациенткам произведен забор венозной крови с целью определения концентрации ангиогенных факторов в сыворотке – sFlt-1, PlGF и соотношения sFlt-1/PlGF. Взятие дополнительной крови из локтевой вены проводилось во время стандартной процедуры забора крови. Образцы крови помещали в стерильные пробирки при температуре 4°С и центрифугировали в течение 10 мин при 3000 оборотах. После этого образцы сыворотки хранили при -40°С до анализа.
Уровни sFlt-1 и PlGF определяли в лаборатории клинической биохимии НМИЦ им Н.Н. Блохина, используя специфические и чувствительные иммуноферментные анализы Human PlGF и Human VEGF R1/Flt-1 Quantikine ELISA Kit производителя R&D Systems, USA.
Статистический анализ
Статистический анализ проводился с использованием программы IBM SPSS Statistics 26.0. Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро–Уилка. Для описания количественных величин, имеющих нормальное распределение, использовались средние арифметических величины (M) и стандартное отклонение (SD). В случае отсутствия нормального распределения количественные данные описывались в виде медианы (Me) и интерквартильного размаха (Q1; Q3).
Сравнение двух групп по количественному показателю, имеющему нормальное распределение при условии равенства дисперсий, выполнялось с помощью t-критерия Стьюдента, при неравных дисперсиях выполнялось с помощью t-критерия Уэлча. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна–Уитни.
Сравнение трех и более групп по количественному показателю, имеющему нормальное распределение, выполнялось с помощью однофакторного дисперсионного анализа, апостериорные сравнения проводились с помощью критерия Геймса-Хауэлла (при неравных дисперсиях). Сравнение трех и более групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью критерия Краскела–Уоллиса, апостериорные сравнения – с помощью критерия Данна.
Категориальные данные описывались с указанием абсолютных значений и процентных долей.
Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполнялось с помощью точного критерия Фишера (при значениях ожидаемого явления менее 10). Сравнение процентных долей при анализе многопольных таблиц сопряженности выполнялось с помощью χ2 Пирсона.
Различия показателей считали статистически значимыми при p<0,05.
Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода применялся метод анализа ROC-кривых. С его помощью определялось оптимальное разделяющее значение количественного признака, позволяющее классифицировать пациентов по степени риска исхода, обладающее наилучшим сочетанием чувствительности и специфичности. Качество прогностической модели, полученной данным методом, оценивалось исходя из значений площади под ROC-кривой со стандартной ошибкой и 95% доверительным интервалом (ДИ) и уровня статистической значимости. Для расчета 95% ДИ долей был использован откорректированный метод Вальда.
Результаты
С целью оценки значений ангиогенных факторов для прогнозирования течения ранней задержки роста плода нами проанализировано 45 беременных основной группы и 35 женщин группы контроля.
Средний возраст беременных в основной группе составил 30,95 (5,07) и был статистически значимо выше среднего возраста беременных в контрольной группе – 27,37 (4,9) лет (p=0,033). По соматическому, акушерско-гинекологическому статусу, паритету родов и ИМТ пациентки изучаемых групп оказались сравнимы. При анализе лабораторных показателей клинического, биохимического анализа крови, общего анализа мочи существенных различий выявлено не было.
Cрок беременности на момент оценки ангиогенных маркеров в основной группе составила 30,5 (28,5; 33,5) недель, в группе контроля – 31,5 (26,5; 34,5) недель (p=0,644).
В зависимости от клинического течения и исхода беременности основная группа была разделена на 2 подгруппы.
Первую подгруппу (IA – 24/45 (53,33%) женщин) составили беременные без ухудшения состояния плода по данным допплерометрии и КТГ-мониторирования, и которым удалось пролонгировать беременность до доношенного срока. Срок беременности на момент родов составил 38,2 (0,63) недель.
Во вторую подгруппу (IB – 21/45 (46,67%) женщин) вошли пациентки, у которых отмечено ухудшение состояния плода, проявляющееся в ухудшении кровотока в АП: нарастанием PI вплоть до отсутствия конечного диастолического кровотока в АП, признаками централизации артериального кровотока плода (снижением ЦПО и снижением PI в СМА), отсутствием прироста фетометрических показателей по данным УЗИ и появлением сомнительного или патологического типа КТГ-мониторинга. Данные показатели потребовали досрочного родоразрешения по перинатальным показаниям. Срок беременности на момент родоразрешения в этой подгруппе составил 29,11 (4,04) недель, что статистически значимо меньше, чем в подгруппе IA (p<0,001).
Частота преждевременных родов в подгруппе IB составила 100%. Все роды в подгруппе IA и контрольной группе были своевременными.
Частота операций кесарева сечения в подгруппе IB статистически значимо больше по сравнению со подгруппой IA и группой контроля – 19/21 (90,48%), 5/24 (20,83%) и 4/35 (11,43%) соответственно (p<0,001, pIB-контроль<0,001, pIB-IA=0,022).
Всем беременным подгруппы IB операцию кесарева сечения проводили в экстренном порядке, по сравнению с подгруппой IA и группой контроля, где операцию кесарева сечения всем беременным выполняли в плановом порядке.
Средняя масса детей при рождении в подгруппе IA составила 2736,2 (125,5) г, в подгруппе IB – 946,67 (539,21) г, в группе контроля – 3475,26 (203,56) г. Были выявлены статистически значимые различия (p<0,001, pIA-контроль <0,001, pIB-контроль <0,001, pIB-IA <0,001).
В подгруппе IA оценка новорожденных по шкале Апгар на 1-й минуте составила 7 (7;8) баллов, в подгруппе IB – 6 (5;6) баллов, в группе контроля – 8 (8; 8) баллов. Различия показателей были статистически значимы (p<0,001, pIA-контроль <0,016, pIB-контроль <0,001, pIB-IA <0,013). Оценка новорожденных по шкале Апгар на 5й минуте составила в подгруппе IA – 8 (8; 9) баллов, в подгруппе IB – 7 (6; 7) баллов и в группе контроля – 9 (9; 9) баллов. Были установлена статистически значимые различия (p<0,001, pIA-контроль<0,023, pIB-контроль <0,001, pIB-IA <0,006).
В исследуемых группах нами проведена оценка концентрации ангиогенных факторов в сыворотке крови – sFlt-1, PlGF и их соотношения (таблица).
В подгруппе IA – у женщин со стабильным состоянием плода – концентрация sFlt-1 составила 54305 пг/мл (12 352;102 394) (рис. 1), PlGF – 82,67 пг/мл (61,03;101,6) (рис. 2), соотношение sFlt-1/PlGF – 852,44 (161,6;1015,2) (рис. 3).
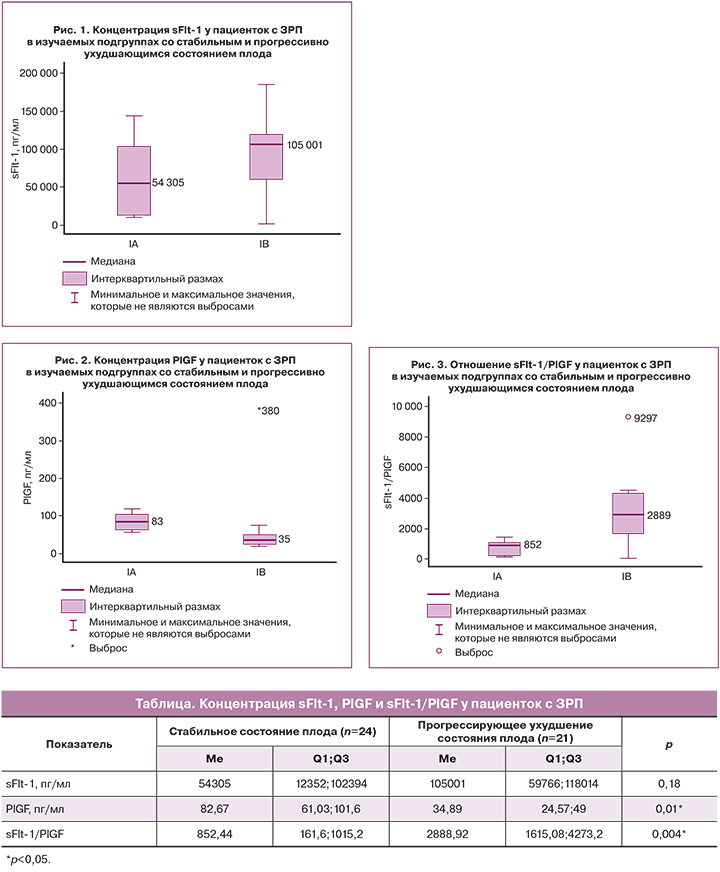
В подгруппе IB – у пациенток с прогрессирующим ухудшением состояния плода – концентрация sFlt-1 составила 105001 пг/мл (59766;118014) (рис. 1), PlGF – 34,89 пг/мл (24,57; 49) (рис. 2), соотношение sFlt-1/PlGF – 2888,92 (1615,08;4273,2) (рис. 3).
Концентрация sFlt-1 у беременных с физиологическим течением беременности составила 11860 пг/мл (6420;15 720), PlGF – 705 пг/мл (324,6;951), sFlt-1/PlGF – 19,1 (7,43; 9,44).
При анализе полученных результатов следует отметить, что разница по концентрации sFlt-1 оказалась статистически незначимой (p=0,18), а по концентрации PlGF и соотношению sFlt-1/PlGF мы получили статистически значимые различия (p=0,01 и p=0,004 соответственно).
Поскольку установлено, что концентрации PlGF и sFlt-1/PlGF статистически значимо отличались в исследуемых подгруппах, нами проведен ROC-анализ с целью определения пороговых величин для прогнозирования декомпенсации ЗРП.
Площадь под ROC-кривой (рис. 4), соответствующей взаимосвязи прогноза ухудшения состояния плода при ЗРП и PlGF, составила 0,844 (0,110) с 95% ДИ: 0,628–1,000. Полученная модель была статистически значимой (p=0,011).
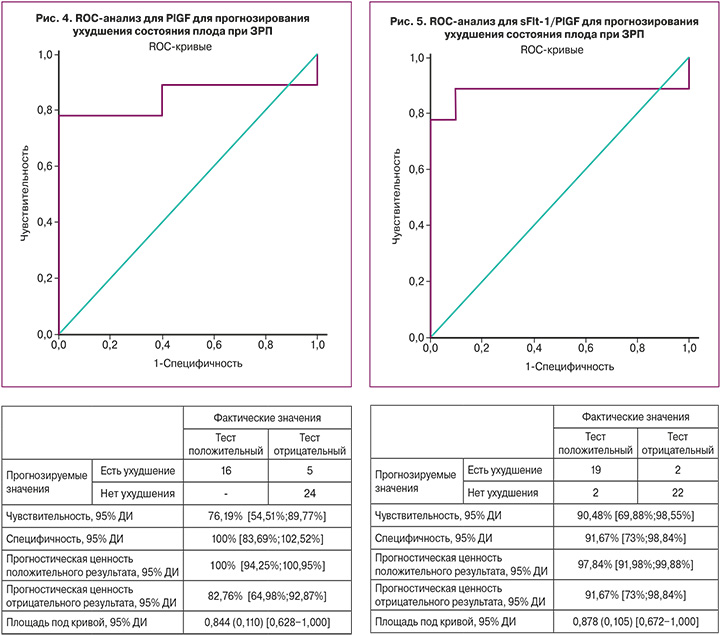
Пороговое значение PlGF в точке cut-off равно 52,7 пг/мл. При уровне PlGF, менее или равном данному значению, прогнозировался высокий риск ухудшения состояния плода. Чувствительность и специфичность метода составили 76,19% и 100% соответственно.
Площадь под ROC-кривой (рис. 5), соответствующей взаимосвязи прогноза ухудшения состояния плода и sFlt-1/PlGF, составила 0,878 (0,105) с 95% ДИ: 0,672–1,000. Полученная модель была статистически значимой (p=0,006).
Пороговое значение sFlt-1/PlGF в точке cut-off равно 1118,12. При уровне sFlt-1/PlGF, равном или превышающем данное значение, прогнозировался высокий риск ухудшения состояния плода ЗРП. Чувствительность и специфичность метода составили 90,48 и 91,67% соответственно.
Таким образом, результаты нашего исследования показали, что при стабильном и прогрессивно ухудшающемся состоянии плода при ЗРП имеются статистически значимые различия по концентрации PlGF и соотношению sFlt-1/PlGF.
Следовательно, данные маркеры могут быть использованы для прогнозирования состояния плода при его задержке роста.
Результат проведенного ROC-анализа показал, что пороговой величиной, указывающей на высокий риск ухудшения состояние плода при ЗРП и неблагоприятного перинатального исхода, является для PlGF – 52,7 пг/мл, для sFlt-1/PlGF – 1118,12.
Обсуждение
Несмотря на то что этиология ЗРП до конца не выяснена, общепринято, что это состояние вызвано дефектом в инвазии трофобласта и нарушением ремоделирования спиральных артерий в первой половине беременности, что приводит к недостаточной плацентарной перфузии во второй ее половине.
Период инвазии трофобласта является основным фактором, определяющим качество плацентарной имплантации, поскольку именно в этот период спиральные артерии трансформируются в сосуды с низким сопротивлением. Неполное ремоделирование спиральных артерий препятствует адекватному кровотоку в межворсинчатом пространстве, поскольку сохраняются сократительные свойства артерий. Это приводит к появлению феномена гипоперфузии-реперфузии, который, в свою очередь, вызывает повреждение архитектуры ворсинок и нарушение обмена между матерью и плодом, что в конечном итоге приводит к ЗРП [10].
Более десяти лет назад циркулирующим токсином, выделяемым ишемизированной плацентой, который, по-видимому, вносит существенный вклад в механизмы материнской эндотелиальной дисфункции, была признана растворимая fms-подобная тирозинкиназа (sFlt-1) – антиангиогенный белок плацентарного происхождения, который является ключевым в регуляции ангиогенного гомеостаза при беременности [11]. Было показано, что он заметно повышен при ЗРП, особенно в тех случаях, которые появляются на ранних сроках беременности. sFlt-1 представляет собой растворимый усеченный вариант рецептора Flt-1, в котором отсутствуют цитоплазматический и трансмембранный домен, но сохраняется лиганд-связывающий домен. Flt-1 (или VEGFR-1) представляет собой рецептор семейства факторов роста эндотелия сосудов, присутствующий на мембранах эндотелиальных клеток сосудов, который также экспрессируется в плаценте, в основном синцитиотрофобластом. Flt-1, а также рецептор, содержащий домен киназы-вставки (KDR или VEGFR-2), обладают высоким сродством к сосудистому эндотелиальному фактору роста-A (VEGF-A), который является важным фактором, участвующим в развитии плацентарных сосудов, пролиферации и выживаемости эндотелиальных клеток, проницаемости сосудов и фенестрации эндотелиальных клеток.
PlGF является членом семейства VEGF, обладает проангиогенной активностью и обильно экспрессируется в плаценте. Он связывается с Flt-1, но не с KDR, и действует, усиливая эффект VEGF-A [12].
В ответ на возникающую при ЗРП гипоксию генерируется альтернативный сплайсинг гена Flt-1 в форме мРНК sFlt-1, и sFlt-1 продуцируется и секретируется плацентой в материнский кровоток, вызывая снижение биодоступности проангиогенных факторов VEGF и PLGF путем связывания с ними, тем самым еще больше усугубляя дисбаланс в сторону антиангиогенного состояния.
По изучению роли ангиогенных маркеров при изолированной ЗРП в современной литературе, посвященной перинатологии, работ мало, большинство из них посвящено изучению беременности, осложненной ПЭ.
В период с 2010 г. по 2014 г. было проведено многоцентровое, проспективное, двойное слепое и неинвазивное исследование PROGNOSIS, в котором было обследовано более 1270 беременных в 30 медицинских учреждениях из 14 стран мира. Целью исследования явилось определение значения соотношения sFlt-1/PlGF для прогнозирования наличия или отсутствия ПЭ в краткосрочной перспективе. Было уточнено могут ли низкие отношения sFlt-1/PlGF прогнозировать отсутствие ПЭ в течение 1 недели после первого посещения, а также могут ли высокие отношения прогнозировать развитие ПЭ в течение 4 недель. Исследователи показали, что соотношение sFlt-1/PlGF, равное или меньше 38, являлось прогностическим фактором отсутствия в течение 1 недели ПЭ у женщин, у которых синдром подозревается клинически, а также являлось предиктором отсутствия наблагоприятных исходов для плода (перинатальная смертность, родоразрешение в сроке менее 34 недель, задержка роста плода, отслойка плаценты, респираторный дистресс-синдром, некротический энтероколит и внутрижелудочковое кровоизлияние) в течение 1 недели, в то время как sFlt-1/PlGF >38 прогнозировало развитие ПЭ и наличие этих неблагоприятных исходов в течение 4 недель [13].
Поскольку ЗРП тоже имеет плацентогенную природу и является плацента-ассоциированным осложнением, нами проведено исследование по изучению этих маркеров при ранней форме ЗРП. Следует отметить, что в основном работы по ЗРП все ассоциированы с ПЭ, а нами предпринята оценка осложнений беременности без явных проявлений ПЭ.
Результаты нашего исследования показали, что ангиогенные маркеры имеют статистически значимые различия в двух подгруппах ЗРП в зависимости от состояния плода. Так, при уровне PlGF ≥52,7 пг/мл и уровне sFlt-1/PlGF ≥1118,12 прогнозировался высокий риск ухудшения состояния плода при ЗРП. Таким образом, данные маркеры могут выступать в качестве лабораторного предиктора течения ранней формы ЗРП.
При анализе литературы по данной тематике аналогов нашему исследованию не было.
Из имеющихся на сегодня исследований следует отметить, что в работе Макарова О.В. и соавт. [14] проведено исследование по изучению основ плацентарного ангиогенеза, причин фетоплацентарной недостаточности и развития плода. Были обследованы пациентки с плацентарной недостаточностью (ПН) и ЗРП и пациентки с физиологическим течением беременности. Авторы определили у них ангиогенные факторы и выявили статистически значимые различия по концентрации ангиогенных факторов в сыворотке крови у пациенток с ПН и ЗРП по сравнению со здоровыми беременными. Таким образом, пришли к выводу, что ПН характеризуется нарушением баланса ангиогенных факторов, увеличением уровня антиангиогенных факторов и снижением уровня проангиогенного фактора.
Заключение
Таким образом, проведенное нами исследование показало обоснованность использования изученных ангиогенных маркеров у беременных с ранней формой ЗРП. Полученные результаты обладают практической значимостью и позволяют рекомендовать использование данных маркеров в практическом здравоохранении, так как установленные пороговые величины дают возможность определять объем и частоту диагностических исследований (УЗИ, допплер, КТГ-мониторинг), а также определять оптимальный срок родоразрешения с целью улучшения перинатальных исходов.
Из минусов собственной работы следует отметить пока недостаточную выборку. Но проведенное нами пилотное исследование направлено на подтверждение гипотезы о возможном клиническом применении ангиогенных маркеров и их соотношения для тактики ведения беременных с ранней ЗРП. Для того чтобы дополнить клинические рекомендации по такой, пока не решенной проблеме, как ЗРП, требуется дальнейшее изучение этой тематики на более широкой выборке.
Перспективами дальнейших исследований может служить проведение многофакторного анализа сочетания клинических данных, факторов риска ЗРП, данных ультразвукового и допплер-исследования и ангиогенных маркеров.



