Персистирующие цервикальные инфекции, вызванные высоко онкогенными типами вируса папилломы человека (ВПЧ), играют ключевую роль в развитии рака шейки матки (РШМ) и определяют важность их выявления для предотвращения заболевания [1]. Основным методом скрининга РШМ и диагностики патологии шейки матки является PАР-тест, который обладает хорошей специфичностью, но относительно низкой чувствительностью [2]. Чувствительность цитологического исследования для выявления цервикальной интраэпителиальной неоплазии (ЦИН)2+ составляет 55–79% [3].
Значимым дополнением к РАР-тесту по данным литературы являются молекулярные методы скрининга и диагностики РШМ [4]. Однако их недостатком является ограниченная специфичность, так как они выявляют как транзиторную, так и персистирующую формы папилломавирусной инфекции. Известно, что транзиторная инфекция чаще выявляется у молодых женщин до 30 лет, а персистирующая – у женщин старше 30 лет, и коррелирует с ЦИН. На этом основании предлагают молекулярный тест, выявляющий присутствие в клетках шейки матки ДНК высоко онкогенных типов ВПЧ как первый метод скрининга РШМ у женщин старше 30 лет. Это может привести к гипердиагностике, поскольку присутствие вирусной ДНК в клиническом образце не означает наличие ЦИН1 –ЦИН3 или РШМ. На данный момент четыре теста, одобренных FDA, используются для выявления высоко онкогенных типов ДНК ВПЧ: Hybrid Capture 2 (Digene, Gaithersburg,MD,USA), Cervista HPV HR (Hologic, Madison, WI , USA), Aptima HPV assay (Hologic, USA) and Cobas HPV test (Roche Molecular Systems, Pleasanton CA, USA).
Целью данной работы была оценка диагностической значимости ВПЧ-тестирования, проведенного методом полимеразной цепной реакции в режиме реального времени (RT-PCR), жидкостной цитологии c РАР-тестом при ВПЧ-ассоциированной цервикальной патологии у женщин до 30 лет и старше.
 Материал и методы исследования
Материал и методы исследования
В данное исследование включены женщины (n=91), которые были выбраны из 4672 (в возрасте от 17 до 56 лет), проходивших обследование и лечение в ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава РФ в 2013 году. Пациентки были разделены на две группы по возрастному критерию: первую группу составили женщины до 30 лет включительно (n=35), вторую – женщины старше 30 лет (n=56).
Использовали общепринятый протокол: клинический осмотр, взятие мазков в SurePath виалы (BD, США), приготовление цитологических препаратов, окрашенных по Папаниколау, с помощью TriPath процессора (BD, США), оценка мазков по системе «Bethesda» [5]. Помимо цитологического анализа провели молекулярно-биологическое исследование с целью выявления и генотипирования ДНК ВПЧ на приборе Cobas 4800 с автоматизированной пробоподготовкой. Cobas test позволяет получить результаты по трем отдельным каналам: индивидуально ДНК ВПЧ16, ДНК ВПЧ18 и общий пул ДНК других 12 высоко онкогенных генотипов ВПЧ (31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 и 68) [6]. Главными преимуществами данного типа ВПЧ-тестирования являются обнаружение высокой вирусной нагрузки, имеющей клиническое значение и генотипирование, позволяющие выявлять женщин группы высокого онкогенного риска с ДНК ВПЧ 16-го и 18-го типов.
Кроме того, выполняли кольпоскопию с прицельным взятием биопсии измененных или подозрительных участков цервикального канала для гистологического, иммуногистохимического (ИГХ) исследований. У пациенток с диагнозом ЦИН2+ проводили конизацию шейки матки. Гистологический диагноз рассматривали как «золотой стандарт» для оценки эффективности ВПЧ-тестирования, жидкостной цитологии. Биопсийный и хирургический материал использовали для постановки ИГХ реакций для выявления экспрессии белков р16 (INK4A) и Ki-67 по методике, разработанной производителем (CINtec PLUS, Roche, Швейцария) [7].
Обработку результатов проводили с помощью ROC (receiver operating characteristic)-анализа [8]. ROC-кривая представляет собой график, позволяющий оценить качество выбранного метода, отображающий соотношение между долей верных положительных значений от общего числа положительных значений (истинно положительное значение, называемое чувствительностью метода) с долей ошибочных положительных значений от общего числа отрицательных значений (ложно положительный результат (ЛПР), величина (1-ЛПР) называется специфичностью метода). Количественную интерпретацию ROC дает показатель AUC (area under ROC curve, площадь под ROC-кривой) — площадь, ограниченная ROC-кривой и осью доли ложных положительных значений. Чем выше показатель AUC, тем качественнее метод, при этом значение 0,5 демонстрирует непригодность выбранного метода.
Результаты исследования и обсуждение
После проведения цитологического исследования мазков из цервикального канала H-SIL выявлен у 21 пациентки (5 женщин до 30 лет и 16 – после 30 лет), L-SIL – у 23 (10 и 13 соответственно), ASC-US – у 15 (7 и 8 соответственно) и NILM – у 32 (13 и 19 соответственно).
На следующем этапе провели выявление ДНК ВПЧ в цитологическом материале с помощью Сobas теста и сравнили полученные результаты с гистологическим заключением. Результаты ВПЧ-тестирования приведены в табл. 1.
В результате проведенных исследований ДНК ВПЧ обнаружили у 63 женщин из 91 (69,2%), а именно: у 25 из 35 женщин моложе 30 лет (71,4%) и у 38 из 56 пациенток старше 30 лет (67,9%). Полученные результаты подтверждают данные других исследователей [9] о том, что ВПЧ чаще встречается у молодых женщин.
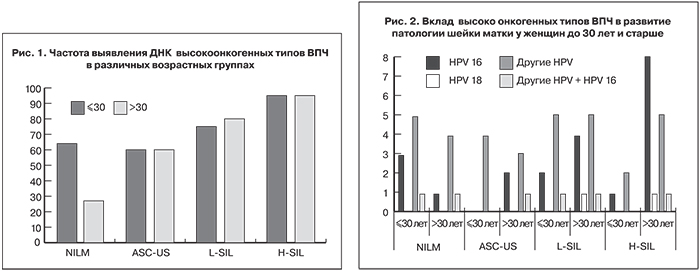
В материале с диагнозом NILM выявили ДНК ВПЧ в 15 образцах из 32 (46,9%): в 9 образцах из 13 – в группе пациенток 30 лет и моложе, и в 6 образцах из 19 (31,6%) – в группе пациенток старше 30 лет.
В образцах с ASC-US положительный результат получили в 10 из 15 случаев: в 4 образцах из 7 в группе пациенток 30 лет и моложе и в 6 из 8 – в группе пациенток старше 30 лет. По сравнению с NILM (46,9%) в мазках с ASC-US ДНК ВПЧ выявляется чаще (66,7%), что согласуется с вкладом данного инфекционного агента в развитие ЦИН.
В образцах с диагнозом L-SIL ВПЧ тест был положительным в 19 случаях из 23 (82,6%): в 8 образцах из 10 (80,0%) в группе пациенток 30 лет и моложе и в 11 из 13 (84,6%) – в группе пациенток старше 30 лет. В мазках с H-SIL ДНК ВПЧ обнаружили в 19 образцах из 21 (90,5%): в 4 образцах из 5 (80,0%) в группе пациенток 30 лет и моложе и в 15 из 16 (93,8%) в группе пациенток старше 30 лет. Полученные результаты делают очевидным тот факт, что после 30 лет частота выявления ДНК ВПЧ коррелирует с увеличением тяжести ЦИН и цитологическим диагнозом (рис. 1).
Из рис. 1 видно, что при отсутствии атипичных клеток в исследуемых образцах шейки матки (NILM) в группе женщин до 30 лет ДНК ВПЧ выявляется чаще, чем у более взрослых женщин, что можно объяснить временным присутствием вируса в организме, то есть его транзиторным характером, и требует от врача только наблюдения и противовирусной терапии.
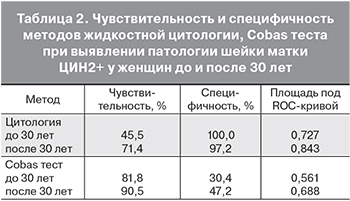 Частота развития ЦИН зависит и от типа вируса, что подтверждают данные литературы [10]. Результаты нашего исследования вклада различных высоко онкогенных типов ВПЧ в развитие ЦИН представлены на рисунках 2,3. В развитие патологии шейки матки высокой степени выраженности (H-SIL) весомый вклад вносит ВПЧ 16 типа (рис. 2). Этот тип ВПЧ обнаружили у 9 из 15 (60,0%) пациенток старше 30 лет. У женщин моложе 30 лет с H-SIL одинаково часто – 2 из 4 (50,%) выявляли суммарный пул двенадцати высоко онкогенных типов ВПЧ и ВПЧ 16-го типа. У женщин с L-SIL моложе 30 лет чаще – 5 из 8 (62,5%) выявляли двенадцать других высоко онкогенных типов ВПЧ. У пациенток старше 30 лет одинаково часто – 5 из 11 (45,5%) выявляли суммарный пул двенадцати высоко онкогенных типов ВПЧ и ВПЧ 16-го типа.
Частота развития ЦИН зависит и от типа вируса, что подтверждают данные литературы [10]. Результаты нашего исследования вклада различных высоко онкогенных типов ВПЧ в развитие ЦИН представлены на рисунках 2,3. В развитие патологии шейки матки высокой степени выраженности (H-SIL) весомый вклад вносит ВПЧ 16 типа (рис. 2). Этот тип ВПЧ обнаружили у 9 из 15 (60,0%) пациенток старше 30 лет. У женщин моложе 30 лет с H-SIL одинаково часто – 2 из 4 (50,%) выявляли суммарный пул двенадцати высоко онкогенных типов ВПЧ и ВПЧ 16-го типа. У женщин с L-SIL моложе 30 лет чаще – 5 из 8 (62,5%) выявляли двенадцать других высоко онкогенных типов ВПЧ. У пациенток старше 30 лет одинаково часто – 5 из 11 (45,5%) выявляли суммарный пул двенадцати высоко онкогенных типов ВПЧ и ВПЧ 16-го типа.
У всех 4 женщин моложе 30 лет с ASC-US обнаружили суммарный пул 12 типов ВПЧ; у более старших пациенток выявили с одинаковой частотой – 3 из 6 (50,0%) ДНК ВПЧ 16 и суммарный пул двенадцати высоко онкогенных типов ВПЧ. У всех женщин с NILM чаще выявляли двенадцать высоко онкогенных типов ВПЧ: в 5 из 9 случаев у молодых пациенток и в 4 из 6 случаев у женщин старше 30 лет.
При проведении исследования у женщин моложе 30 лет выявили вирусную ДНК 16-го типа, в том числе при отсутствии в цитологическом мазке атипичных клеток (NILM), что еще раз подтверждает необходимость проведения цитологического анализа наряду с молекулярным тестом (рис. 3А см. на вклейке).
У женщин старше 30 лет ДНК ВПЧ 16 обнаружили в мазках с различным цитологическим заключением, но с неодинаковой частотой; чаще ВПЧ 16-го типа встречался у женщин с H-SIL (рис. 3Б см. на вклейке). ДНК ВПЧ 18 выявили только у женщин старше 30 лет с L-SIL и H-SIL. Наличие данного молекулярного маркера патологии шейки матки у женщин позволяет отнести их в группу риска развития ЦИН.
Двенадцать других высоко онкогенных типов ВПЧ (31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 и 68) выявили у женщин моложе 30 лет с NILM (5 случаев), ASC-US (4 случая), L-SIL (5 случаев) и H-SIL (2 случая). У женщин старше 30 лет суммарный пул ДНК ВПЧ зарегистрировали у пациенток с NILM (4 случая), ASC-US (3 случая), L-SIL (5 случаев) и H-SIL (5 случаев). Сочетание ВПЧ 16 с другими двенадцатью высоко онкогенными типами ВПЧ у женщин моложе 30 лет наблюдали при NILM, L-SIL и H-SIL – по 1 случаю, у женщин старше 30 лет при NILM, ASC-US, L-SIL и H-SIL – по 1 случаю (табл. 2, рис. 3Б см. на вклейке).
Присутствие ВПЧ является основным, но не единственным фактором возникновения и развития ЦИН. Свой вклад в развитие заболевания вносят курение, раннее начало половой жизни, присутствие воспалительных процессов, вызванных различными инфекциями [11]. В связи с этим необходимо учитывать и морфологические изменения в шейке матки при ВПЧ-инфекции. Для определения чувствительности и специфичности ВПЧ-тестирования и морфологического метода у женщин до 30 лет и старше при выявлении цервикальной патологии ЦИН2+ использовали гистологическое и ИГХ заключения.
Хронический цервицит выявили в 36 образцах из 91 (39,6%). Он характеризовался лимфомакрофагальной инфильтрацией стромы ткани, часто с примесью плазматических клеток. В эпителии встречали признаки акантоза, гиперкератоза, клеточного полиморфизма. В 24 образцах (26,4%) обнаружили патологию шейки матки менее ЦИН2 со слабо выраженными изменениями строения эпителия при умеренной пролиферации базальных клеток. Морфологические признаки папилломавирусной инфекции характеризовались паракератозом, койлоцитозом, явлениями дискариоза и фигурами митозов. В 31 случае (34,1%) выявили ЦИН2+ с выраженными морфологическими изменениями шейки матки, которые охватывали свыше двух третей эпителия и характеризовались появлением патологических митозов, наличием многократно увеличенных (гиперхромных) ядер клеток. ИГХ исследование ЦИН2+ образцов показало повышенную экспрессию белка р16(INK4A) по всей глубине эпителиального слоя, а Ki67 – от 60 до 100% эпителиальных клеток шейки матки. При расчете чувствительности и специфичности методов диагностики при выявлении патологии шейки матки ЦИН2+ цитологические заключения NILM, ASC-US и L-SIL рассматривали как негативные результаты, а случаи с H-SIL – позитивные. Гистологический материал с ЦИН2 + оценивали как положительный, а с хроническим цервицитом и ЦИН1 рассматривали как отрицательный. Cobas тест считали положительным в случае обнаружения одного или более типов ДНК ВПЧ. Обработку результатов проводили с помощью ROC-анализа и полученные данные представили в табл. 2 и рис. 4А и 4Б.
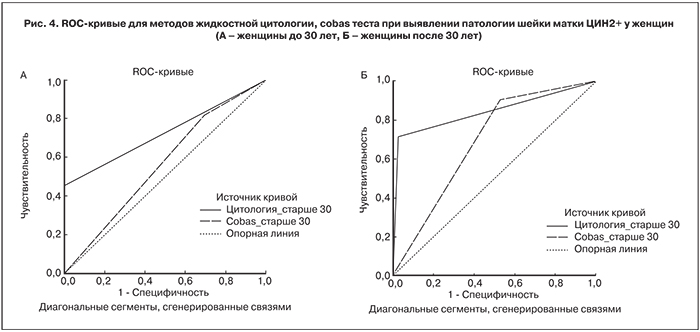
Из табл. 2 видно, что представленные методы выявления патологии шейки матки имеют значения, превышающие 0,5, и, следовательно, пригодны для решения поставленной задачи. При этом, значение AUC для цитологии (0,727 и 0,843) выше, чем для Cobas теста (0,561 и 0,688). Чувствительность цитологического метода исследования составила 45,5% у женщин моложе 30 лет и 71,1% у пациенток старше 30 лет. Чувствительность Сobas теста выше чувствительности цитологического анализа и составила 81,8% у женщин моложе 30 лет и 90,5% у пациенток старше 30 лет. Выявление ДНК ВПЧ может быть первым методом скрининга РШМ, так как метод имеет более высокую чувствительность, чем цитологический анализ и дает возможность выявить патологию шейки матки на ранних этапах, что защищает женщин от развития цервикального рака [12–15]. Однако выявление вирусной ДНК у пациентки не означает наличие заболевания. Это подтверждает специфичность молекулярных методов выявления патологии шейки матки, которая составляет 30,4% у женщин моложе 30 лет и 47,2% у более взрослых пациенток и ниже специфичности цитологического анализа – 100,0 и 97,2%.
Эффективность метода выявления патологии – это совокупность чувствительности и специфичности. Наше исследование показало, что для молодых женщин до 30 лет цитологический метод исследования более специфичен, чем ВПЧ-тестирование, но из-за низкой чувствительности иногда выдает ложноотрицательные результаты. Этого можно избежать, если использовать комплекс данных методов [16]. В последнее время в мире практикуют пересмотр цитологических препаратов после положительного ВПЧ-теста, что позволяет значительно повысить эффективность выявления цервикальной патологии [17]. Появился новый термин «информированная» цитология — проведение цитологического исследования после ВПЧ-тестирования, что также повышает эффективность диагностики патологии шейки матки [18].
Заключение
Ранняя диагностика патологии шейки матки, ассоциированная с ВПЧ, должна базироваться на комплексе цитологического метода с ИГХ исследованием экспрессии белков р16(INK4A)/Ki67 и ДНК ВПЧ-тестировании независимо от возраста пациентки. Особенно важно при обследовании женщин моложе 30 лет проводить ДНК ВПЧ тестирование вместе с РАР-тестом для исключения транзиторной формы папилломавирусной инфекции.



