Инфицирование вирусом папилломы человека (ВПЧ) характерно преимущественно для молодых сексуально активных женщин. Многочисленные исследования свидетельствуют о значительной распространенности ВПЧ высокого онкогенного риска (ВПЧ ВР) среди женщин моложе 30 лет [1]. Факторами риска инфицирования ВПЧ являются ранний возраст начала половой жизни, три или более половых партнера и сопутствующие генитальные инфекции (хламидиоз, генитальный герпес, бактериальный вагиноз) [2, 3]. В 95% случаев рака шейки матки (РШМ), подтвержденного гистологическими методами исследования, выявляются ВПЧ ВР. Ежегодно в России регистрируется 15 342 случая РШМ, из них 7371 заканчивается смертельным исходом [4].
РШМ предшествуют цервикальные интраэпителиальные неоплазии (CIN) различной степени тяжести. Ежегодно в мире выявляются 40 млн новых случаев CIN, которые наиболее часто диагностируются в возрасте 25–35 лет. Частота прогрессии CIN II–III в РШМ составляет 40–65%.
Цервикальный скрининг
В настоящее время в России цервикальный скрининг включает забор цитологического мазка – традиционная или жидкостная цитология. По данным мета-анализа, чувствительность и специфичность данных методов обладает равным потенциалом [3, 5].
Согласно приказу Минздрава России от 03.02.2015 г. № 36ан «Об утверждении порядка проведения диспансеризации определенных групп взрослого населения», цервикальный скрининг проводят женщинам в возрасте 21–69 лет каждые 3 года.
Согласно рекомендациям Американского общества рака (ACS, American Cancer Society), Американского общества клинической онкологии (ASCP, American Society for Clinical Pathology), скрининг РШМ следует начинать с 21 года. Женщинам в возрасте от 21 до 29 лет цитологическое исследование должно проводиться 1 раз в 3 года. Женщинам от 30 до 65 лет рекомендовано проведение комбинированного теста (co-test), который включает в себя ВПЧ-тестирование 1 раз в 5 лет и цитологический мазок каждые 3 года. Доказано, что при применении комбинированного теста, по сравнению с цитологическим исследованием, риск заболеваемости РШМ снижается [6]. Цервикальный скрининг следует проводить женщинам до 65 лет при условии, что в течение последних 10 лет результат цитологического исследования соответствовал норме, и предыдущий скрининг был проведен не более 5 лет назад. Женщинам с гистологическим диагнозом CINII, CINIII или микроинвазивным РШМ (CIS) в анамнезе, проводится ежегодный комбинированный тест в течение последующих 20 лет с момента лечения [7].
В 2015 году FDA (Food and drug administration) рекомендовало проводить типирование ВПЧ всем женщинам с 25-летнего возраста в качестве первоначального этапа программы по скринингу РШМ.
Выбор тактики ведения пациенток с цитологическими заключениями плоскоклеточные интраэпителиальные поражения высокой степени тяжести (HSIL) определен Приказом Минздрава РФ от 07.11.2012 г. № 599н, в соответствии с которым, таким пациенткам проводится ВПЧ-тестирование, расширенная кольпоскопия с последующим выполнением прицельной биопсии шейки матки и кюретажем цервикального канала (по показаниям). При гистологическом подтверждении CINII/CINIII пациентке проводится конусовидное иссечение патологически измененных тканей шейки. Гистологическое заключение, помимо верификации основного диагноза CINII-CINIII, должно включать в себя информацию о состоянии краев гистологического материала. Наличие CIN в краях удаленного образца свидетельствует о высоком риске рецидива.
В настоящее время не разработаны алгоритмы ведения пациенток с «малыми» формами поражения эпителия шейки матки.
«Малые» формы поражения шейки матки
Американское общество по кольпоскопии и цервикальной патологии (ASCCP, American Society for Colposcopy and Cervical Pathology) в 2012 г. предложило использовать термин «малые» формы поражения эпителия шейки матки для обозначения пациенток:
- с наличием ВПЧ 16-го или 18-го типов;
- персистенцией ВПЧ ВР;
- цитологическими заключениями мазков:
- ASCUS (Atypical squamous cells undetermined significance) атипичные клетки неясного значения;
- LSIL (Low grade squamous intraepithelial lesion) плоскоклеточные интраэпителиальные поражения низкой степени тяжести [7].
В настоящее время выделен и описан 201 тип ВПЧ. По данным мета-анализа, типы ВПЧ, относящиеся к α-филогенетической группе, вызывают неопластические процессы и являются причиной канцерогенеза. В соответствии с Международными эпидемиологическими исследованиями выделяют 18 высокоонкогенных типов ВПЧ, а именно: 16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, и 82, связанных с развитием РШМ. Низкоонкогенными типами являются ВПЧ 6, 11, 40, 42, 43, 44, 54, 61, 72 и 81 (вызывают доброкачественные изменения, остроконечные кондиломы) [8–10].
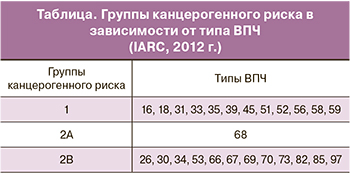 Международное агентство по изучению рака (IARC) выделило 3 группы ВПЧ канцерогенного риска: группа 1 – высокого канцерогенного риска, группа 2A – вероятно канцерогенного риска, группа 2B – возможно канцерогенного риска (таблица).
Международное агентство по изучению рака (IARC) выделило 3 группы ВПЧ канцерогенного риска: группа 1 – высокого канцерогенного риска, группа 2A – вероятно канцерогенного риска, группа 2B – возможно канцерогенного риска (таблица).
По данным международных исследований, РШМ был диагностирован в 96% случаев при наличии хотя бы одного из 13 типов ВПЧ канцерогенного риска групп 1 и 2А [11, 12].
Согласно исследованиям F. Wang (2011) ВПЧ 16-го и 18-го типов выявляются наиболее часто при поражениях эпителия шейки матки. Так, в 55–70% случаев РШМ был выявлен ВПЧ 16-го типа и в 10–15% – ВПЧ 18-го типа [13, 14]. В России у женщин с РШМ в 64,6% был выявлен ВПЧ 16-го типа и в 9,4% – ВПЧ 18-го типа [4].
По данным мета-анализа ВПЧ 16-го типа в 2 раза чаще встречался у женщин с цитологической картиной HSIL (47,5%), чем у пациенток с «малыми» формами поражения шейки матки: c NILM (Negative for intraepithelial lesion or malignancy, отсутствие внутриклеточного поражения или злокачественности) – 20,4%, с ASCUS – 22,9% и LSIL – 25,1% [15].
В исследование F.M. Köse и соавт. в 96,6% цервикальных раков была выявлена ДНК ВПЧ ВР, в 53,5% – ВПЧ 16-го типа, в 17,2% – ВПЧ 18-го типа [16]. Учитывая результаты эпидемиологических исследований, проведенных в Европе и США, основанных, главным образом, на частоте встречаемости типов ВПЧ, были разработаны вакцины, предотвращающие инфицирование папилломавирусной инфекцией, обусловленной ВПЧ 16-го и 18-го типов.
Результаты исследования P. Guan и соавт. показали, что спектр генотипов ВПЧ варьирует в различных регионах мира. Так, в Западной и Центральной Азии у женщин с нормальными результатами цитологии в 29,5% случаев выявлялся ВПЧ 16-го типа, в Северной Америке – в 26,3%, в Европе – в 22,8%, в Африке – в 13,1%. В большинстве случаев РШМ также выявлялся ВПЧ 16-го типа: в Западной и Центральной Азии – в 73,0%, в Европе – в 66,7%, Австралии – в 62,6% [15]. Так, проведенное в Восточном и Южном Китае исследование показало, что в этих регионах доминировали ВПЧ 52-го и ВПЧ 58-го типов у женщин с нормальным цитологическим мазком, однако ВПЧ 16-го типа превалировал в случаях с HSIL [17, 18].
По данным исследования проведенного в НЦАГиП им. В.И. Кулакова при ВПЧ-генотипировании с определением 21 типа среди 413 ВПЧ-позитивных женщин в 91,3% случаев встречались ВПЧ группы А9. Доминирующим типом был ВПЧ 16-го типа – 38,5%, затем ВПЧ 58-го типа – 16,2%, ВПЧ 31 – 15,5%, ВПЧ 52 – 11,4%, ВПЧ 33 – 9,7%, ВПЧ 18 – 8,5%. Среди ВПЧ-позитивных женщин аномальная цитология встречалась в 57,1% случаев (ASCUS – в 4,4%, LSIL – в 23,2%, HSIL – в 24,7%, РШМ – в 4,8%) [19].
Таким образом, анализ результатов исследований показал, что имеются особенности распространения и различие типов ВПЧ в разных регионах и странах. Однако наибольшей тропностью к эпителию шейки матки обладает ВПЧ 16-го типа, который достоверно чаще выявляется при HSIL и РШМ.
У 85–90% ВПЧ-инфицированных женщин самостоятельная элиминация вируса происходят в среднем за 8–24 месяца с момента инфицирования [2, 20].
Однако у женщин в возрасте 25–30 лет положительный результат ВПЧ-теста в большинстве случаев свидетельствует о персистенции инфекции. Персистенция ВПЧ – это определение одного и того же типа ВПЧ ВР на протяжении двух и более лет. J. Zhao и соавт. выявлена взаимосвязь между транзиторной папилломавирусной инфекцией и персистенцией ВПЧ ВР и развитием неопластических процессов и РШМ у женщин. Обнаружение одного и того же типа ВПЧ ВР на протяжении более 18 месяцев ассоциировалось с развитием CIN II–III по сравнению с контрольной группой (ДИ 92%, RR >3,0) [21].
Длительное нахождение одного и того же вида ВПЧ в организме женщины является непременным условием для прогрессирования заболевания и развития РШМ. Выявлена взаимосвязь между возрастом и степенью тяжести SIL – чем старше женщина, тем выше частота встречаемости тяжелых дисплазий шейки матки и РШМ. Так, частота встречаемости РШМ у женщин в возрасте 30–44 лет составила 5,5%; 45–54 года – 14,4%; 55 лет и старше – 18% [22]. S.S. Xiao с соавт. оценили риск возникновения и прогрессирования ВПЧ-ассоциированных заболеваний шейки матки у 1065 женщин с ВПЧ ВР в течение 2 лет наблюдения с использованием ВПЧ-тестирования и цитологического исследования с интервалом 12 месяцев. По результатам исследования в зависимости от частоты обнаружения ВПЧ женщины были разделены на 4 группы: 1-я группа – отрицательный тест на ВПЧ через 12 и 24 месяцев с момента исследования (стойкий отрицательный ответ, СОО), 2-я группа – ВПЧ – положительный тест только через 12 месяцев (нестойкий отрицательный ответ, НОО); 3-я группа – отрицательный результат на ВПЧ через 12 месяцев и положительный через 24 месяца (нестойкий положительный ответ, НПО); 4-я группа – персистенция ВПЧ на протяжении 24 месяцев (стойкий положительный ответ, СПО). Результаты исследования показали, что в 4-й группе (персистенция ВПЧ ВР) достоверно чаще встречались цитологические результаты HSIL и РШМ по сравнению с другими группами. Таким образом, стойкая персистенция одного и того же типа ВПЧ ВР является причиной развития CIN и РШМ [23].
Результаты исследований, проведенных в ФГБУ НЦАГиП им. В.И. Кулакова МЗ РФ, показали, что у 33% женщин с персистенцией ВПЧ ВР определялись слабовыраженные и выраженные изменения при кольпоскопии, требующие проведения биопсии шейки матки. Аналогичные результаты получены T.C. Wright и соавт.: при аномальной кольпоскопической картине и NILM по цитологии у ВПЧ-позитивных женщин в 15% случаев гистологически верифицирован CINII/CINIII [24, 25]. Таким образом, нормальная цитологическая картина у женщин с наличием ВПЧ ВР требует проведения расширенной кольпоскопии для раннего выявления заболеваний шейки матки, ассоциированных с вирусом.
Цитологическое заключение ASCUS встречается в большинстве случаев исследуемых цитограмм и имеет самый низкий риск прогрессирования заболевания до CINIII и РШМ. У 1/3 женщин с ASCUS ВПЧ ВР не выявляется, однако отмечаются воспалительные и реактивные изменения [26, 27]. По данным H.A. Katki и соавт., у таких женщин в возрасте 30–64 лет риск прогрессирования заболевания в течение 5 лет до CINIII составляет 0,43%, РШМ – 0,05%, что достоверно ниже по сравнению с ВПЧ-позитивными женщинами [27].
Результаты исследования J.C. Gagea и соавт. показали, что цитологическое заключение ASCUS достоверно выше в группе ВПЧ-позитивных женщин до 30 лет, а у ВПЧ-отрицательных такой закономерности не выявлено [28]. Результаты мета-анализа показали, что наиболее часто встречающимися типами ВПЧ у пациенток с ASCUS были ВПЧ 16 – 22,9%, ВПЧ 52 – 10,1%, ВПЧ 31 – 9,4%, ВПЧ 51 – 8,8%, ВПЧ 18 – 8,4%, ВПЧ 58 – 7,8% [15].
У ВПЧ-позитивных женщин с цитологическим заключением ASCUS в 78,9% случаев был морфологически верифицирован CINI и в 21,1% – CINII/CINIII [29].
В 2016 г. был проведен мета-анализ с участием 13871 пациенток с «малыми» формами поражения шейки матки, из них 8587 – с цитологическим заключением ASCUS и 5284 – с LSIL. Всем женщинам было проведено генотипирование ВПЧ. По результатам ВПЧ-теста женщины были разделены на две группы: к первой группе отнесли пациенток только с наличием ВПЧ 16/18 типов, ко второй группе – с другими типами ВПЧ ВР. По результатам исследования в первой группе женщины с ASCUS составили 83%, с LSIL – 76% [30].
По данным мета-анализа риск возникновения CINIII у пациенток с ВПЧ 16/18 типов и цитологическими заключениями ASCUS составляет 17%, LSIL – 19%, а при наличии других типов ВПЧ ВР – 5% [30].
У женщин с ВПЧ ВР и цитологическим заключением LSIL в 78,1% случаев гистологический диагноз совпадал с результатом ПАП-теста и в 21,9% – соответствовал CINIII [29]. По данным мета-анализа установлено, что у пациенток с CINI в 57% случаев наблюдается регресс заболевания, в 32% – персистенция, в 11% – прогрессирование заболевания до CINIII и в 1% случаев – развитие РШМ [7]. У пациенток с «малыми» формами поражения шейки матки степень выраженности патологического процесса в большинстве случаев коррелирует с результатами аномальной цитологии. Так, по данным A. Ciavattini и соавт. при ASCUS/LSIL кольпоскопические изменения наблюдаются в 57% случаев, из них слабо выраженные изменения выявлены в 88%, выраженные – в 12% [31]. Кольпоскопическими признаками, характерными для «малых» форм поражения шейки матки, являются – тонкий ацетобелый эпителий, медленно проявляющийся на пробе с уксусной кислотой и в 50% случаев сочетающийся с нежной мозаикой и нежной пунктуацией.
Перспективные методы диагностики
В настоящее время в клинической практике помимо стандартных методов исследования применяются молекулярные биомаркеры, которые отражают риск развития пролиферативных процессов с переходом в неоплазии.
Ряд авторов полагают, что повышение экспрессии онкобелков Е6/Е7 у ВПЧ-позитивных женщин с цитологическим заключением ASCUS/LSIL свидетельствует о прогрессировании процесса [32].
В настоящее время с целью диагностики тяжести поражения SIL хорошо зарекомендовал себя иммуноцитохимический метод выявления клеточных белков p16INK4A, Ki67. Гиперэкспрессия протеинов p16 INK4A и Ki67 рассматривается как маркер при CINII/CINIII и РШМ. Данный диагностический инструмент используется в спорных ситуациях, как дополнение при проведении стандартного цитологического исследования. Накопление в клетках p16INK4A свидетельствует о нарушении регуляции клеточного цикла. Усиленная экспрессия p16INK4A происходит вследствие инактивации гена ретинобластомы белком Е7 вируса. Окрашивание цитологических мазков специфическими антителами к p16 INK4A указывает на степень выраженности цервикальных поражений [28, 33].
Одним из важных механизмов в развитии РШМ считаются эпигенетические нарушения, связанные с инактивацией генов-супрессоров опухолевого роста. Изучение изменения уровня экспрессии мРНК генов человека у пациенток с ВПЧ-ассоциированными заболеваниями шейки матки для прогнозирования риска развития и прогрессирования CIN представляет большой интерес. Определение мРНК гена p16 (INK4a) может быть использовано в качестве прогнозирования плоскоклеточных поражений шейки матки.
Изучение уровней экспрессии молекулярно-генетических маркеров у пациенток с «малыми» поражениями эпителия шейки матки может иметь высокую прогностическую ценность в исходах данных заболеваний. В поисках новых и важнейших биомаркеров патологии шейки матки были выявлены гены, характеризующие высокую частоту метилирования в измененных клетках. Было проанализировано 68 различных генов метилирования у пациенток с ВПЧ-ассоциированными поражениями эпителия шейки матки. По результатам исследований было выделено 3 маркера (DAPK1, CADM1 и RARB), выявляемых вследствие аномального метилирования [34, 35]. Недавнее исследование, проведенное N. Vasiljević и соавт., идентифицировало 6 новых генов (EPB41L3, EDNRB, LMX1, DPYS, MAL и CADM1), гиперэкспрессия которых выявлена при плоскоклеточных карциномах [36].
По данным исследования, проведенного в ФГБУ НЦАГиП им. В.И. Кулакова МЗ РФ, определены прогностические маркеры риска развития CIN и РШМ: мРНК функциональные гены человека МКI(67), CDKN2A(P16), PGR, BCL2 методом полимеразной цепной реакции в режиме реального времени. Интегральная оценка данных маркеров на основе многофакторного анализа выявила группу пациенток с высоким риском развития неопластической трансформации эпителия шейки матки у пациенток с персистенцией ВПЧ ВР (8,9%) и LSIL (18%). В ходе наблюдения у женщин данной группы отмечено ухудшение результатов цитологии (100/33,3%) [37].
Для диагностики, течения и прогнозирования ВПЧ-ассоциированных поражений эпителия шейки матки изучаются микро-РНК (miR): выявление miR-375, свидетельствует о прогрессировании заболевания с переходом в РШМ [14], а изменение экспрессии miR-25, -22, -92а и -29а более чем 1,5 раза позволило рассматривать их в качестве диагностического маркера CIN различной степени тяжести и РШМ [38].
Заключение
Таким образом, «малые» формы поражения шейки матки всегда ассоциированы с ВПЧ ВР, существует риск прогрессирования заболевания до CINIII и РШМ. Персистенция одного и того же типа ВПЧ ВР является непременным условием для прогрессирования заболевания. Поэтому пациентки с «малыми» формами поражения шейки матки являются группой риска в развитии предрака и РШМ. Отсутствие единых алгоритмов введения при «малых» формах поражения шейки матки ведет к неоправданному радикальному лечению и требует поиска новых молекулярно-генетических маркеров риска развития неопластической трансформации и прогрессирования процесса.



