Рак молочной железы (РМЖ) занимает первое место среди онкологических заболеваний у женщин в мире и в Российской Федерации (РФ). В 2016 г. РМЖ выявлен у 63 456 женщин в РФ, что составляет 439,0 на 100 тысяч населения, 38,7% в структуре заболеваемости злокачественной патологии [1].
РМЖ представляет собой гетерогенное заболевание с разнообразием фенотипических форм. Идентификация мутаций в генах репарации ДНК в ходе молекулярно-генетических исследований позволяет выделить наследственный РМЖ. Частота встречаемости наследственной формы рака, по данным различных авторов составляет от 5 до 10% от всех случаев РМЖ и характеризуется наличием мутацией в генах предрасположенности к РМЖ: BRCA1, BRCA2, RAD51, BLM, CHEK2, Nbs1 и др. [2].
Ген репарации ДНК – CHEK2 – локализован на длинном плече 22 хромосомы (22q12.1), содержит 14 экзонов и занимает 50 кб ДНК. Продукт экспрессии гена CHEK2 активизируется в ответ на повреждение (двунитевые разрывы) ДНК, что ведет к апоптозу, остановке клеточного цикла. При мутации CHEK2 1100delC экспрессия киназы либо нарушена, либо снижена. Мутация CHEK2 I157T приводит к синтезу дефектного белка из аминокислот на мРНК, не способного к фосфорилированию CDC25A и BRCA1.
Дефект CHEK2 IVS2+1G>A (более типичный для славянской популяции) в результате стоп-кодона приводит к формированию укороченного и, соответственно, функционально неактивного белка. Мутации в гене CHEK2 увеличивают риск развития РМЖ в 2–3 раза и до 5 раз – на фоне семейного онкологического анамнеза [2, 3].
Это подтверждает гипотезу, что пенетрантность CHEK2-мутаций в семьях высокого риска модифицируется другими генетическими нарушениями и/или факторами внешней среды. Дефекты в гене CHEK2 встречаются в 4% всех случаев наследственного РМЖ, половина из них вызвана определенной «founder»-мутацией c.1100delC. Отмечено, что в группе носителей мутации CHEK2 1100delC повышается риск развития РМЖ после ионизирующей радиации. Мутация CHEK2 1100delC увеличивает риск РМЖ в 2–3 раза у женщин и в 10 раз у мужчин. По результатам крупного исследования, проведенного в Польше, было установлено повышение риска рака щитовидной железы, толстой кишки и почки у носителей 3 мутаций CHEK2 c.1100delC, c.319+1G>A(IVS2+1G>A) и p.Ile157Thr (NM_007194.3).
Таким образом, при мутации средней пенетрантности агрегация случаев онкологических заболеваний в молодом возрасте у кровных родственников также позволяет предположить высокую вероятность развития РМЖ в последующем поколении.
Наследуется мутация аутосомно-доминантно. При наличии данной мутации происходит преждевременное формирование стоп-кодона, что приводит к укорочению фермента чек-поинт киназы 2, ее неполноценности и нарушению функции. Повышается риск РМЖ и яичников. Мутации могут быть со вставкой (ins) или делецией (del) нуклеотидов, вследствие чего происходит преждевременное формирование стоп-кодонов и значительное снижение продукции опухолевых супрессоров (утрата контроля репарации ДНК).
Герминальная мутация 1100delC в 10 экзоне гена СНЕК2 впервые была найдена в семьях с синдромом Ли-Фраумени. В нескольких исследованиях показано, что этот вариант ассоциирован с предрасположенностью к РМЖ у женщин и раку предстательной железы у мужчин [3–7].
 Часто при наследственных формах РМЖ у пациенток диагностируют метахронные РМЖ [8].
Часто при наследственных формах РМЖ у пациенток диагностируют метахронные РМЖ [8].
Далее приведены клинические примеры пациенток, получавших лечение в МНИОИ им. П.А.Герцена. У трех пациенток диагностирован РМЖ, ассоциированный с мутацией в гене СНЕК2; тактика лечения, а также выбор профилактических мастэктомий и тубовариоэктомий различен у каждой пациентки, таким образом для каждой пациентки план лечения был индивидуален.
Клиническое наблюдение 1
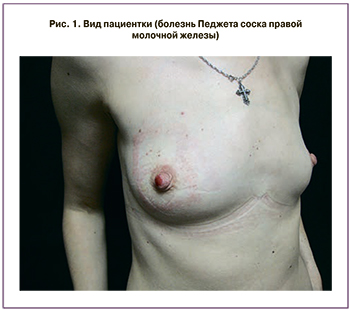
Пациентка К., 31 года, диагноз – рак Педжета правой молочной железы рТ(Paget)N0М0. Носитель мутации гена СНЕК2.
Из анамнеза – самостоятельно обнаружила изменения в области соска правой молочной железы около 4 месяцев назад, обратилась для обследования в МНИОИ им. П.А. Герцена в апреле 2016 г. Наследственный онкологический анамнез – у мамы первично множественный метахронный РМЖ, носитель мутации гена СНЕК2.
При обследовании: ультразвуковое исследование (УЗИ) молочных желез и маммография – без узловых образований.
По данным компьютерной томографии грудной клетки, сцинтиграфии костей скелета, УЗИ брюшной полости, малого таза – без признаков метастазирования.
Цитология – соскоб с соска правой молочной железы – рак Педжета.
Генетическое исследование мутаций ВRCA1,2, СНЕК 2 – выявлена герминальная миссенс-мутация I157Т (р.I1е157Тhr) в 3-м экзоне гена СНЕК 2, в результате которой происходит аминокислотная замена (изолейцин на треонин в кодоне 470 – с.470Т>C) в гетерозиготном состоянии.
Клинически: в области соска правой молочной железы эрозия до 7 мм, поверхность кровоточит, четкие узловые образования не пальпируются, подмышечные лимфатические узлы пальпаторно не изменены (рис. 1).
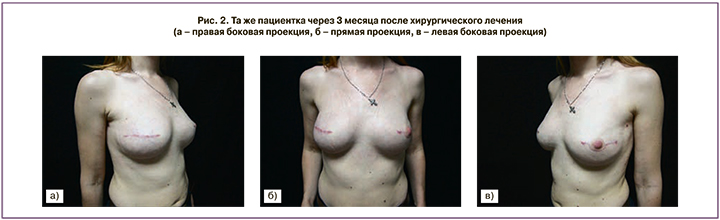
Пациентке 24.05.16 выполнены операции – радикальная кожесохранная мастэктомия справа с одномоментной реконструкций эндопротезом (срg 313 – 350, mentor) и сетчатым имплантатом (parietex). Профилактическая подкожная мастэктомия слева с одномоментной реконструкций эндопротезом (срg 313 – 350, mentor) и сетчатым имплантатом (parietex).
Морфологическое исследование №АБ 29917-35/оп: макро – ткань правой молочной железы: поверхность соска 6 мм с эрозированной поверхностью.
Микро: ткань правой молочной железы: рак Педжета соска молочной железы с распространением в млечные протоки и протоки подсосковой зоны. В ткани железы – фиброзно-кистозные изменения, эктазия протоков, очаги аденоза и протоковой гиперплазии. Отдельно: в ткани молочной железы фиброз и очаги аденоза; исчерченные мышцы обычного строения. В 3 исследованных лимфатических узлах жировой клетчатки препарата метастазов нет, гистиоцитоз синусов, лимфоидная гиперплазия, жировое замещение лимфоидной ткани. Ткань левой молочной железы – с фиброзом, очагами аденоза, апокриновой метаплазией эпителия.
Послеоперационный период без осложнений, заживление первичное (рис. 2).
Пациентка обсуждена на консилиуме, рекомендовано наблюдение. Прогноз благоприятный.
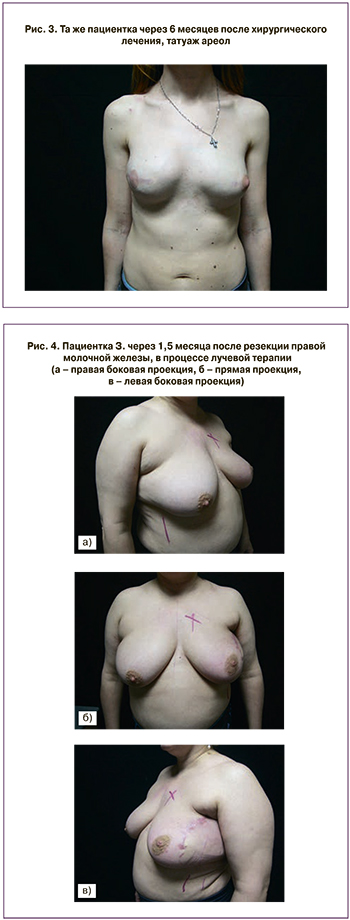
У пациентки дочь 5 лет, в дальнейшем пациентка планирует вторую беременность, после родов плановое удаление яичников. Для полной реабилитации выполнен татуаж ареолы правой молочной железы (рис. 3).
 Клиническое наблюдение 2
Клиническое наблюдение 2
Пациентка З., 48 лет, диагноз: РМЖ IIБ ст. усТ2N1М0G2PR, урТ1N1М0. Люминальный тип А. Состояние после 8 курсов неоадъювантной полихимиотерапии. Носитель мутации СНЕК2.
Из анамнеза – пациентка в сентябре 2015 г. самостоятельно обнаружила узел в левой молочной железе, дообследована, диагностирован местно-распространенный РМЖ, на первом этапе рекомендована неоадъювантная полихимиотерапия.
Наследственный онкологический анамнез: дед и дядя – рак гортани.
На первом этапе проведена неоадъювантная полихимиотерапия (4АС+12 введений паклитаксел и карбоплатин) с 08.12.15 до 20.06.16.
При контрольном обследовании: по данным УЗИ и маммографии уменьшение размера и плотности опухолевого узла с 3 см до 0,6 см.
Компьютерная томография грудной клетки и сцинтиграфия костей скелета – без отдаленных метастазов.
УЗИ брюшной полости, малого таза – без признаков метастазирования.
Гистология 8711\16 – узел левой молочной железы – инвазивный рак без признаков специфичности II степени злокачественности.
Иммуногистохимия – эстрогеновые рецепторы 8, рецепторы прогестерона 8, неr2 отр, Кi-25% – люминальный тип А.
Генетическое исследование мутаций ВRCA1,2, СНЕК 2 – (выявлена герминальная миссенс-мутация I157Т (р.I1e157Тhr) в 3 экзоне гена CHEK2, в результате которой происходит аминокислотная замена (изолейцин на треонин в кодоне 470 – с.470Т>C в гетерозиготном состоянии)
На втором этапе – 08.08.2016 – радикальная резекция левой молочной железы.
Послеоперационный период без осложнений.
Гистология АБ 55979-56002/оп – в верхне-наружном квадранте левой молочной железы узел 1,2×0,5×1 см. Микроинвазивный рак без признаков специфичности, с признаками лечебного патоморфоза 2-й степени. Вблизи единичный комплекс внутрипротоковой карциномы. Вокруг небольшие фокусы пролиферации эпителия. В 1 из 17 лимфоузлов – микрометастаз рака, с наличием в перифокальной клетчатке крупного опухолевого эмбола со слабым патоморфозом. В подключичном лимфоузле без метастазов.
Тактика лечения обсуждена на консилиуме рекомендовано лучевая терапия, далее гормонотерапия.
С 27.09.16 по 24.10.16 облучение локо-регионарных зон по 2,5 Гр до СОД 50 Гр на молочную железу и 45 Гр на регионарные зоны (рис. 4).
Пациентка от профилактической мастэктомии справа и удаления яичников отказалась, в настоящее время принимает тамоксифен 20 мг, контролирует уровень маркеров СА-15-3 (рис. 5).
У пациентки взрослая дочь 22 лет, которая информирована о риске наследственных заболеваний, планируется генетическое исследование мутаций для РМЖ.
Клиническое наблюдение 3
Пациентка С., 36 лет, диагноз – Первично-множественный метахронный рак: 1) Саркома Юинга 6-го ребра слева. Состояние после комплексного лечения в 1995–1997 гг. Ремиссия. 2) Рак правой молочной железы IIIБ ст. рT4bN0М0CR. Тройной негативный тип. Состояние после комплексного лечения в 2016 г. Носитель мутации гена CHEK2.
 Наследственный онкологический анамнез – не отягощен.
Наследственный онкологический анамнез – не отягощен.
Из анамнеза – в 1995–1996 гг. пациентка получила комплексное лечение в РОНЦ им. Н.Н. Блохина по поводу саркомы Юинга (химиолучевая терапия, хирургическое лечение). В настоящее время ремиссия. В 2016 г. в Санкт-Петербурге выполнено комбинированное лечение по поводу рака правой молочной железы (неоадъювантная химиотерапия по схеме 3АТ (паклитаксел,доксорубицин)+5Т (паклитаксел в монорежиме), радикальная мастэктомия справа). В марте 2017 г. пациентка самостоятельно обратилась в генетический центр, где выявлена мутация в гене CHEK2. Пациентка комплексно обследована, данных за наличие опухолевой патологии не получено. Принимая во внимание перенесенный рак молочной железы в анамнезе, а также наличие мутация в гене CHEK2 (выявлена герминальная миссенс-мутация I157Т (р.I1e157Тhr) в 3-м экзоне гена CHEK2, в результате которой происходит аминокислотная замена (изолейцин на треонин в кодоне 470 – с.470Т>C в гетерозиготном состоянии), в апреле 2017 г. в МНИОИ им. П.А. Герцена выполнена профилактическая мастэктомия слева и двухсторонняя тубовариоэктомия.
Гистология № АВ 42944-51 18.04.17: в ткани молочной железы, в том числе и в соске опухолевого роста нет. В яичниках фолликулы разных стадий зрелости, артретические, частью кистозно-измененные, желтое тело с кровоизлияниями, фиброзные тела, инклюзионные кисты. Маточные трубы обычного строения.
У пациентки нет детей, планируется динамическое наблюдение.
Заключение
Необходимы дальнейшие исследования у пациенток с мутациями генов ВRCA1, 2, СНЕК 2, так как число пациенток с мутациями в данных генах благодаря увеличению числа генетических лабораторий будет расти. Зная особенности наследования, развития наследственно ассоциированного РМЖ, необходимо выработать тактику хирургического лечения данных больных, алгоритмы динамического наблюдения за пациентками, а также алгоритм обследования и профилактики РМЖ среди родственников.
Выводы
- Во всех трех клинических наблюдениях у пациенток была диагностирована герминальная миссенс-мутация I157Т (р.I1е157Тhr) в 3 экзоне гена СНЕК 2, в результате которой происходит аминокислотная замена (изолейцин на треонин в кодоне 470 – с.470Т>C) в гетерозиготном состоянии.
- Объем хирургических вмешательств при РМЖ, профилактических операций на молочной железе и яичниках у пациенток решался индивидуально, исходя из клинических данных.
- Необходимо генетическое обследование родственников для первичной профилактики РМЖ.



