Качество выхаживания детей, рожденных прежде физиологических сроков, является важным показателем социального благополучия современного общества. Преждевременные роды составляют в человеческой популяции от 5 до 10%, не превышая 1% при сроке беременности менее 28 недель [1–3]. Однако даже в развитых странах именно преждевременные, в особенности очень ранние роды, обуславливают приблизительно половину всех случаев перинатальных потерь [4].
Считается доказанным, что иммунная система здоровых доношенных новорожденных во многом отличается от иммунной системы взрослых, поскольку внутриутробное развитие плода происходит при ограниченной антигенной стимуляции. При нормально развивающейся беременности взаимоотношения между иммунными системами матери и плода сбалансированы, что отражает сформированность толерантности иммунной системы матери к аллогенным антигенам плода. Среди причин, приводящих к преждевременным родам, может иметь место и чрезмерная активация иммунной системы матери. Считается, что поддержание толерантности обеспечивается подавлением реакций типа Th1 в ранние сроки беременности и превалированием ответа типа Th2 в середине беременности. «Иммунологическая провокация» со стороны плода по отношению к материнскому организму может привести к преждевременным родам, в связи с чем в норме иммунный ответ новорожденных смещен в сторону противовоспалительного Th2-ответа. Однако подавление иммунных реакций Th1-типа, в свою очередь, обусловливает высокую подверженность новорожденного инфекционным осложнениям, в том числе развитию раннего неонатального сепсиса и врожденной пневмонии [3].
Врожденная пневмония является полиэтиологическим заболеванием. Среди ведущих причин развития пневмонии у недоношенных новорожденных особое значение придается особенностям строения дыхательной системы – незрелости легочной ткани, которая приводит к нарушению вентиляционно-перфузионных отношений в легких, недостаточному расправлению альвеол, что, в свою очередь, создает предпосылки для развития патологического процесса [5, 6].
Немаловажную роль в развитии пневмоний у новорожденных играет иммунная система, функциональная неполноценность которой особенно выражена у глубоконедоношенных детей [5, 7].
Основными факторами первого уровня защиты от возбудителей инфекционных заболеваний у новорожденных признаются факторы, составляющие врожденный иммунитет. Нарушения врожденного иммунитета при развитии пневмоний у новорожденных, в особенности у недоношенных детей, сопровождаются дисбалансом продукции цитокинов, что может приводить к развитию синдрома системного воспалительного ответа (ССВО) [6, 8].
Таким образом, исследование особенностей комплекса растворимых иммунорегуляторных белков плазмы периферической крови (цитокинов, хемокинов, факторов роста) у недоношенных детей с врожденной пневмонией представляется особенно актуальным с точки зрения изучения вариантов иммунологического реагирования при развитии инфекционного процесса, с учетом морфофункциональной зрелости недоношенных детей и их гестационного возраста (ГВ).
Цель исследования: оценить содержание цитокинов в плазме периферической крови недоношенных детей с врожденной пневмонией на 1-й неделе жизни.
Материалы и методы
В данное исследование были включены 76 недоношенных детей ГВ 25–36 недель (основная группа) и 13 здоровых доношенных детей ГВ 37 недель (контрольная группа), которые были рождены в «НМИЦ АГП им. В.И. Кулакова» Минздрава России (далее Центр) в период январь–ноябрь 2019 г. У всех недоношенных детей в 1-е часы жизни развились клинические признаки синдрома системного воспалительного ответа и дыхательная недостаточность, они получали лечение по поводу врожденной пневмонии в условиях отделения реанимации и интенсивной терапии (ОРИТН) Центра. Дети контрольной группы родились в удовлетворительном состоянии; период ранней неонатальной адаптации у них протекал без особенностей, и они были выписаны домой до конца 1-й недели жизни.
Критериями исключения из исследования были: синдромальная форма наследственной патологии, наличие врожденных пороков, требующих экстренной хирургической коррекции, гемолитическая болезнь новорожденных.
Перед включением в исследование родителями новорожденных было подписано добровольное информированное согласие на участие детей в исследовании. Данное исследование было одобрено этическим комитетом ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Все новорожденные основной группы, включенные в исследование, после первичной стабилизации состояния в родильном зале поступали в ОРИТН, где в 1-е часы жизни (до момента начала медикаментозной терапии и энтерального кормления) одномоментно с проведением обязательного первичного клинико-лабораторного обследования, согласно унифицированному клиническому протоколу, осуществлялось взятие периферической венозной крови для иммунологических исследований. Дети контрольной группы с первых часов после рождения до момента выписки домой наблюдались в отделении новорожденных акушерского стационара. Отбор крови на исследование в контрольной группе был осуществлен однократно в 1-е сутки жизни вместе с проведением стандартного клинико-лабораторного обследования, без дополнительных инвазивных манипуляций.
Антропометрические данные недоношенных детей оценивались с помощью центильных таблиц Т. Фэнтона для мальчиков и девочек [9, 10].
Унифицированный клинический протокол, разработанный в ОРИТН Института неонатологии и педиатрии ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России включал: микробиологическое исследование крови, рентгенологическое исследование органов грудной полости, оценку содержания белков острой фазы воспаления, клинический анализ крови с определением абсолютного числа лейкоцитов, тромбоцитов, нейтрофилов и вычисление нейтрофильного индекса (НИ).
 Окончательный диагноз был поставлен на 3-и сутки жизни на основании выявления как минимум двух клинических и одного лабораторного признака инфекции. Очаговые и инфильтративные тени на рентгенограмме органов грудной полости расценивались как абсолютные признаки врожденной пневмонии. Усиление бронхо-сосудистого рисунка считалось косвенным признаком врожденной пневмонии и было основанием для постановки данного диагноза лишь в сочетании с другими клинико-лабораторными маркерами инфекции [11–13].
Окончательный диагноз был поставлен на 3-и сутки жизни на основании выявления как минимум двух клинических и одного лабораторного признака инфекции. Очаговые и инфильтративные тени на рентгенограмме органов грудной полости расценивались как абсолютные признаки врожденной пневмонии. Усиление бронхо-сосудистого рисунка считалось косвенным признаком врожденной пневмонии и было основанием для постановки данного диагноза лишь в сочетании с другими клинико-лабораторными маркерами инфекции [11–13].
Дизайн исследования приведен на рисунке.
Профиль цитокинов плазмы периферической крови новорожденных основной группы был исследован на 1-е, 3-и и 7-е сутки жизни. Взятие крови осуществлялось в пробирки с антикоагулянтом (ЭДТА).
Определение содержания иммунорегуляторных белков, участвующих в иммунном ответе: провоспалительных (интерферон гамма (IFN-γ), фактор некроза опухоли альфа (TNF-α), интерлейкины (ИЛ-1β, ИЛ-2, ИЛ-5, ИЛ-6, ИЛ-12, ИЛ-17)), противовоспалительных (ИЛ-4, ИЛ-10, ИЛ-13), хемокинов (ИЛ-8, моноцитарный хемотаксический протеин (MCP)-1, макрофагальный белок воспаления (MIP)-1β и ростовых факторов (ИЛ-7, гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF)), осуществлялось мультиплексным методом на анализаторе Bioplex 200 (Bio-Rad, США) с использованием коммерческого набора Bio-Plex ProHuman Cytokine 17-plex Assay (Bio-Rad, США). Согласно инструкции производителя тест-системы компании Bio-Rad, для приготовления образцов ЭДТА-плазмы применяли двукратное центрифугирование образцов периферической крови при 1000 g в течение 15 минут при 4°С и 10 000 g в течение 10 минут при 4°С для полного удаления тромбоцитов и осадков. Образцы плазмы замораживали и хранили до момента проведения анализа при температуре -80°С.
Статистический анализ
Статистический анализ полученных данных выполняли с помощью пакетов прикладных программ Microsoft Office Excel 2010 и MedCalc (версия 16.8). Для проверки нормальности распределения применяли критерий Шапиро–Уилка.
В случае нормального распределения измеренных параметров данные представлены как M (SD) (среднее (среднеквадратичное отклонение)), и для оценки значимости различий применяли t-критерий Стьюдента. В случае распределения измеренных параметров, отличающегося от нормального, данные представлены как Me (Q1;Q3) (медиана и интерквартильный размах)). Для оценки значимости различий выборок применяли тест Манна–Уитни для сравнения данных в двух группах или тест Краскела–Уоллиса для сравнения данных в трех группах с последующим апостериорным анализом. Для описания качественных переменных использовали частоты анализируемых признаков, для сравнения качественных показателей в 2 и более группах использовали критерий χ2 Пирсона. Различия считались значимыми при р≤0,05.
Результаты и обсуждение
В таблице 1 представлен спектр заболеваний, выявленных у матерей обследованных новорожденных до и во время данной беременности.

При изучении данных соматического и акушерско-гинекологического анамнеза нами не было обнаружено статистически значимых различий среди матерей новорожденных I и II подгрупп по всем анализируемым показателям, за исключением аллергических заболеваний, которые значимо чаще встречались у матерей новорожденных ГВ 25–31 неделя (р<0,05).
Клиническая характеристика новорожденных, включенных в исследование, представлена в таблице 2.

Антибактериальная терапия проводилась всем новорожденным основной группы двумя антибактериальными препаратами (пенициллин+аминогликозид) в течение 7 дней с последующим клинико-лабораторным обследованием и контролем лабораторных маркеров системной воспалительной реакции.
Респираторная терапия новорожденных в обеих подгруппах основной группы проводилась в зависимости от наличия, степени выраженности и динамики дыхательных нарушений, и частота ее использования в обеих группах была сходной. Виды респираторной поддержки в остром периоде врожденной пневмонии у новорожденных представлены в таблице 3.
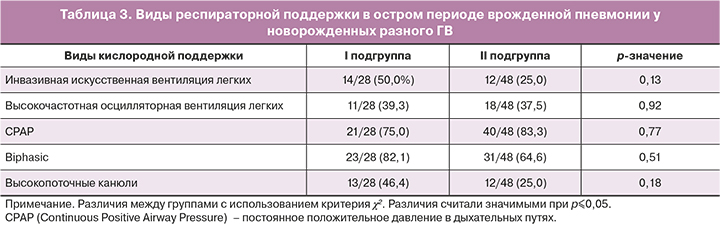
Развитие синдрома диссеминированного внутрисосудистого свертывания (ДВС) отмечалось только в I подгруппе у 13 (46,4%) пациентов (p<0,001); проявления легочного кровотечения регистрировались у 7 новорожденных (25%) этой подгруппы и у 2 (0,4%) – 2-й (p=0,019); желудочного кровотечения – у 5 (17,9%) 1-й и у 5 (10,4%) 2-й (p>0,05); кровоизлияния в кожу – у 9 (32,1%) пациентов 1-й подгруппы и у 2 (0,4%) – 2-й (p=0,005), макрогематурия – у 3 (10,7%) глубоконедоношенных детей и отсутствовали у пациентов 2-й подгруппы (p=0,03).
Внутрижелудочковые кровоизлияния (ВЖК) различной степени тяжести были диагностированы у 13 (46,4%) недоношенных новорожденных 1-й подгруппы и у 7 (14,6%) – 2-й подгруппы (p=0,02). Из них ВЖК I степени развилось у 4 (14,3%) детей 1-й подгруппы и у 5 (10,4%) – 2-й (p>0,05), II степени – у 8 (28,6%) детей 1-й и у 1 (0,2%) – 2-й (p=0,003), III степени – у 1 (3,6%) пациента 1-й подгруппы и у 1 (0,2%) пациента – 2-й (p>0,05).
При первичном клинико-лабораторном обследовании недоношенных новорожденных обеих подгрупп выявлена значимая разница в абсолютном содержании лейкоцитов (9,9 (7,2;14,5) и 12,6 (8,6;18,1); p<0,001)) и абсолютном содержании нейтрофилов (4,8 (2,5;5,5) и 5,6 (3,7;10,3); p<0,001)) при отсутствии значимых различий в уровне других маркеров воспаления, например, в НИ (0,04 (0,03;0,11) и 0,03 (0,02;0,06); p>0,05)) и содержании С-реактивного белка (0,7 (0,4;1,2) и 0,7 (0,4;1,3);p>0,05.
Таким образом, у недоношенных новорожденных 1-й подгруппы основной группы регистрировалось изменение значительно большего числа маркеров ССВО, чаще отмечались проявления ДВС-синдрома и гипоксически-геморрагическое поражение центральной нервной системы с развитием ВЖК различной степени тяжести по сравнению с новорожденными детьми 2-й подгруппы.
Анализ содержания цитокинов во всех исследованных группах на 1-е сутки рождения представлен в таблице 4.
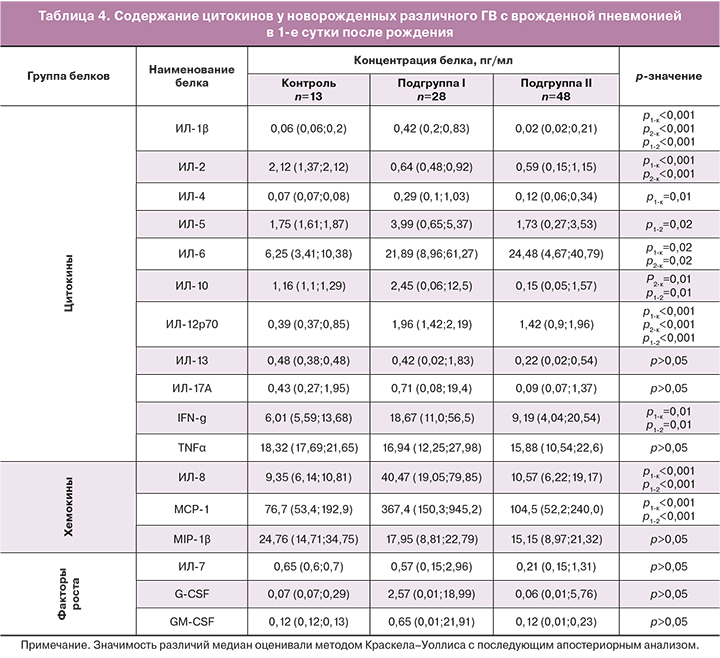
Как видно из таблицы 4, содержание цитокинов в плазме периферической крови новорожденных 1-й подгруппы основной группы существенно выше, чем в контрольной группе. Значимые различия выявлены в содержании следующих цитокинов: противовоспалительных – ИЛ-4, ИЛ-10, провоспалительных – IFN-γ, ИЛ-1β, ИЛ-2, ИЛ-5, ИЛ-6, ИЛ-12, хемокинов – ИЛ-8, МСР-1. Полученные результаты полностью коррелируют с результатами ранее опубликованных наших работ о том, что уровни цитокинов ИЛ-1β, ИЛ-6, IFN-γ, ИЛ-8, МСР-1 в плазме пуповинной крови значимо выше у недоношенных новорожденных с врожденной пневмонией, чем у детей сходного ГВ, имеющих дыхательные нарушения неинфекционного генеза [14].
Известно, что ИЛ-6 синтезируется активированными макрофагами и Т-клетками и стимулирует иммунный ответ. По мнению многих авторов, определение его уровня играет важную роль в диагностике ранних неонатальных инфекций [14–20]. Целесообразность мониторинга ИЛ-6 в сыворотке для наблюдения за развитием воспалительной реакции определяется также и тем, что он имеет короткий период полураспада [21].
ИЛ-8 – хемокин – также является маркером неонатального сепсиса и системной воспалительной реакции. Он синтезируется в первую фазу иммунного ответа макрофагами, эпителиальными и эндотелиальными клетками, содержащими Toll-подобные рецепторы. Существуют данные о том, что увеличение его связано с неблагоприятным исходом течения пневмонии у взрослых пациентов: избыток ИЛ-8 коррелирует с усилением воспаления в легочной ткани и с последующим развитием дыхательной недостаточности [21].
Для недоношенных новорожденных II подгруппы основной группы с врожденной пневмонией были выявлены достоверные различия только в концентрациях ИЛ-1β, ИЛ-6, ИЛ-12; содержание остальных цитокинов было сходным с содержанием в контрольной группе. Сопоставление полученных данных указывает на существенно больший дисбаланс в работе иммунной системы глубоконедоношенных новорожденных 1-й подгруппы, что можно связать с такими факторами, определяемыми ГВ, как морфофункциональная незрелость организма в целом относящаяся как к иммунной системе, так и к легочной ткани. Кроме того, обращает на себя внимание большая вариабельность уровня ростовых факторов в 1-е сутки после рождения у недоношенных новорожденных 1-й подгруппы по сравнению с контрольной группой.
Содержание исследованных цитокинов в течение раннего неонатального периода у новорожденных обеих групп с врожденной пневмонией представлено в таблице 5.
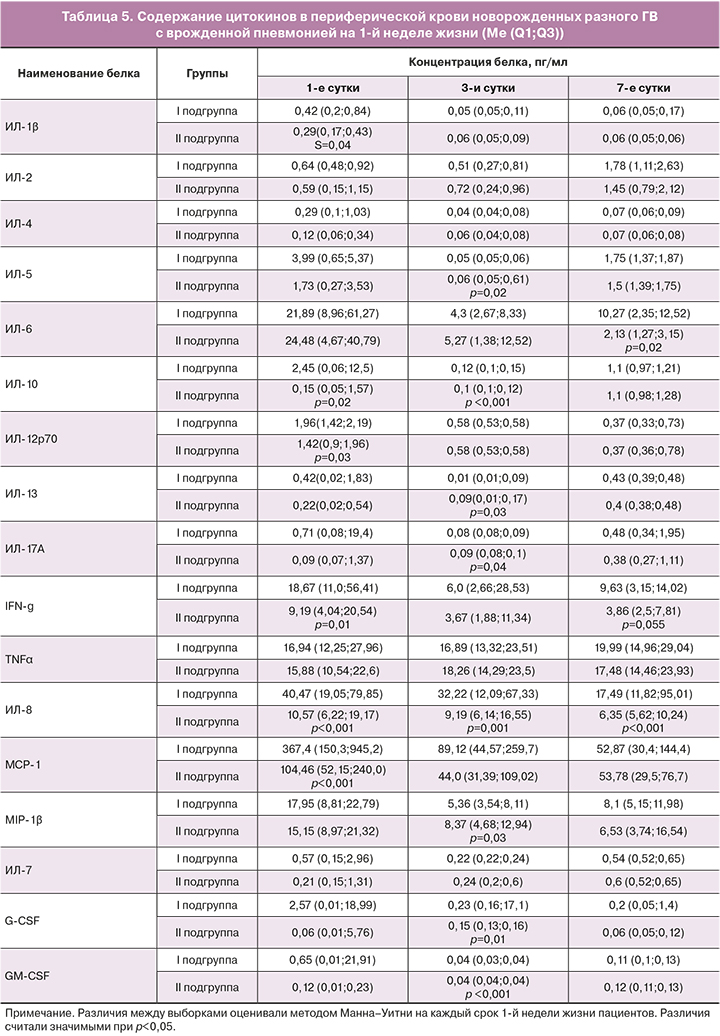
Как следует из представленных в таблице 5 данных, в 1-е сутки после рождения уровень практически всех измеренных цитокинов у недоношенных новорожденных 2-й подгруппы ниже, чем у глубоконедоношенных детей 1-й подгруппы; однако результаты не достигали статистической значимости, за исключением содержания провоспалительных МCP-1, IFN-γ, ИЛ-8, которое было значимо ниже. На 3-и сутки значения исследованных хемокинов практически совпадают, за исключением ИЛ-8, уровень которого оказался ниже, и МIР-1β – значимо выше у новорожденных 2-й подгруппы основной группы. Как известно, MIP-1β формируют острые и хронические воспалительные реакции у человека в местах повреждения или инфекции, играют ключевую роль в индукции и модуляции воспалительных реакций, главным образом путем рекрутирования провоспалительных клеток. Они имеют решающее значение для хемотаксиса Т-клеток от кровотока к воспаленной ткани, а также играют важную роль в регуляции трансэндотелиальной миграции моноцитов, дендритных клеток и NK-клеток [20–22].
На 7-е сутки у недоношенных новорожденных 2-й подгруппы основной группы уровень MIP-1β стал одинаковым с уровнем у недоношенных новорожденных 1-й подгруппы; при этом значимо снизились уровни ИЛ-6 и ИЛ-8 и проявилась яркая тенденция к снижению уровня IFN-γ.
Поскольку динамика выработки ИЛ-6 и ИЛ-8 при врожденной пневмонии у новорожденных имеет значение прежде всего для тактики ведения больных, то в полученных данных обращает на себя внимание сохранение их высокого уровня в течение всего периода наблюдения у недоношенных новорожденных 1-й подгруппы основной группы, что является подтверждением предположения о том, что степень морфофункциональной зрелости, в том числе легочной ткани, к моменту рождения у этой категории новорожденных может являться фактором, определяющим эффективность проводимой терапии. Действительно, длительность лечения в ОРИТН недоношенных новорожденных 1-й подгруппы составила 39 (23,5;46,5) дней по сравнению с недоношенными новорожденными 2-й подгруппы основной группы, у которых она в среднем составляла 7 (4;10) дней (критерий Манна–Уитни, p<0,0001). Кроме того, 19 детям из 28 новорожденных 1-й подгруппы (68%) с подтвержденным диагнозом врожденная пневмония, включенным в исследование, потребовалось проведение повторных курсов антибактериальной терапии, тогда как среди недоношенных новорожденных 2-й подгруппы – лишь 6 пациентам из 48 (12,5%) (критерий Ѕ, p<0,001).
Исходя из изложенного, можно допустить, что различия в цитокиновом профиле (динамика ИЛ-6, ИЛ-8 и IFN-γ) могут иметь значение для прогноза эффективности лечения глубоконедоношенных детей с врожденной пневмонией.
У новорожденных, тем более у недоношенных детей, по сравнению со взрослыми выражена незрелость звеньев врожденного иммунитета. Поскольку онтогенез иммунной системы продолжается в течение всего гестационного периода, то естественно, что иммунная система глубоконедоношенных детей характеризуется количественным и качественным дефицитом факторов врожденного и адаптивного иммунитета по сравнению с детьми, родившимися в срок. Поэтому возможна более частая генерализация инфекционного процесса у недоношенных новорожденных, по сравнению с детьми более старшего ГВ [23]. Кроме того, низкое содержание моноцитов и нейтрофилов у недоношенных новорожденных может приводить к неполноценной защите от патогенных микроорганизмов по сравнению с детьми, рожденными в срок [23]. Врожденная пневмония возникает в результате инфицирования плода во внутриутробном или интранатальном периоде [24–26]. Показано, что активация иммунной системы недоношенного новорожденного, подвергшегося инфекции, в свою очередь, усугубляет истощение содержания моноцитов, что может определять затяжной характер течения врожденной пневмонии у данной когорты пациентов [27].
Выявление при сборе анамнеза у матерей высокой частоты аллергических заболеваний позволяет предполагать влияние генетических или эпигенетических факторов на темпы морфофункционального созревания иммунной системы недоношенных детей. С другой стороны, у женщин не исключается риск возникновения патологических иммунных реакций при имплантации и плацентации, что, в свою очередь, может привести к риску развития осложнений беременности, фетоплацентарной недостаточности, ранней преэклампсии, преждевременных родов. Глубокая степень недоношенности, более низкая масса тела, выраженная незрелость легочной ткани и дисбаланс иммунной регуляции сопровождаются клинически более длительным течением воспалительного процесса в легочной ткани, более продолжительной по времени респираторной терапии, необходимостью применения повторных курсов антибактериальной терапии, что влечет за собой более длительное пребывание пациентов в стационаре.
Заключение
Среди комплекса измеренных растворимых иммунорегуляторных белков плазмы периферической крови (цитокинов, хемокинов, факторов роста) у недоношенных детей ГВ 25–31 недель с врожденной пневмонией по сравнению с недоношенными детьми ГВ 32–26 недель и доношенными детьми ГВ 37 недель выявлена более высокая концентрация провоспалительных медиаторов в плазме периферической крови в 1-е сутки после рождения. Сохранение более высоких концентраций ИЛ-6 и ИЛ-8 у недоношенных детей ГВ 25–31 недель по сравнению с недоношенными детьми ГВ 32–36 недель до 7-х суток жизни включительно свидетельствует о более выраженном уровне системного воспалительного ответа с момента рождения и указывает на более медленные, несмотря на интенсивную комплексную терапию, темпы купирования воспалительного процесса в группе ранних недоношенных детей.



