Несмотря на активное развитие технологий репродуктивной медицины в начале XXI в., частота встречаемости сниженного овариального резерва (СОР) у женщин с бесплодием, вступающих в программу экстракорпорального оплодотворения (ЭКО), составляет от 9 до 24%, продолжая увеличиваться [1, 2].
Разработаны различные методики, направленные на улучшение результатов программ ЭКО/ИКСИ. Введение больших доз гонадотропинов, модифицированный протокол овариальной стимуляции, Duo-stim, комбинации различных схем неоадъювантной терапии дали возможность выбора персонифицированной терапии [3]. В последние годы одним из перспективных направлений неоадъювантной терапии является применение андрогенов до и/или во время стимуляции функции яичников, поскольку, по данным отечественных и мировых исследований, СОР ассоциирован со снижением уровня андрогенов, включая тестостерон [4, 5].
В многочисленных исследованиях установлено, что у женщин после 30–35 лет отмечается снижение их синтеза, что отчетливо прослеживается на модели яичниковой гиперандрогении при синдроме поликистозных яичников [6]. В этот процесс вовлечены органы и системы, в которых наблюдается экспрессия андрогенных рецепторов, инициирующих различную функциональную активность, в том числе сексуальную, как часть репродуктивного процесса.
Согласно теории «двух клеток – двух гонадотропинов», андрогены играют важную роль в обеспечении стероидогенеза в яичниках [7], являясь субстратом для ароматазной активности клеток гранулезы, и, преобразуясь в эстрогены, оказывают прямое аутокринное и/или паракринное влияние на регуляцию фолликулогенеза через одноименные рецепторы в яичниках [8, 9]. Количество и экспрессия андрогенных рецепторов меняются на различных этапах фолликулогенеза с постепенным их снижением при переходе фолликула к его финальной стадии созревания [10]. Экспрессия андрогенных рецепторов положительно коррелирует с количеством и экспрессией маркеров клеточной пролиферации в яичниках и отрицательно – со скоростью клеточного апоптоза [11].
Существующие данные о роли андрогенов в созревании антральных фолликулов свидетельствуют об их влиянии на ароматазную активность в преовуляторных фолликулах [12–14] и инициации овуляторного пика. Тем не менее роль андрогенов в фолликулогенезе продолжает оставаться предметом для открытой дискуссии. Известно, что андрогены вызывают атрезию фолликулов [15, 16], проявляя синергетический эффект с фолликулостимулирующим гормоном (ФСГ), стимулируя синтез инсулиноподобного фактора роста-1 и способствуя рекрутированию фолликулов. Даже при кратковременном применении экзогенных андрогенов в яичниковой ткани происходят изменения, аналогичные морфологической картине мультифолликулярных яичников: увеличение общего количества преантральных и антральных фолликулов в 2,5–4,5 раза [17–19].
В различных исследованиях роли андрогенного прайминга с целью улучшения результатов вспомогательных репродуктивных технологий (ВРТ) применяли различные дозы андрогенсодержащих препаратов. На ранних и промежуточных стадиях созревания фолликулов добавление тестостерона в качестве прайминга может улучшить трансформацию из «спящего» пула в растущий пул [20] и увеличить количество преантральных и антральных фолликулов. Существуют данные о возможном влиянии тестостерона на усиление экспрессии рецепторов ФСГ в клетках гранулезы, потенциально повышая чувствительность яичников к ФСГ. В данном исследовании оценивалось влияние андрогенного прайминга: тестостеронсодержащего геля и таблетированной формы дегидроэпиандростерона (ДГЭА) у женщин с СОР и бесплодием в программах ВРТ (ЭКО/ИКСИ) [21].
Таким образом, целью представленного исследования явилось изучение и сравнительная оценка терапевтического эффекта андрогенного прайминга – ДГЭА и тестостерона на исходы программ ВРТ (ЭКО/ИКСИ) у женщин с бесплодием и СОР.
Материалы и методы
Исследование проводилось на базе 1-го гинекологического отделения института репродукции ФГБУ «НМИЦ АГиП им. В.И. Кулакова» Минздрава России согласно приказу Минздрава России №803н. В исследовании приняли участие 380 женщин с бесплодием и СОР, из которых 75 были исключены перед случайным распределением, поскольку не соответствовали критериям включения: возраст до 43 лет, наличие в анамнезе СОР (уровень антимюллерова гормона (АМГ) ≤1,2 нг/мл и количество антральных фолликулов (КАФ) ≤5 на 3-й день менструального цикла), отсутствие эмбрионов хорошего и отличного качества по данным эмбриологического этапа в предыдущих программах ЭКО/ИКСИ; приняли решение реализовать репродуктивную функцию с ооцитами донора или прекратили лечение до стимуляции яичников (рисунок). Критериями исключения были оперативные вмешательства на яичниках, эндометриоидные кисты яичников, онкологические заболевания, эндокринные и метаболические нарушения в анамнезе.
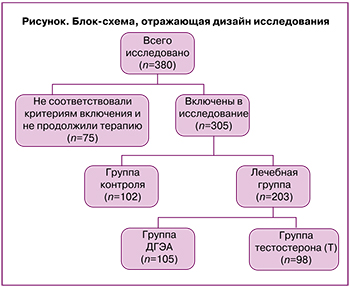
На рисунке представлена блок-схема проводимого исследования, из 380 женщин с СОР 305 удовлетворяли критериям включения. Все женщины случайным образом были разделены на 2 группы: лечебная и группа контроля. Лечебную группу составили 203 женщины, которым был рекомендован андрогенный прайминг: группа Т (n=98) – применение 1% тестостеронсодержащего геля (Андрогель) и группа ДГЭА (n=105) – прием ДГЭА. В группу контроля вошли 102 женщины без терапии.
В группе Т применяли 12,5 мг трансдермального 1% тестостерона (Андрогель 50 мг, Besin Healthcare, Бельгия) на чистую, сухую, здоровую кожу на обоих плечах 1 раз в день вечером в течение 3 месяцев. В группе ДГЭА использовали таблетированную форму ДГЭА 25 мг 3 раза в сутки в течение 3 месяцев. При необходимости контрацепции все женщины использовали барьерный метод в течение 3–6 месяцев до вступления в программу ЭКО.
Во всех группах проведена овариальная стимуляция яичников в протоколе с антагонистами гонадотропин-рилизинг-гормона с использованием гонадотропинов. Ультразвуковое исследование в программе ЭКО/ИКСИ выполняли на аппарате УЗИ GE Voluson p6 (2018, Корея), оборудованном вагинальным датчиком 5–7 МГц. Культивация эмбрионов проводилась в последовательных средах G1-PLUS/G2-PLUS (Vitrolife, Västra Frölunda, Швеция), классификация эмбрионов – в соответствии со стандартной морфологической оценкой по Consesus ALPHA (2011) в зависимости от количества и размера клеток, фрагментации и качества эмбриона. Оценка качества бластоцист проводилась согласно классификации Gardner и Schoolcraft. Бластоцисты с оценкой ≥3BB были отнесены к эмбрионам отличного качества. Перенос эмбрионов был произведен на 5-й день культивирования – стадии бластоцисты. Через 10 дней после переноса эмбрионов проводилась диагностика беременности на основании определения сывороточной концентрации ß-субъединиц хорионического гонадотропина (ХГ). Тест на беременность оценивали как положительный при уровне ß-ХГ более 20 МЕ/л.
Лабораторные исследования проводили на базе клинико-диагностической лаборатории ФГБУ «НМИЦ АГиП им. В.И. Кулакова» Минздрава России. В рамках исследования на 2–3-й день менструального цикла утром натощак проводился забор венозной крови из локтевой вены c помощью закрытых систем для взятия крови S-Monovette (Sarstedt, Германия) с активатором образования сгустка. Для анализа использовали сыворотку, полученную при центрифугировании 3000 об./мин не менее 10 минут на аппарате Eppendorf 5804 (Германия) не позднее чем через 1 ч после взятия крови. При необходимости дополнительных исследований отбирали аликвоты образцов сыворотки крови и сохраняли их при -70°С. Определение андрогенного профиля выполнялось методом иммунохемилюминесцентного анализа (ИХЛА) в сыворотке крови на автоматическом иммунохимическом анализаторе Cobas е411 (Roche Diagnostics GmbH, Германия) с использованием коммерческих наборов данного производителя.
Статистический анализ
Статистическая обработка данных выполнялась с помощью электронных таблиц Microsoft Excel и пaкета статистических программ Statistica v. 10 (StatSoft Inc., США). Количественные показатели были проверены на соответствие нормальному распределению с помощью критерия Колмогорова–Смирнова, которые в работе представлены в виде средних значений и стандартных отклонений М (SD). Качественные показатели представлены в виде абсолютных и относительных величин. Сравнение характеристик и исходов по группам проводилось для количественных переменных с использованием критерия ANOVA (при сравнении трех групп) и t-критерия Стьюдента (для двух групп) (равенство дисперсий проверяли с помощью теста Левена); теста хи-квадрат (χ2), а также одностороннего точного критерия Фишера для пропорций. Анализ изменений показателей в ходе лечения оценивался с помощью парного критерия Стьюдента или критерия Вилкоксона. Значение р<0,05 считалось статистически значимым, а в случае применения поправки Бонферрони для множественного сравнения показателей между тремя группами значимым считали уровень р<0,017.
Протокол данного исследования №2 был одобрен комиссией по этике биомедицинских исследований при ФГБОУ «НМИЦ АГиП им. академика В.И. Кулакова» Министерства здравоохранения РФ от 07 февраля 2019 г.
Результаты
Нами проведено рандомизированное контролируемое исследование 305 женщин с бесплодием и СОР, обратившихся с целью реализовать репродуктивную функцию.
В обеих группах исходно были сопоставимы (p>0,05) средний возраст, индекс массы тела (ИМТ), параметры овариального резерва, гормоны, оцениваемые на 2–3-й день менструального цикла, и ультразвуковое исследование (УЗИ) органов малого таза с определением КАФ (табл. 1). Средний возраст составил 37,6 (4,9) года. У всех женщин отмечался регулярный менструальный цикл. Средний ИМТ составил 23,5 (4,2) кг/м2, средняя длительность бесплодия – 5,7 (2,0) года.

Проведена сравнительная оценка параметров гормонального профиля в лечебной группе до и после 3 месяцев андрогенного прайминга.
Сравнительный анализ средних значений гормонов по данным ИХЛА в сыворотке крови в раннюю фолликулярную фазу показал исходно ниже концентрации общего тестостерона, тогда как после 1 месяца андрогенного прайминга ДГЭА отмечено его увеличение с 0,29 (0,05) до 0,39 (0,05) нмоль/л (р<0,001) (табл. 2). Концентрация андростендиона статистически значимо различалась до и после прайминга ДГЭА, составив 1,2 (0,1) и 5,2 (0,15) нмоль/л до и после лечения соответственно (p<0,001). В группе ДГЭА наблюдалась флюктуация АМГ с 0,84 (0,2) нг/мл до значений в среднем 1,1 (0,25) нг/мл, однако она не была статистически значимой (p=0,34).
На фоне 1 месяца применения тестостеронсодержащего геля отмечено статистически значимое увеличение концентрации общего тестостерона с 0,4 (0,2) до 0,44 (0,05) нг/мл (р<0,001). При анализе концентрации андростендиона на фоне андрогенного прайминга группа тестостерона также показала статистически значимые изменения с 1,3 (0,6) до 5,6 (0,6) нмоль/л (р<0,001). Статистически значимой разницы по показателю АМГ в данной группе выявлено не было (табл. 3).
При сравнительном анализе гормонального профиля лечебной группы с группой контроля отмечены статистически значимые отличия по показателю андростендиона (p<0,001) (табл. 4), что подтверждает предиктивность андростендиона как предшественника андрогенов для диагностики андрогенного дефицита.
Для оценки влияния андрогенного профиля на эмбриологический этап был проведен сравнительный анализ показателей оо- и эмбриогенеза до и после андрогенного прайминга.
По данным анализа эмбриологического этапа на фоне приема ДГЭА выявлены статистически значимые различия по числу ооцитов – с 2,9 (0,3) до 4,4 (0,3), в том числе зрелых – с 1,8 (1) до 3,3 (1,05), зигот – с 1,2 (0,6) до 2,1 (0,7), бластоцист – с 0,8 (0,4) до 1,4 (0,6), частоте бластуляции – с 27,6 до 31,8% (p<0,001) (табл. 5). Отмечено увеличение частоты наступления беременности с 8,6 до 11,4% (p=0,32).
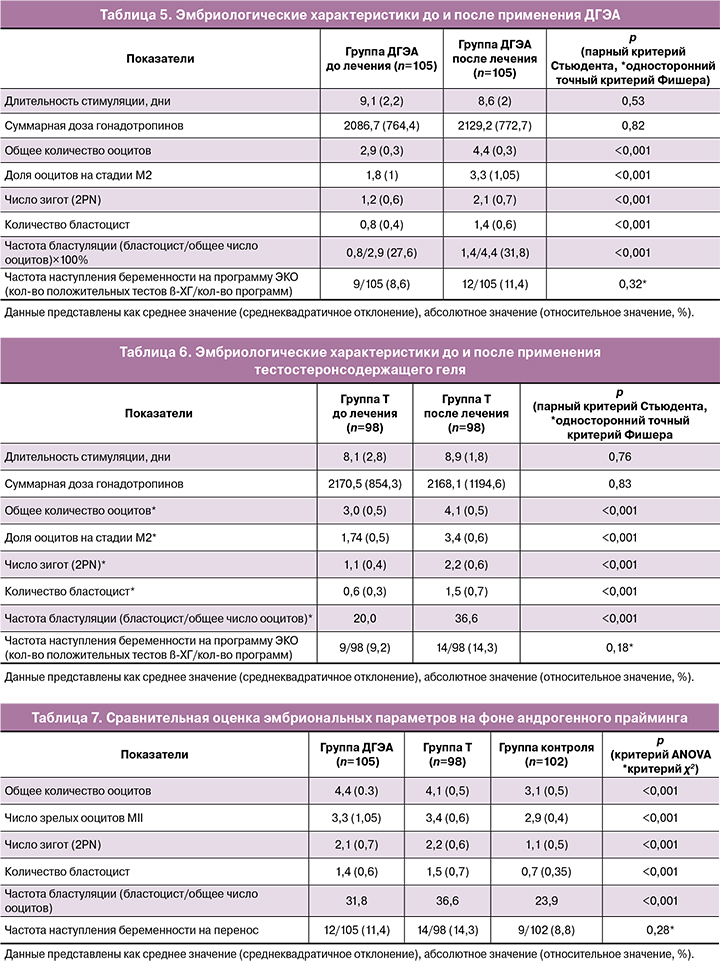
При анализе эмбриологического этапа на фоне тестостеронсодержащего геля также были выявлены статистически значимые различия по числу ооцитов с 3,0 (0,5) до 4,1 (0,5) и зрелых ооцитов – с 1,74 (0,5) до 3,4 (0,6), зигот – с 1,1 (0,4) до 2,2 (0,6), бластоцист – с 0,6 (0,3) до 1,5 (0,7), частоте бластуляции – с 20,0 до 36,6% и частоте наступления беременности (p<0,001), однако в этой группе выявлена большая частота наступления беременности – 14% после терапии по сравнению с группой ДГЭА (табл. 6).
При сравнительном анализе параметров эмбриологического этапа в лечебной группе после 3 месяцев андрогенного прайминга с группой контроля были выявлены статистически значимое изменение количества ооцитов, в том числе зрелых, улучшение раннего эмбриогенеза и бластуляции, что подтверждает положительное влияние терапии андрогенами на ранние исходы ВРТ (табл. 7).
Применение андрогенного прайминга не оказало влияния на длительность проводимой стимуляции и суммарную дозу гонадотропинов во всех исследуемых группах. На фоне андрогенного прайминга не выявлено побочных эффектов.
Обсуждение
В настоящей работе проведено исследование влияния андрогенного прайминга на результаты программ ЭКО/ИКСИ у женщин репродуктивного возраста с бесплодием и СОР. Вопрос выбора рациональной терапии у данной когорты является дискуссионным [22, 23].
По нашим данным, на фоне андрогенного прайминга в программах ЭКО/ИКСИ отмечены большее количество зрелых ооцитов, процент фертилизации и количество бластоцист, статистически значимо более высокий процент наступления клинической беременности, что подтверждается данными многочисленных исследований влияния андрогенного прайминга на исходы ВРТ. Так, в исследовании Davison S.L. et al. выявлена прямая положительная корреляция между концентрацией тестостерона и количеством аспирированных ооцитов [24].
Согласно данным Кокрановского обзора 2015 г., андрогенный прайминг как ДГЭА, так и тестостероном улучшает эффективность проведения программы ЭКО/ИКСИ у женщин с СОР и бесплодием, повышая частоту прогрессирующей беременности при приеме ДГЭА до 15–26% (вместо 12% при использовании плацебо) и при приеме тестостерона – до 10–32% (вместо 8% при использовании плацебо) [25].
По данным метаанализа 2022 г. использование ДГЭА не оказывало влияния на эффективность программы ЭКО, однако андрогенный прайминг с использованием тестостерона увеличивал число ооцитов, а также частоту наступления клинической беременности и живорождения [26].
В нашем исследовании не выявлено побочных эффектов от применения исследуемых препаратов в указанных дозах, хотя в литературе при использовании ДГЭА 75 мг описаны выпадение волос, гирсутизм, склонность к акне и увеличение активности сальных желез [4, 27]. При использовании трансдермального геля Singh A.B. et al. зарегистрировали случаи акне, увеличения активности сальных желез, гирсутизма [28], однако большая часть исследований не сообщают о значимых побочных эффектах [29, 30].
Длительность лечебного курса андрогенами может иметь решающее значение для индукции процессов фолликулогенеза и их роста. Однако данные об оптимальной продолжительности применения андрогенов до сих пор не представлены ввиду разнородности групп женщин со сниженным овариальным резервом. Наиболее распространенная длительность андрогенного прайминга составляет от 4 до 12 недель в дозе от 50–100 мг [31], в нашем исследовании оба прайминга использовались в течение 3 месяцев. Согласно данным Yeung T.W.Y.et al., прайминг ДГЭА уже в течение 3–4 недель позволял увеличить сывороточные концентрации тестостерона (Т) и дегидроэпиандростерона сульфата (ДГЭА-С), однако не влиял на фолликулярные концентрации этих гормонов, а в течение 16 недель увеличивал интрафолликулярную концентрацию ДГЭА-С [32]. Длительность развития фолликулов от 70 до 120 дней объясняет необходимость более пролонгированной терапии у женщин с СОР и бесплодием [33]. Дальнейшим перспективным направлением изучения андрогенного прайминга в программах ВРТ является его стратификация по длительности применения с последующим выбором наиболее эффективной продолжительности курса.
Заключение
Таким образом, согласно полученным данным, нами сделан вывод, что персонификация лечения женщин с бесплодием и СОР путем использования андрогенного прайминга как ДГЭА, так и тестостерон-содержащего геля приводит к улучшению показателей эмбриологического этапа и увеличению эффективности программ ЭКО/ИКСИ по сравнению с группой женщин без терапии. Эти результаты подтверждают преимущества андрогенов как «дирижеров» фолликулогенеза и показывают их клиническую эффективность при своевременном применении у женщин с бесплодием и СОР.



