Кистозно-аденоматозная мальформация легких (КАМЛ) и легочная секвестрация (ЛС) являются наиболее частыми врожденными пороками развития легких плода и новорожденного. КАМЛ возникает в результате нарушения формирования терминальных бронхиол с образованием в ткани легкого различного диаметра кист [1–4]. ЛС – это участок аномально развитой легочной паренхимы, не связанный напрямую с воздухоносными путями, его кровоснабжение осуществляется по аномальным сосудам из системного кровотока – аорты и ее ветвей [3–5].
 Частота встречаемости КАМЛ широко варьирует, от 1:2000–3000 до 1:35 000 к общему числу новорожденных [6–10]. Частота встречаемости ЛС точно неизвестна, что связано с относительной редкостью данного заболевания [5].
Частота встречаемости КАМЛ широко варьирует, от 1:2000–3000 до 1:35 000 к общему числу новорожденных [6–10]. Частота встречаемости ЛС точно неизвестна, что связано с относительной редкостью данного заболевания [5].
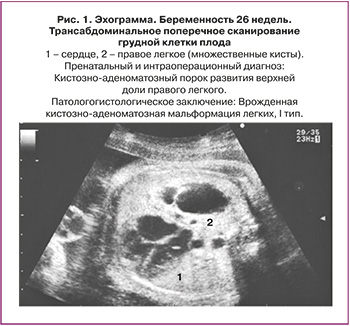
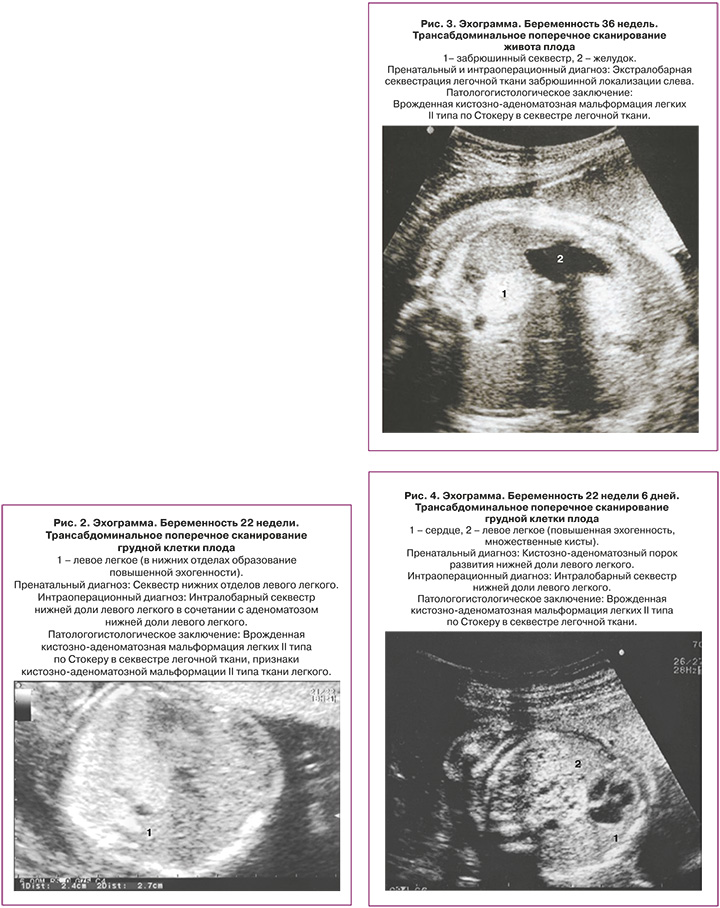
Морфологическая классификация КАМЛ, предложенная J. Stocker, основана на размере кист и характере выстилающего их эпителия. Она одинаково удобна для описания как поражения собственно легочной ткани, так и секвестров легкого: I тип – большие кисты 2–10 см в диаметре, выстланные многослойным эпителием, II тип – кисты 0,5–2 см, выстланные цилиндрическим эпителием, III тип – микрокисты, менее 0,5 см в диаметре, выстланные кубическим эпителием. Впоследствии к этой оригинальной классификации было добавлено еще два типа: 0 тип – солидная ткань и IV тип – одна большая киста. Эти два типа составляют всего 5% всех кистозно-аденоматозных пороков развития легкого (КАПРЛ) [11]. В настоящее время существует мнение, что КАМЛ и ЛС нельзя всегда рассматривать как самостоятельные нозологические единицы. Морфологические исследования свидетельствуют о том, что около 50% КАМЛ и ЛС являются «гибридными формами», имеющими как признаки аномального строения ткани собственно легкого, так и характерные для секвестрации особенности кровоснабжения патологического участка [3, 11–14]. В целом происхождение, морфологические особенности и клинические данные этих заболеваний очень схожи, что позволяет объединить их в группу КАПРЛ (рис. 1–4).
Сопутствующая патология при КАПРЛ выявляется в 3–22% случаев. Наиболее часто это аномалии сердечно-сосудистой и мочевыделительной системы, врожденная диафрагмальная грыжа (ВДГ) [1, 8, 11, 12, 15]. Хромосомная патология встречается крайне редко [8].
Классификация ЛС основана на локализации и связи с долей легкого. Интралобарный секвестр располагается в пределах доли легкого, они покрыты единым листком плевры, часто отсутствует четкая граница между тканью секвестра и нормальной легочной паренхимой. Экстралобарный секвестр полностью отделен от легкого и имеет собственную плевру, может располагаться в плевральной полости или в поддиафрагмальном пространстве, обычно ретроперитонеально [5].
Пренатальная диагностика аномалий легочной ткани в основном возможна с 20–21-й недели беременности [1, 3, 8, 11, 16]. При эхографии в грудной клетке плода определяется увеличение размеров и повышение эхогенности всего легкого или его части с наличием или отсутствием в нем кистозных включений. В подавляющем числе наблюдений изменениям подвергается одна из долей легкого, и процесс имеет одностороннюю локализацию (более чем в 95% случаев) [1, 3, 8, 11]. В 26–28 недель беременности наблюдается пик роста легочной патологии [1, 8]. В дальнейшем, обычно после 32 недель, может происходить уменьшение размера или полное исчезновение внутриутробных эхографических признаков данной патологии [4, 6, 9, 12, 17–20].
Исходы для новорожденного расцениваются как благоприятные в случае неосложненного внутриутробного течения заболевания. Выживаемость новорожденных составляет 88–97% [8, 11, 12]. Неблагоприятным вариантом течения беременности при легочной мальформации является развитие водянки плода [1, 2, 11]. Во внутриутробном периоде появление данного осложнения при пороках легкого отмечено в 5–9% наблюдений [8, 12], что значительно ниже, чем в популяции. По данным литературы, частота встречаемости неиммунной водянки плода составляет 1 на 3000–4000 новорожденных [20–22]. При консервативной тактике ведения беременности при водянке плода частота летального исхода варьирует в пределах 50–100% [11, 12]. В настоящее время при развитии данного осложнения внутриутробно у плода с пороком легкого возможно проведение хирургического лечения: при наличии крупных кистозных полостей – торакоамниотическое шунтирование [8, 12], склеротерапия [23], при ЛС – внутриутробная лазерная коагуляция питающего сосуда [12].
Как уже отмечалось ранее, в процессе прогрессирования беременности к окончанию III триместра в 15–50% случаев происходит исчезновение патологических признаков рассматриваемой патологии [1, 8, 11, 12]. Однако после обследования новорожденных (КТ или МРТ с контрастированием сосудов) «исчезнувшая» патология вновь обнаруживается в 60–100% случаев [6, 11, 12]. При этом авторы отмечают низкую диагностическую точность рентгенографии (около 60%) по сравнению с КТ.
Тактика ведения беременности при патологии легких зависит от размеров образования. Большие размеры образования и смещение средостения требуют родоразрешения в условиях специализированного стационара с возможностью оказания хирургической помощи [1, 7].
Тактика ведения новорожденных с бессимптомным течением заболевания неоднозначна. Часть специалистов придерживаются консервативной тактики ведения [1, 7, 16, 24]. Однако большинство детских хирургов полагают, что проведение плановой операции до появления явных симптомов более безопасно и дает лучшие результаты. Пациенты с данной патологией легких, диагностированной внутриутробно, несмотря на отсутствие симптомов после рождения, должны быть обследованы в возрасте 4–6 недель, а в возрасте 3–6 месяцев в случае необходимости им проводится резекция пораженного участка легкого или секвестрэктомия [23]. При этом важно отметить, что ранняя резекция патологического участка легкого может также способствовать компенсаторному росту и увеличению нормального легкого [3, 4, 25–28].
Материалы и методы
Нами проведен анализ медицинской документации 363 беременных, которые обратились на пренатальный консилиум специалистов Центра в период с 01.01.2010 по 31.12.2019 гг. по поводу выявленного порока легких у плода.
При всех обращениях проводили экспертное ультразвуковое исследование плода по стандартной методике с необходимыми измерениями и оценкой в системе Astraia, а также экспертное ЭхоКГ плода. Ультразвуковое исследование осуществляли при помощи приборов Siemens SONOLINE Elegra (Германия), Alfa 10, Aloka (Япония), Voluson E8 (GE) с использованием трансабдоминального конвексного датчика частотой 3,5 МГц и линейного датчика с частотой 7,5 МГц. Наряду с этим всем пациенткам проводилась допплерография и кардиотокография с использованием полностью автоматизированного отечественного кардиомонитора фирмы «Уникос» (Москва).
При обнаружении отклонений в развитии легких у плода определяли сторону поражения, размеры и эхоструктуру патологического очага и эхографически здоровых участков пораженного легкого, контралатерального легкого, оценивали наличие и размеры кистозных полостей, их количество, а также выявляли признаки и степень смещения средостения. В режиме допплеровского картирования изучали кровоснабжение аномального участка легкого. Общий осмотр всех органов и систем плода выполняли для исключения других врожденных аномалий, а также осложнений – сердечной недостаточности и неиммунной водянки.
При осмотре в III триместре беременности оценивали ультразвуковую динамику картины легких плода и сравнивали с первичными данными (собственными или по данным медицинской документации).
В случае рождения ребенка в Центре проводили обследование новорожденного для уточнения диагноза и выявления показаний к хирургическому лечению.
Результаты
За 10-летний период в Центре проведен анализ 363 беременностей с пренатально выявленными врожденными пороками легкого у плода. В 48/363 (13,2%) наблюдениях первичный диагноз был установлен на базе отделения ультразвуковой и функциональной диагностики Центра. В остальных наблюдениях (315/363 (86,8%)) признаки врожденного порока развития легочной ткани обнаружены на ультразвуковом скрининге по месту жительства.
Срок первичной диагностики врожденного порока легкого, по данным медицинской документации, в 351/363 (96,7%) наблюдении составил 20–22 недели, в 12/363 (3,3%) наблюдениях – 13–19 недель.
В сроках от 13 до 28 недель (в среднем 23±2 недели) пренатальный консилиум в Центре прошли 192/363 (52,9%) женщины. В 171/363 (47,1%) наблюдении первичное посещение консилиума имело место в III триместре беременности, в связи со значительной территориальной удаленностью регионов консультации этих женщин в ранних сроках беременности были проведены по телемедицинской связи – определяли тактику дальнейшего наблюдения и рекомендовали очную явку после 32-й недели.
При первичном ультразвуковом исследовании патологический процесс несколько чаще диагностировали в левом легком (95/192 (49,5%)), чем в правом (85/192 (44,3%)), а также в забрюшинном пространстве (12/192 (6,2%)).
Повышение эхогенности и увеличение размеров пораженного легкого было выявлено во всех наблюдениях (192/192 (100%)). У 138/192 (71,9%) плодов в структуре патологически измененного легкого обнаружены кисты, при этом в 107/138 (77,5%)) наблюдениях они были множественными, в 31/138 (22,5%) – единичными. Диаметр кист варьировал от 0,5 см до 10 см. Наиболее часто встречались небольшие кисты (менее 2 см) – 87/138 (63%) наблюдений, тогда как крупные (2–5 см) и гигантские (более 5 см) – гораздо реже, соответственно в 45/138 (32,6%) и 6/138 (4,3%) наблюдениях. Смещение средостения увеличенным легким выявлялось в подавляющем большинстве наблюдений II триместра (156/192 (81,3%), при этом значительное увеличение размеров пораженной части легкого чаще было связано с его кистозным строением (121/156 (77,6%)), чем солидным (35/156 (22,4%)). ЛС забрюшинной локализации установлена в 12/192 (6,2%) наблюдениях.
Следует отметить, что при обнаружении объемного образования забрюшинного пространства необходимо проводить дифференциальную диагностику с образованиями надпочечника. Для ЛС забрюшинного расположения характерны повышенная эхогенность и четкие контуры, а также выявление отдельного питающего сосуда. Необходима также четкая визуализация ипсилатерального надпочечника отдельно от образования.
Осложненное течение порока легкого во II триместре беременности выявлено в 11/192 (5,7%) наблюдениях, среди них гидроперикард (1), гидроперикард и гипертрофия миокарда (1), асцит (1), многоводие (2), признаки универсального отека тканей плода с накоплением жидкости в полостях – неиммунная водянка плода (6).
Ультразвуковое исследование в III триместре беременности (как первичное, так и в динамике) было выполнено 318/363 (87,6%) пациенткам. При этом сравнивали эхографическую картину легких плода с данными II триместра, полученными в ходе собственного первичного исследования (при повторном посещении консилиума – 145/363 (39,9%)) либо содержащимися в медицинской документации из региона (при первичном обращении в позднем сроке – 173/363 (47,7%)). В 45/363 (12,4%) случаях данные получить не удалось в связи с неявкой на повторное исследование. Положительная динамика патологии легких плода была установлена в 247/318 (77,7%) наблюдениях, это проявлялось уменьшением размера патологического очага, количества и размера кистозных полостей, уменьшении выраженности смещения средостения, исчезновении жидкости в полости перикарда. При этом в ряде случаев при повторных исследованиях признаков порока развития легкого обнаружить не удавалось вовсе (39/318 (12,3%)). Отсутствие изменений порока легких констатировано в 58/318(18,2%) наблюдениях, при этом все объемные образования забрюшинного пространства сохраняли свою форму, размеры и ультразвуковые характеристики. Отрицательная динамика в виде нарастания размеров порочной части легкого и присоединения признаков неиммунной водянки плода установлена у 12/318 (3,8%) пациенток. В одном наблюдении при первично выявленной гигантской кисте с признаками нарастания сердечной недостаточности и появления асцита у плода произведена попытка внутриутробного шунтирования кистозной полости, которая позволила снизить внутригрудное напряжение и добиться положительной динамики состояния плода (1/318 (0,3%)).
На пренатальном этапе диагностики устанавливали пять видов диагноза: КАМЛ – 181/363 (49,9%), секвестр легкого – 66/363 (18,2%), объемное образование забрюшинного пространства (секвестр легкого) – 22/363 (6,1%), КАПРЛ – 89/363 (24,4%), киста легкого – 5/363 (1,4%). Сопутствующие аномалии других органов и систем были диагностированы у 26 плодов (26/363; 7,2%), среди них ВДГ – 8 (2,2%), пороки сердечно-сосудистой системы – 8 (2,2%), мочевыделительной системы – 4 (1,1%), желудочно-кишечного тракта – 5 (1,4%), наружных половых органов – 1 (0,3%). В 4 наблюдениях порок легкого встретился при многоплодной беременности (4/363 (1,1%)), при этом в 3 наблюдениях – у одного плода из двойни, в одном – у обоих плодов.
Признаки осложненного течения порока легкого у плода (накопление жидкости в полостях, развитие неиммунной водянки) на протяжении беременности выявлены у 16/363 (4,4%) пациенток, среди них у 11 – в начале II триместра беременности и у 5 – в конце (до 30 недель гестации). Исход одной беременности с ранним появлением многоводия нам неизвестен. В 4 наблюдениях отмечена положительная динамика в виде самопроизвольного исчезновения жидкости из полостей (3) и при помощи внутриутробного шунтирования (1). Две беременности были прерваны в сроке до 22 недель, в двух случаях установлена внутриутробная гибель плодов, в остальных семи беременность закончилась рождением детей разной степени недоношенности с признаками неиммунной водянки и ранней смертью вследствие тяжелой некупируемой дыхательной и полиорганной недостаточности.
Родоразрешение 271 беременной с пренатальным диагнозом врожденного порока легкого у плода состоялось в акушерских отделениях Центра. Родился живым 271 ребенок (в 1 наблюдении – двойня с поражением легкого у обоих детей), в 1 случае произошла внезапная внутриутробная гибель доношенного плода до начала родовой деятельности (по данным патологоанатомического исследования, вследствие острой гипоксии при формировании истинного узла пуповины (1/272 (0,4%)).
Признаки интранатальной асфиксии средней и тяжелой степени в раннем неонатальном периоде наблюдали у 26/271 (9,6%) детей, при этом реанимационные мероприятия с интубацией трахеи и искусственной вентиляцией легких с рождения потребовались только в 13 случаях: у 8 детей с ВДГ, у 4 с неиммунной водянкой и у 1 с крупной кистой легкого. В подавляющем большинстве родоразрешений признаков интранатальной асфиксии не наблюдали (245/271 (90,4%)).
Всем детям с пренатально установленным диагнозом врожденного порока легкого был выполнен стандартный комплекс исследований легких (рентгенография в прямой проекции, УЗИ плевральных полостей и забрюшинного пространства, КТ или МРТ органов грудной клетки и брюшной полости). Умершим в раннем неонатальном периоде детям, а также мертворожденному ребенку диагноз подтвержден при патологоанатомическом исследовании. Спектр выявленных пороков развития органов грудной клетки представлен в таблице 1.
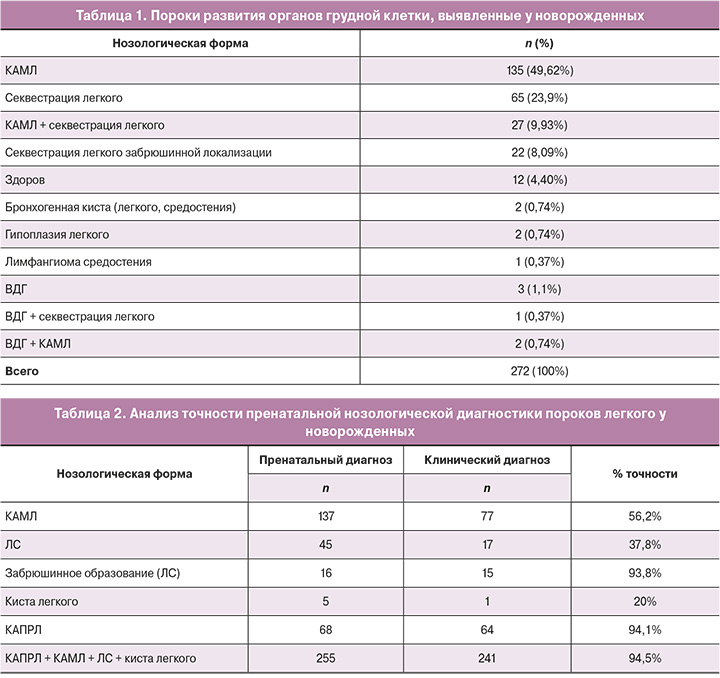
Таким образом, пренатально выявленный врожденный порок развития легкого был подтвержден после рождения у 252/272 (92,6%) новорожденных детей, у 12/272 (4,4%) констатировано разрешение внутриутробной патологии. У 9/272(3,3%) новорожденных оказались другие пороки развития органов грудной клетки. В 3 наблюдениях у детей с врожденной диафрагмальной грыжей признаков поражения легочной ткани установлено не было, в 2 наблюдениях выявлена гипоплазия одного легкого в сочетании с викарной гипертрофией контралатерального, в 2 – диагностированы бронхогенные кисты разной локализации, в 1 – небольших размеров лимфангиома средостения и в 1 наблюдении не подтвердился ни порок легкого, ни врожденная диафрагмальная грыжа – у ребенка имелась небольшая парциальная релаксация левого купола диафрагмы.
Как уже отмечалось выше, в 39/318 (12,3%) наблюдениях, проведенных в динамике в конце беременности, эхографические признаки патологии легких отсутствовали, 35 детей из этой группы рождены и обследованы в Центре. Истинное разрешение процесса подтверждено только у 4 детей, в остальных случаях установлены выявленные ранее признаки порока легочной ткани.
Анализ точности пренатальной нозологической диагностики пороков легкого у новорожденных представлен в таблице 2.
Точность нозологической пренатальной диагностики невелика, за исключением забрюшинной локализации ЛС, как и врожденных пороков развития легкого в целом. Возможно, это связано с многообразием ультразвуковой картины КАМЛ и ЛС на пренатальном этапе и отсутствием их патогномоничных признаков, а также нередким развитием «гибридных» пороков, что и обусловливает нозологические ошибки диагностики.
Хирургическое лечение по поводу врожденного порока развития легочной ткани в периоде новорожденности выполнено 214/252 (84,9%) детям. В 32 наблюдениях была избрана консервативная тактика – в связи с небольшими размерами поражения легочной ткани и отсутствием клинических признаков дыхательной недостаточности (32/252; 12,7%). В 5 наблюдениях оперативное вмешательство не выполнено в связи с тяжестью состояния и ранней смертью: у 3/252 (1,2%) детей с неиммунной водянкой плода, у 2/252 (0,8%) – с сочетанной врожденной диафрагмальной грыжей. 1 ребенок родился мертвым (1/252 (0,4%)). Хирургические вмешательства у 199/214 (93%) детей были выполнены миниинвазивным торакоскопическим доступом, что уменьшает операционную травму, сокращает длительность послеоперационного периода и обеспечивает хороший косметический результат. С 2012 г. все операции при врожденных пороках развития легких выполняются при помощи видеоэндоскопической техники. В послеоперационном периоде проведено морфологическое исследование всех образцов удаленных тканей, диагнозы врожденных пороков легочной ткани были подтверждены.
Хирургическое лечение было эффективным у 213/214 (99,5%) детей. Они выписаны домой. Рост и развитие соответствовали возрасту по данным катамнестического наблюдения длительностью от 1 месяца до 10 лет. Послеоперационная летальность составила 0,5% – 1/214 недоношенный ребенок с выраженной незрелостью легочной ткани условно здоровых долей легкого. Несмотря на успешно проведенное удаление патологической доли легкого, смерть наступила из-за нарастающей тяжелой дыхательной недостаточности.
На основании известных нам исходов 318 плодов и детей с врожденными пороками развития легкого (272 – рожденные в условиях нашего Центра и 46 – в других лечебных учреждениях) общая летальность с учетом внутриутробных и постнатальных потерь составила 15/318 (4,7%), дооперационная – 14/318 (4,4%) и послеоперационная – 1/318 (0,3%). Положительный результат беременности и лечения новорожденных мы наблюдали в 303/318 (95,3%) наблюдениях.
Обсуждение
КАМЛ и ЛС – наиболее часто встречающаяся патология легких у плода. Точность ультразвуковой диагностики легочной мальформации в пренатальном периоде довольно высока. За 10-летний период под нашим наблюдением находились 363 плода с этой патологией. После рождения установлено, что точность внутриутробной диагностики составила 92,6%, в постнатальном периоде патология не выявлена в 4,4%, ошибки диагностики были допущены в 3,3%.
Сопутствующая патология развития при легочной мальформации встречалась редко, в наших наблюдениях – в 7,2%, по данным литературы – в 3–18% [1, 8, 11, 12, 15]. Наиболее часто отмечались ВДГ, патология сердечно-сосудистой и мочевыделительной системы.
В 96,7% наблюдений срок диагностики пороков легкого составил 20–22 недели гестации, что согласуется с данными литературы [1, 2, 9, 11, 16].
Основными эхографическими признаками врожденного порока развития легкого являлись повышение эхогенности ткани, увеличение его в размерах, наличие в структуре образования кистозных полостей, а также смещение средостения в контралатеральную сторону. Об осложненном течении заболевания свидетельствовали признаки накопления жидкости в полостях (гидроторакс, асцит, гидроперикард) и отеки мягких тканей плода с развитием неиммунной водянки. Исследование кровотока патологического очага не всегда бывает успешным, несмотря на возможности современной аппаратуры.
К концу беременности в наших наблюдениях уменьшение патологического участка в легких отмечалось у 77,7% плодов и полное исчезновение эхографических признаков данной патологии – у 12,3%. Это также согласуется с данными литературы, где указанное явление отмечено соответственно в 32–76% и 15–50% наблюдениях [1, 4, 6, 8, 9, 11, 12, 27]. Установленная закономерность, по-видимому, связана с уменьшением размеров очага относительно массы здоровой легочной ткани к концу беременности, а также с изменением эхогенности как здоровой, так и патологической легочной ткани, особенно при мелкокистозном варианте.
Существует мнение, что основной причиной неблагоприятных исходов при патологии легких является развитие водянки плода, что отмечается в 5–9% случаев [8, 12]. В наших наблюдениях это осложнение возникло у 4,4% плодов. В связи с множеством причин возникновения водянки плода зачастую выявить среди них ведущую затруднительно. Значимую роль в этом, по-видимому, играют как инфекционные факторы, так и нарастание сердечной недостаточности вследствие сдавления средостения. По данным литературы, неиммунная водянка плода встречается в 1 случае на 3000–4000 новорожденных [20–22], что значительно чаще, чем при пороках легких.
Благоприятный исход беременности и лечения новорожденных мы наблюдали в 303/318 (95,3%) случаях с известными нам исходами. Общая летальность плодов и детей с врожденными пороками развития легкого с учетом внутриутробных и постнатальных потерь составила в нашем наблюдении 15/318 (4,7%) случаев (из них дооперационная – 14 (4,4%) и послеоперационная – 1 (0,3%)). По данным литературы, выживаемость плодов и новорожденных составляет 88–97%. Причинами неблагоприятного исхода являются преждевременные роды, внутриутробная или неонатальная гибель, прерывание беременности по показаниям, не связанным с патологией легких, вирусная пневмония после рождения [8, 11, 12].
В 271 наблюдении родоразрешение произведено в условиях Центра. 90,1% новорожденных родились без признаков интранатальной асфиксии, реанимационные мероприятия и ИВЛ потребовались 4,8% новорожденных с ВДГ и неиммунной водянкой плода.
Большинство специалистов золотым стандартом диагностики патологии легких после рождения считают МРТ- и КТ-исследование и рекомендуют выполнять его всем новорожденным с пренатально установленным диагнозом, в том числе и при полном «исчезновении» эхографических признаков этой патологии в конце беременности [6, 10, 11].
В наших наблюдениях в конце беременности эхографические признаки рассматриваемой аномалии легких не выявлялись у 39 плодов, однако по результатам МРТ и КТ, выполненных после рождения, у 31 новорожденного (88,6%) они вновь диагностированы. По данным литературы, выявление «исчезнувшей» патологии после рождения отмечается у 60–100% новорожденных [6, 11, 12].
Хирургическое лечение после рождения было проведено у 214 новорожденных (84,9%). Послеоперационная выживаемость составила 99,5% (213 новорожденных), летальность – 0,5% (1 недоношенный новорожденный).
Анализ точности нозологической диагностики пороков легких в пренатальном периоде выявил высокую эффективность эхографии в диагностике ЛС забрюшинной локализации (93,8%) и пороков развития легких в целом (94,5%).
Однако необходимо отметить, что постановка точного диагноза того или иного порока развития легкого на пренатальном этапе не оказывает влияния на тактику дальнейшего наблюдения беременности, выбор способа родоразрешения, а также спектра обследования новорожденного. Поэтому считаем целесообразным полученные пренатальные ультразвуковые данные о врожденном пороке легкого объединять в собирательное понятие «КАПРЛ», за исключением образований забрюшинной локализации, в диагностике которых также имеются свои особенности и трудности. Постановка пренатального диагноза КАПРЛ полностью отражает суть процесса, позволяет своевременно провести необходимые разъяснения будущим родителям, проследить развитие процесса до родоразрешения и обследовать новорожденного для решения вопроса о последующей тактике наблюдения и лечения.
Выводы
1. Срок первичной диагностики врожденных пороков развития легкого в подавляющем большинстве случаев соответствует II триместру, именно в этом сроке ультразвуковая картина изменений легкого наиболее типичная и информативная.
2. В большинстве случаев в пренатальном периоде отмечаются значительные сложности ультразвуковой диагностики отдельных нозологических форм легочной мальформации, однако собирательное понятие «кистозно-аденоматозный порок развития легкого (КАПРЛ)» полностью отражает суть патологического процесса в ткани легкого, не нуждается в дальнейшем уточнении, позволяет прогнозировать течение беременности.
3. Отсутствие ранее выявленных признаков порока легкого при динамических исследованиях в III триместре беременности не является свидетельством полного выздоровления плода, новорожденные дети в обязательном порядке должны быть обследованы после рождения для подтверждения или исключения поражения легочной ткани.
4. Серьезным осложнением беременности при КАПРЛ является развитие неиммунной водянки плода, которая обуславливает пренатальную и постнатальную смертность вследствие недоношенности и незрелости легких. Вместе с тем частота ее выявления не превышает таковую в популяции и не является следствием только легочной патологии.
5. Врожденные КАПРЛ у плода являются прогностически благоприятными, что подтверждается выявленными закономерностями их динамического развития на протяжении внутриутробного периода, редкостью сопутствующих аномалий других органов и систем, а также результатами наблюдения, обследования и хирургического лечения новорожденных.



