Как показывают многочисленные исследования, поддержка лютеиновой фазы (ЛФ) у женщин в протоколах экстракорпорального оплодотворения (ЭКО) – необходимость, которая не оспаривается [1–3]. Однако с целью повышения эффективности программ ЭКО применяются различные подходы. Для максимальной эффективности программы ЭКО (получения эуплоидного эмбриона) нужно не менее 10–15 ооцитов, но при этом нельзя не учитывать риск синдрома гиперстимуляции яичников, который снижает безопасность программы вспомогательных репродуктивных технологий (ВРТ). Снижения подобного риска помогает добиться сегментация циклов ЭКО [4]. Кроме того, одним из факторов, ведущих к сегментации цикла ЭКО, является возраст женщины, вступающей в протокол, и необходимость в связи с ним, более того, с недавнего времени – это прямое показание, преимплантационного генетического тестирования эмбриона на предмет анеуплоидий (ПГТ-А) [5]. В условиях, когда большое число циклов протоколов ЭКО подвергается сегментации, важным является каждый фактор, в том числе и выбор гестагена в циклах с витрифицированным эмбрионом, в связи с чем предпринято настоящее ретроспективное когортное исследование.
Цель исследования: оценить эффективность ПГТ-А в различных протоколах ВРТ с витрифицированным эмбрионом.
Материалы и методы
Ретроспективно проанализировали исходы циклов с переносом витрифицированного эмбриона с поддержкой ЛФ дидрогестероном в зависимости от типа протокола. Женщины в сегментированные циклы вступали согласно трем типам протоколов. Первый протокол (172 цикла): ультразвуковой (УЗ) мониторинг овуляторного цикла с использованием триггера овуляции («Овитрель» 6500 п/к или хорионический гонадотропин человека (ХГЧ) 5000 в/м) при наличии фолликула 17–18 мм; старт приема препарата дидрогестерона 10 мг через 37 ч в дозировке 10 мг 3 раза в сутки и перенос эмбриона через 124–125 ч действия препарата гестагена. Второй протокол (62 цикла) предполагал назначение препарата эстрадиола («Прогинова» 2 мг 2 раза в день перорально или «Дивигель» по 1 г 2 раза на кожу, согласно инструкции по применению лекарственного препарата) с 3–5-го дня менструального цикла на фоне УЗ-мониторинга роста эндометрия. Старт препарата дидрогестерона по 10 мг 3 раза в сутки при наличии эндометрия более 8 мм и перенос эмбриона через 124–125 ч действия препарата. Третий протокол применялся у пациенток с рецидивирующей гиперплазией эндометрия в анамнезе, аденомиозом 2–3-й степени и ранними овуляциями. В естественном цикле перед циклом криопереноса назначался агонист гонадотропин-рилизинг-гормона (ГнРГ) с 17–19-го дня цикла («Диферелин» 3,75 мг). Старт препаратов эстрогена («Прогинова» 2 мг 2 раза в день или «Дивигель» по 1 г 2 раза на кожу согласно аннотации препарата) проводили после УЗ-контроля через 3–6 недель действия агониста ГнРГ. Далее проводился мониторинг роста эндометрия и назначались дидрогестерон по 10 мг 3 раза в сутки при наличии эндометрия более 8 мм и перенос эмбриона через 124–125 ч действия препарата. Все пациентки получали индивидуально подобранную прегравидарную подготовку и были обследованы по приказу № 107н. Проводился гормональный мониторинг в день назначения препаратов прогестерона (анализ крови на содержание эстрадиола, прогестерона, лютеинизирующего гормона выполняли в лабораториях сети «Хеликс»).
Перенос эмбриона осуществлялся с использованием УЗ-контроля катетером Kitazato #213325 или TDT. Пациентки сразу вставали после проведенного переноса. Диагностика наступления беременности проводилась через 14 дней посредством анализа крови на ХГЧ и визуализации плодного яйца в полости матки через 21 день после переноса эмбриона. Для каждой женщины производили расчет частоты имплантации, вычисляя его как отношение числа плодных яиц к числу перенесенных эмбрионов, выраженное в процентах [6]. По правилам расчета среднего и его среднеквадратичного отклонения вычисляли частоту имплантации для сформированных групп пациенток.
Повторное УЗИ влагалищным датчиком проводилось через 30–35 дней после переноса эмбриона для визуализации сердцебиения эмбриона. Отмена препаратов эстрадиола проводилась постепенно под контролем двукратной сдачи крови и уровня в крови утром на фоне минимального значения эстрадиола (лаборатории сети «Хеликс»). Препарат прогестерона (дидрогестерон) пациентки принимали до 12 недель беременности в дозировке 10 мг по 3 раза в день. При наличии кровянистых выделений проводился УЗИ-мониторинг с однократным приемом дидрогестерона 40 мг и далее по 10 мг каждые 6 ч до окончания выделений с последующим возвращением на дозу 30 мг в сутки. На период кровянистых выделений также назначался препарат транексамовой кислоты 250–500 мг 2–3 раза в день. В сроке 8–9 недель пациентки вставали на учет по беременности в МБУ «Екатеринбургский клинический перинатальный центр» или по месту жительства. Скрининг в 12 недель проводился на базе Клинико-диагностического центра «Охрана матери и ребенка» (Екатеринбург), родоразрешение – в роддомах Екатеринбурга и области. На почту клиники пациентки высылали данные трех скринингов беременности и выписку из роддома с данными о ребенке.
Культивация, оценка и заморозка, хранение. Разморозка, оценка, процедура переноса
В программах ЭКО через 40±1 ч после постановки триггера овуляции проводилась процедура интрацитоплазматической инъекции (ИКСИ) для всех зрелых ооцитов. После инъекции ооциты убирали в среду для культивации Irvine CSCM-C. Через 16–18 ч проводились оценка оплодотворения и сортировка зигот по количеству пронуклеусов. Все аномально оплодотворенные яйцеклетки, более или менее двух пронуклеусов, утилизировались, остальные эмбрионы культивировались до 5-х или 6-х суток. На 5-й день развития проводился осмотр бластоцист с оценкой развития трофэктодермы и внутренней клеточной массы; те эмбрионы, к которым неприменима система оценки по Гарднеру, культивировались до 6-х суток. Пригодные к криоконсервации эмбрионы замораживались витрификационным методом с использованием сред Kitazato на открытых носителях Cryotop и хранились в сосудах Дьюара в жидком азоте с информированного согласия пациентов.
Нормально оплодотворенные эмбрионы культивировались до 5–6-х суток до стадии бластоцисты, после чего оценивалось качество по Гарднеру. Пригодным для биопсии эмбрионам проводился вспомогательный хетчинг путем иссечения блестящей оболочки с последующим забором 3–7 клеток трофэктодермы. По окончании процедуры каждый образец биоматериала промывался в буфере, помещался в индивидуальную промаркированную ПЦР-пробирку объемом 0,2 мкл, затем пробирки упаковывались в штативы с ФИО пациента и отправлялись в лабораторию для анализа ПГТ-А, эмбрионы витрифицировались и хранились до получения результата генетического тестирования. Образцы трофэктодермы отправлялись в лабораторию (First Genetics, Москва) с соблюдением температурного режима –20°C. После попадания штативов в лабораторию происходила их регистрация, и биоматериал подвергался полногеномной амплификации (WGA), затем проводился скрининг хромосомных аберраций методом Next-generation sequencing (NGS)
В день планируемого криопереноса эмбрионы размораживались с использованием сред Kitazato по стандартному протоколу, после чего помещались в чашку для переноса со средой для культивации Irvine CSCM-C. Через 1 ч после разморозки оценивалась выживаемость эмбрионов в цикле заморозки-разморозки, выражаемая долей интактных клеток. Через 2 ч после разморозки проводилась процедура переноса эмбрионов в полость матки реципиента с помощью трансферного катетера Kitazato #213325 или TDT. Тип катетера выбирался врачом непосредственно во время процедуры в зависимости от анатомических особенностей пациентки. В конце переноса катетер промывался буферным раствором G-MOPS Plus и осматривался на предмет задержки эмбрионов. Задержавшиеся в катетере эмбрионы снова помещали в среду для культивации и повторяли перенос с новым катетером [7].
Статистический анализ
Статистический анализ полученных результатов проводился при помощи пакета программ Statistica 6.0 (Statsoft, США). Для количественных признаков рассчитывались среднее значение и его среднеквадратичное отклонение (М±SD), для качественных – абсолютная величина (n) и доля (%) от общего объема группы. При межгрупповом сравнении показателей (их распределение отличалось от нормального) использовали критерий Манна–Уитни, при множественном сравнении – критерий Краскела–Уоллиса. Различия между качественными признаками проверялись при помощи критерия χ2. Если достигнутый уровень различий не превышал 0,05, их считали статистически значимыми [8].
Результаты
В исследовании оценили поддержку дидрогестероном на фоне одного из трех типов протоколов криопереноса (табл. 1), а также изучили влияние ПГТ-А эмбрионов в различных протоколах на исходы программ ЭКО с витрифицированным эмбрионом. Женщины из группы использовавших Протокол 1 чаще, чем прочие, впервые обращались к репродуктологу для преодоления проблемы бесплодия. В группе женщин, пролеченных с использованием Протокола 2, не было программ суррогатного материнства. Возраст женщин из группы с Протоколом 3 был значимо выше, чем возраст женщин из двух других групп. Выявленные различия имели под собой клиническое обоснование, а в остальном женщины, вступившие в программы криопереносов согласно трем типам протоколов, не имели значимых различий (табл. 1).

Это касалось и исходов циклов ЭКО с витрифицированным эмбрионом с поддержкой ЛФ дидрогестероном, вошедших в настоящее ретроспективное исследование: значимых различий ни по одному показателю не было выявлено (табл. 2).
Принимая во внимание, что наличие ПГТ-А может оказать существенное влияние на исход программы ЭКО, внутри каждой из групп произвели разделение на подгруппы в зависимости от наличия или отсутствия ПГТ-А (ПГТ+ или ПГТ-) в протоколе и проанализировали ключевые показатели, которые могут определить исход программы, а также сами исходы изучаемых протоколов.
В группе из 172 циклов с витрифицированным эмбрионом, леченных с использованием Протокола 1, выявлено, что у женщин, принявших решение о ПГТ-А, в полость матки было перенесено в среднем значимо меньше эмбрионов (табл. 3). Частота биохимической беременности оказалась выше в подгруппе с ПГТ-А, нежели без этой процедуры (51% против 34% соответственно). Однако различия на этапе клинической беременности оказались нивелированы. Все остальные критерии оценки течения программы на фоне поддержки дидрогестероном оказались сопоставимы в зависимости от наличия или отсутствия ПГТ-А. Возможно, дидрогестерон в Протоколе 1 способствует поддержанию меньшего процента потери беременности на этапе от биохимической к клинической беременности в циклах без ПГТ-А, что в итоге позволяет иметь сопоставимые доли положительных исходов во всех сравниваемых характеристиках течения и исхода цикла. В отношении частоты имплантации показано ее повышение в группе с ПГТА.
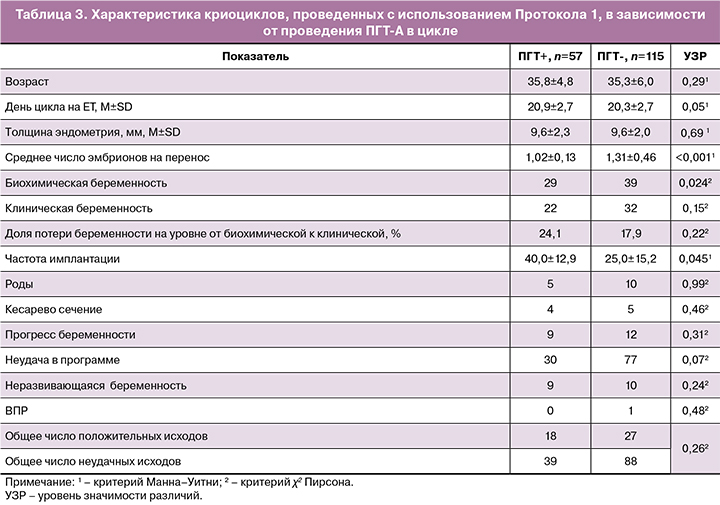
У женщин, вступивших в программу с витрифицированным эмбрионом в Протоколе 2 (с эстрогенами), процедура ПГТ-А не только достоверно уменьшала процент потери беременностей на этапе программы от биохимической беременности к клинической, но и сама частота биохимических и клинических беременностей была значимо выше в группе женщин, принявших решение о проведении ПГТ-А (табл. 4). При этом общее число позитивных и негативных исходов программы, как и частота их отдельных вариантов, не отличались значимо в обеих подгруппах женщин в этом типе протокола цикла ВРТ с витрифицированным эмбрионом.
Вышесказанное позволяет заключить, что у женщин, проходящих цикл ВРТ с переносом размороженного эмбриона и поддержкой ЛФ дидрогестероном в протоколе с эстрогенами, наличие ПГТ-А позволяет достигать лучших характеристик вынашивания и обеспечивает большую частоту имплантации.
Результаты изучения влияния ПГТ-А на течение и исходы циклов в «длинном» протоколе с агонистом ГнРГ представлены в таблице 5.
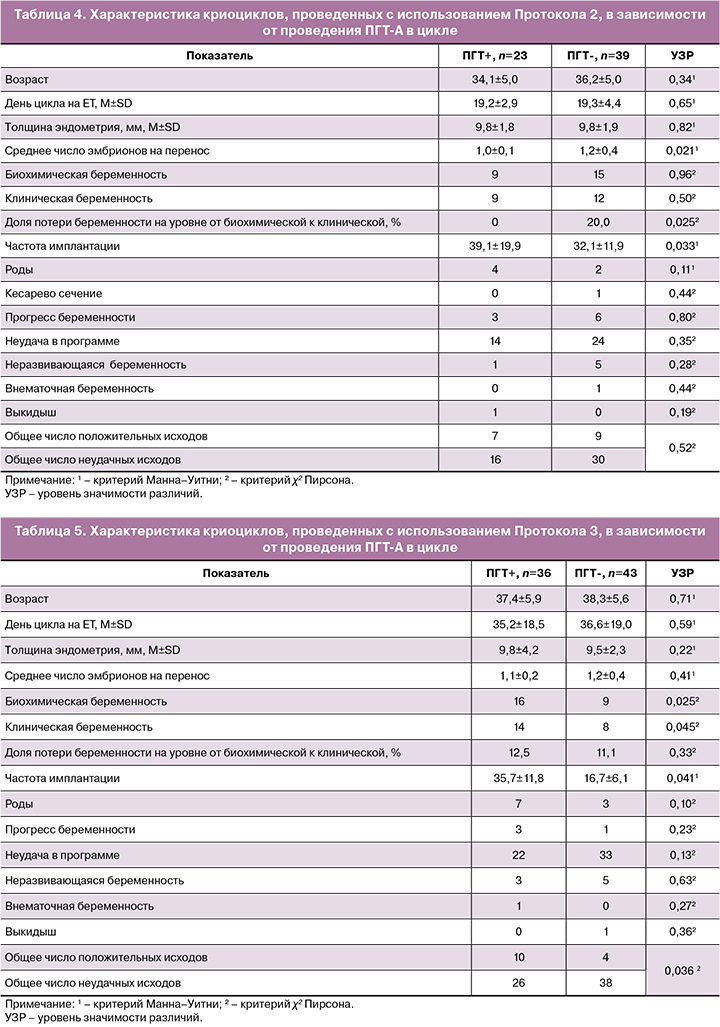
Для этой группы женщин, характеризующейся старшим репродуктивным возрастом и наличием гинекологических заболеваний, наличие ПГТ-А в цикле ЭКО с криопереносом и поддержкой ЛФ дидрогестероном оказалось ассоциировано со значимым увеличением частоты наступления биохимической, клинической беременности, повышением частоты имплантации, а также достоверно увеличивало суммарное число положительных исходов программы ВРТ (р=0,036). Таким образом, ПГТ-А у женщин в протоколе с агонистом ГнРГ создает максимально благоприятные условия для успешного завершения лечения бесплодия в циклах с криопереносом.
Обсуждение
В настоящее время ни один из существующих методов лечения и профилактики бесплодия не является достаточно эффективным. Вместе с тем растет число женщин, вступающих в программу ВРТ в позднем репродуктивном возрасте и с сопутствующими заболеваниями [9], с ожидаемым снижением потенциала эффективного лечения методом ЭКО [10]. В этой связи приобретают важное значение поиск процедур и методов, описание выбора и стратификации известных подходов для повышения эффективности преодоления бесплодия. Вопросы об эффективности циклов с витрифицированным эмбрионом уже с 90-х гг. прошлого века решались в пользу замороженного эмбриона. В когортном исследовании 398 пар было показано, что криоконсервация эмбрионов повышает результативность программы ЭКО в 1–3 циклах до 50% против использования эмбрионов в свежем цикле [11]. В настоящее время сторонники стратегии замораживания всех эмбрионов и сегментации цикла приводят убедительные доказательства возможности такого подхода повышать эффективность программы ВРТ [12]. В отношении поддержки ЛФ в цикле с переносом размороженного эмбриона нет единого мнения ученых, тогда как для циклов с переносом «свежего» эмбриона все чаще встречается мнение о дидрогестероне как о новом стандарте поддержки ввиду предпочтительного использования женщинами пероральной формы гестагена, надежного профиля безопасности и низкого риска для развития плода [13]. В настоящем исследовании все циклы были проведены с применением дидрогестерона, так как, согласно актуальным рекомендациям ESHRE по ЭКО «Стимуляция яичников при ЭКО/ИКСИ», для поддержки ЛФ может быть назначена как одна из допустимых форм биоидентичного прогестерона (то есть внутримышечный, подкожный или вагинальный), так и дидрогестерон (перорально) [6].
О ПГТ-А написано достаточно, чтобы говорить об этом методе как о факторе, при использовании по показаниям повышающем эффективность цикла ЭКО [14, 15]. Однако успех программы ЭКО определяется разными авторами по-разному. Это очень затрудняет сравнение результатов разных исследований, и по-прежнему стоит вопрос о том, какой подход будет наиболее успешным и для каких конкретных групп пациентов [16]. Изучение влияния ПГТ-А на исходы программ, особенно у пациенток в старшем репродуктивном возрасте, давно привлекает внимание специалистов. Есть мнение, что ПГТ-А можно рекомендовать в качестве метода скрининга всем пациенткам в названном возрасте, даже если используются донорские ооциты [17]. Авторы показывают, что ПГТ-А позволяет добиваться более высоких показателей частоты имплантации в сравнении с циклами без ПГТ-А: 72% против 56% в циклах суррогатного материнства; 60% против 36% в циклах с самостоятельным вынашиванием [18]. Нами получены схожие результаты: частота имплантации у пациенток старшего репродуктивного возраста с ПГТ-А значимо выше, нежели в группе без ПГТ-А: 35,7±11,8 против 16,7±6,1 (р=0,041). Кроме этого, общее число положительных исходов программы на фоне ПГТ-А было выше, чем в группе без ПГТ-А. Учитывая, что все пациентки принимали пероральный дидрогестерон для поддержки ЛФ, представляется эффективным ПГТ-А эмбрионов в цикле с переносом витрифицированного эмбриона на фоне использования дидрогестерона в таком цикле ВРТ.
Заключение
Проведение ПГТ-А достоверно увеличивает частоту имплантации эмбриона во всех трех рассматриваемых протоколах селективного криопереноса, обеспечивая при этом минимальный риск многоплодной беременности с достаточным уровнем эффективности.
Применение ПГТ-А позволяет добиваться снижения доли потери на этапе от биохимической к клинической беременности в протоколах с применением эстрогенов, без сохранения овуляции.
В случае возрастных пациенток, имеющих груз гинекологических заболеваний, ПГТ-А служит фактором, повышающим частоту положительных исходов программ ВРТ в протоколах с агонистом ГнРГ и поддержкой ЛФ дидрогестероном, нивелируя при этом ожидаемое возрастное снижение эффективности.



