Актуальность проблемы бесплодия не теряет своей значимости для супружеских пар репродуктивного возраста во всем мире, а у части из них единственной возможностью рождения ребенка становится лечение методами вспомогательных репродуктивных технологий (ВРТ). В достижении положительных результатов при использовании программ ВРТ решающую роль играет качество полученного клеточного материала. Золотым стандартом овариальной стимуляции в программах ВРТ является получение высококачественных ооцитов в адекватном количестве и с минимальными побочными эффектами лекарственных препаратов для лечения бесплодия [1].
Успех проведения программ экстракорпорального оплодотворения (ЭКО) во многом определяется качеством полученного ооцита и выбором эмбриона с высоким имплантационным потенциалом [2]; при этом перенос морфологически нормального эмбриона не всегда приводит к наступлению долгожданной беременности, а в ряде случаев она может прерваться на ранних сроках развития. Именно поэтому решение проблемы повторных неудач имплантации в программах ЭКО остается весьма актуальной задачей. Ведущей причиной неэффективности лечения бесплодия в программах ВРТ является нарушение имплантации эмбриона [3]. Основными причинами нарушений имплантации, помимо качества самого эмбриона, могут являться снижение рецептивности эндометрия или несостоятельность «диалога» между эндометрием и эмбрионом. Последовательный сложный процесс имплантации контролируется различными молекулярными факторами: сигнальными цитокинами, факторами роста, молекулами адгезии [4–7].
Клетки кумулюса – специализированные клетки, которые окружают и питают ооцит в процессе роста и развития. Они координируют созревание ооцитов внутри растущих фолликулов, стимулируют ядерное и цитоплазматическое созревание ооцита, обеспечивают энергетическими субстратами для возобновления мейотического созревания женских гамет, которое необходимо для формирования пронуклеусов после оплодотворения, и определяют дальнейшую способность к развитию [8]. Главная функция кумулюса состоит в обеспечении транспорта сигнальных молекул и метаболитов между ооцитом и тканью яичника. С другой стороны, ооцит в созревающем фолликуле секретирует факторы роста, действующие локально, управляя функцией и дифференцировкой кумулюсных клеток [9].
Кумулюсные клетки играют основную роль в двусторонней передаче сигналов к ооциту; важность данных сигнальных путей для производства жизнеспособных гамет не может быть переоценена [9]. Принимая во внимание двунаправленную передачу сигналов между ооцитом и кумулюсными клетками, можно предположить, что метаболические процессы в ооцит-кумулюсном комплексе также взаимосвязаны и оказывают существенное влияние на созревание и успешное оплодотворение ооцитов, а также на дальнейшее развитие эмбрионов.
В проведенном метаанализе Kattan N. et al. было выявлено, что аутологичное сокультивирование эмбрионов с клетками кумулюса повышает эффективность программ ВРТ у пациенток с множественными неудачными попытками ЭКО в анамнезе [10]. Также в некоторых работах было показано, что при сокультивировании эмбрионов с клетками кумулюса улучшаются качественные характеристики бластоцист и повышается частота имплантации за счет детоксикации среды культивирования и секреции эмбриотропных веществ (цитокины, факторы роста, стероидные гормоны и интерлейкины) [11, 12]. Фидерные клетки значительным образом могут обогащать культуральную среду in vitro, тем самым давая возможность эмбрионам развиваться в более обогащенной среде [13]. В 1996 г. Quinn P. et al. одними из первых провели проспективное исследование, в котором была отмечена разница в развитии эмбрионов при классическом культивировании и сокультивировании с клетками кумулюса [14]. При детальном изучении механизмов влияния кумулюсных клеток на имплантационный потенциал эмбриона в исследовании Benkhalifa M. et al. показано, что клетки кумулюса выступают экзогенным источником лейкемия-ингибирующего фактора и фактора активации рецепторов тромбоцитов [15]. Данные факторы роста влияют на развитие эмбриона, бластуляцию, а также имплантацию за счет воздействия на фосфорилирование белков, включая тирозинкиназу, что было показано на экспериментальной модели животных [16]. Помимо этого, было изучено влияние возраста женщины на качество клеток кумулюса и особенности метаболического профилирования [17]. Авторы сообщают о влиянии возрастных молекулярных изменений в клетках кумулюса, которые воздействуют на мейотическое созревание, функции и расхождение хромосом, цитоплазматическую зрелость женских гамет [17]. Необходимо отметить, что сама технология сокультивирования эмбриона с различными фидерными клетками в клинической практике является современным методом совершенствовании лечения бесплодия, который особенно эффективен у пациенток с множественными неудачными попытками ВРТ [18, 19]. В ряде работ было показано, что дифференциальная экспрессия ряда генов в клетках кумулюса коррелирует с высокой вероятностью успешного развития эмбриона и имплантации [20–23].
Перспективным методом изучения метаболизма клеток, в том числе клеток кумулюса, является культивирование клеток в питательных средах и оценка метаболома. Данный подход успешно применялся непосредственно для отработанных сред культивирования и выявил заметную разницу в биохимическом профиле отработанных сред после культивирования в них эмбрионов различного качества и результата имплантации [24], при патологиях женской репродуктивной системы [25], а также с использованием различных сред культивирования [26]. Из всего многообразия методов оценки метаболизма клеток и тканей в настоящее время одним из наиболее широко распространенных является использование хроматографического разделения метаболитов с последующей масс-спектрометрической детекцией. Эта технология обладает высокой чувствительностью и специфичностью, а также отличается достаточно простой пробоподготовкой, что упрощает ее введение в рутинную клиническую практику.
Цель работы: оценить влияние сокультивирования эмбрионов с клетками кумулюса на морфологию бластоцист и вероятность их имплантации в сравнении с классическим методом при использовании стандартной среды, а также выполнить анализ метаболитов как самих клеток кумулюса, так и питательных сред после 5-суточного культивирования клеток кумулюса.
Материалы и методы
В исследование были включены пациентки, обратившиеся в отделение вспомогательных технологий в лечении бесплодия имени проф. Б.В. Леонова ФГБУ «НМИЦ АГП имени В.И. Кулакова» Минздрава России для проведения лечения бесплодия методами ВРТ. Всего в работе участвовали 127 пар для оценки клинического эффекта технологии сокультивирования эмбрионов с клетками кумулюса и 90 женщин для изучения метаболомного профиля культуральных сред и клеток кумулюса. Все пациенты подписали информированное добровольное согласие. Настоящее исследование было поддержано на заседании Комиссии по биоэтике ФГБУ «НМИЦ АГП имени В.И. Кулакова» Минздрава России. Критериями включения были: возраст пациентки от 18 до 40 лет; регулярный менструальный цикл; сохраненный овариальный резерв (базальный уровень фолликулостимулирующего гормона (ФСГ) менее 12 мМЕ/мл, антимюллерова гормона (АМГ) – не менее 1,2 нг/мл); оплодотворение методом интрацитоплазматической инъекции сперматозоида (ИКСИ); не менее 2 неудачных попыток ЭКО в анамнезе (не менее двух программ переноса эмбрионов в полость матки, в том числе переноса размороженных эмбрионов удовлетворительного качества в полость матки). Критерии невключения: противопоказания для проведения программы ВРТ, в том числе экстрагенитальная патология и онкологические заболевания; получение менее 2 зрелых ооцитов в день трансвагинальной пункции яичников (истощение овариального резерва); подтвержденный лапароскопически и/или эхографически генитальный эндометриоз III–IV степени; интерстициальная и/или субсерозная миома матки более 4 см, субмукозная миома, деформирующая полость матки; патология эндометрия; пороки развития половых органов; выраженная патозооспермия.
Программа экстракорпорального оплодотворения и методы культивирования эмбрионов
Все пациенты, включенные в работу, прошли обязательное обследование перед циклом ВРТ согласно Приказу Минздрава России №803н от 31 июля 2020 г. «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению». Применяли как общеклинические, так и специальные методы обследования в зависимости от клинической ситуации. Стимуляцию функции яичников выполняли по стандартному протоколу с применением препаратов рекомбинантного ФСГ и антагонистов гонадотропин-рилизинг-гормона. С целью финального созревания фолликулов использовали хорионический гонадотропин человека в дозе 10 000 МЕ. Пункцию фолликулов выполняли под общей анестезией в условиях малой операционной аспирационными атравматичными иглами (VitroLife, Швеция). Полученные ооцит-кумулюсные комплексы собирали в культуральной среде с буфером HEPES (Gamete Buffer, СООК, Ирландия) с последующим помещением биологического материала в культуральную бикарбонатную среду (Irvine Sc., США). Эякулят собирали путем мастурбации с 3–4 днями полового воздержания, обрабатывали в градиенте плотностей с последующим всплытием swim up. Оплодотворение проводили методом ИКСИ. Культивирование эмбрионов проводили до 5 суток в условиях инкубатора – 5% О2, 6% СО2, 37◦С. Оценку эмбрионов выполняли согласно рекомендациям Российской ассоциации репродукции человека.
В клинической части работы у 127 женщин все полученные зиготы (2PN2PB, всего 625 зигот) были случайным образом разделены на 2 группы: группа 1 – сокультивирование эмбрионов с клетками кумулюса (n=236 зигот), группа 2 (сравнения) – стандартное культивирование (n=389 зигот). Классический метод культивирования эмбрионов проводили в индивидуальных каплях сред (Irvine CSC, USA) одинакового объема (25 мкл), покрытых маслом. Сокультивирование выполняли следующим образом. При трансвагинальной пункции фолликулов от ооцит-кумулюсного комплекса стерильным скальпелем отрезали под маслом небольшое число клеток кумулюса (2×2 мм), которые 24 ч держали отдельно от ооцитов. В день оценки зигот и выделения группы сравнения данные клетки кумулюса помещали в каплю 25 мкл под маслом, куда также помещали нормально оплодотворенную зиготу. К каждой зиготе в капле были добавлены клетки кумулюса, которые совместно культивировали до 5 суток без смены среды.
На 5-е сутки культивирования производили морфологическую оценку полученных эмбрионов в двух группах с последующим переносом лучшего (из любой группы). В зависимости от перенесенного эмбриона женщины были поделены на группы: перенос эмбриона после сокультивирования (группа 1) и после классического культивирования (группа 2). Подготовка эндометрия к переносу эмбриона осуществлялась препаратами прогестерона согласно инструкции производителя.
Культивирование клеток кумулюса и оценка метаболома методом высокоэффективной жидкостной хроматографии с тандемной масс-спектрометрией (ВЭЖХ-МС)
Для исследования метаболома отработанных сред культивирования клетки кумулюса после трансвагинальной пункции отрезали стерильным скальпелем в среде, содержащей буфер HEPES (Gamete Buffer, СООК, Ирландия), размером 3×3 мм без признаков крови и дегенеративных клеток. Промывали в среде бикарбонатного буфера (Irvine CSC, США) и помещали в капли 25 мкл под культуральное масло (Irvine CSC, США) на 5 суток без последующей смены среды. Контролем служила капля среды без клеток кумулюса. Чашки Петри помещали в СО2-инкубатор (37◦С, 6% СО2, 5% О2). На 5-е сутки отбирали равные объемы (20 мкл) отработанных сред, отдельно собирали клетки кумулюса. Все отобранные образцы были промаркированы и заморожены (-80◦С). В рамках пробоподготовки для ВЭЖХ-МС-анализа метаболиты экстрагировали добавлением к каждому образцу среды или непосредственно к пеллете клеток кумулюса трех объемов метанола для высаживания белков, после чего центрифугировали (13 000 g) в течение 15 мин. Супернатант переносили в чистые виалы. Для в ВЭЖХ-МС к 18 мкл экстракта каждого образца добавляли 2 мкл внутреннего стандарта с конечной концентрацией 5 мкМ, разделение проб проводили на колонке Atlantis T3 C18 – 3 мкм, длина 15 см, внутренний диаметр 1 мм (Waters, США) при помощи хроматографической системы Ultimate 3000 Nano LC System (Thermo Scientific, США).
Элюирование компонентов образцов проводили методом обращенно-фазной хроматографии в изократическом растворе 5% подвижной фазы «В» (0,1% раствор муравьиной кислоты в ацетонитриле) и 95% фазы «А» (0,1% раствор муравьиной кислоты в воде) в течение 15 минут, затем в градиенте 5–95% подвижной фазы «B» в течение 10 минут при скорости потока 40 мкл/мин. Затем промывали 5 мин (95% фазы «B»), после чего в течение 1 минуты возвращалась исходная концентрация фазы «B» в 5% и колонка 3 мин уравновешивалась. Общее время хроматографии одного образца составило 34 минуты. Детекция метаболитов проводилась на гибридном квадруполь-времяпролетном масс-спектрометре Bruker MaXis Impact (Bruker Daltoniks, Germany) в двух измерениях на один образец. Масс-спектры получали при разрешении 50 000 в диапазоне 50–1500 m/z, в режиме положительно заряженных ионов. Детектирование пиков, их группировка и коррекция времени удерживания проводились с помощью программного пакета xcms. Детекция пиков была выполнена с помощью алгоритма Centwave c параметрами: разброс m/z – 15 ppm; минимальная и максимальная ширина пика – 10 и 50 с соответственно. Группировка пиков по всем образцам была выполнена методом Peak Density с параметрами по умолчанию.
Для первичной идентификации метаболитов с соответствующими молекулярными массами использовали базу данных HMDB (www.hmdb.ca).
Статистический анализ
Анализ результатов проводился с помощью пакета программ LibreOffice Calc и IBM SPSS Statistics версии 23.0 (США), а также с помощью таблиц Microsoft Excel. Для анализа количественных данных в группах определялся вид распределения данных (тест Колмогорова–Смирнова и Шапиро–Уилка). При распределении, отличном от нормального, переменные были представлены в виде медианы (Ме) и межквартильных значений [Q1; Q3]. Статистический анализ проводили с помощью теста Манна–Уитни при парном сравнении. В случае нормального распределения переменных использовали среднее арифметическое (М) и стандартное отклонение (SD): М (SD). Для анализа использовали методы параметрической статистики (t-критерий Стьюдента). Для описания категориальных бинарных данных (клинико-анамнестические данные и исходы программ ВРТ (имплантация и роды)) использовали процентные доли от общего числа пациенток в группе P и абсолютные числа n в формате P% (n). Анализ номинальных данных проводили с помощью критерия Хи-квадрат (χ2) и точного критерия Фишера. Для сравнения групп по номинальным признакам в проспективном исследовании рассчитывали относительный риск (ОР) с 95% доверительным интервалом (ДИ) для сравнения вероятности исхода (имплантация, роды) в зависимости от наличия фактора (сокультивирование с аутологичными клетками кумулюса). Величину порогового уровня значимости p принимали равной 0,05.
При анализе метаболома культуральных сред для поиска и визуализации наибольших различий между образцами использовали метод многомерной статистики – дискриминантный анализ ортогональных частичных наименьших квадратов (OPLS-DA). Для проверки статистической значимости различия относительных концентраций (средних интегрированных площадей пика) между группами для конкретных метаболитов использовался t-критерий Стьюдента. Cтатистически значимыми считались те изменения, для которых значение p с учетом коррекции на множественную проверку гипотез (FDR) было меньше 0,05. Дополнительным критерием отбора для потенциальных биомаркеров являлась кратность изменений концентрации не менее чем в 2 раза между группами. Для оценки статистической значимости найденных метаболических путей применялся точный тест Фишера. Кратность изменений, а также одномерная и многомерная статистика рассчитывались с помощью платформы Metaboanalyst v5.0.
Критерии эффективности использования сокультивирования зигот с аутологичными клетками кумулюса – повышение частоты бластуляции. Первичные исходы совпадают с критерием эффективности – улучшение показателей эмбриологического этапа. Вторичные исходы – повышение эффективности программ ВРТ (частота наступления клинической беременности (имплантация) и частота живорождения).
Результаты
В работе были оценены клинико-анамнестические данные включенных в исследование пациенток. Статистический анализ клинических характеристик и эмбриологического этапа исследуемых групп представлен в таблице 1, а характеристики овариального резерва и менструальной функции женщин — в таблице 2. Согласно результатам теста Колмогорова–Смирнова, распределение значений количественных характеристик значимо отличается от нормального (р<0,05), за исключением показателя ФСГ (распределение нормальное, данные представлены в виде М (SD)).
Средняя суммарная доза гонадотропинов составила 1575 МЕ [1262; 2025], число дней овариальной стимуляции – 9 [8; 10]. Показатели оогенеза и сперматогенеза, а также эмбриологические характеристики анализируемых циклов ВРТ показаны в таблице 3. Как видно из представленных результатов, супружеские пары обладали клиническими характеристиками, предполагающими достаточно позитивный исход лечения бесплодия. Однако у всех было не менее 2 неудачных протокола в анамнезе. Всем пациенткам в полость матки был перенесен строго 1 эмбрион. Из 127 женщин перенос эмбриона был выполнен в 105 случаях, у 22 женщин – отмена переноса эмбриона из-за неудовлетворительного качества бластоцист или патологии эндометрия, выявленной в день переноса эмбриона при ультразвуковом исследовании; эмбрионы в таком случае были криоконсервированы.
На 5-е сутки культивирования были оценены эмбрионы на стадии бластоцисты в обеих группах (табл. 4). Всего было получено 236 бластоцист в группе сокультивирования и 389 в группе сравнения. При сравнении долей эмбрионов разного качества (отличного, хорошего, удовлетворительного и плохого) в зависимости от условий культивирования были получены статистически значимые различия (р=0,01). Выявленные различия были обусловлены более высоким процентом эмбрионов отличного качества – 36,9% (87/236) против 24,9% (97/389) (р=0,002) и более низким процентом эмбрионов неудовлетворительного качества – 43,2% (102/236) против 50,6% (197/389) при сокультивировании (р=0,07) с клетками кумулюса, по сравнению с классическими условиями культивирования.
Как показали результаты сравнения, сокультивирование эмбрионов с аутологичными клетками кумулюса значимо улучшало качество получаемых на 5-е сутки бластоцист, что предоставляло возможность как проводить селективный перенос одного эмбриона в полость матки, так и увеличить количество замороженных эмбрионов для последующих криопереносов. Всего было выполнено 47 переносов эмбрионов после классического культивирования и 58 переносов из группы сокультивирования с клетками кумулюса. Клинические результаты показаны в таблице 5.
Как показывают клинические данные, процедура сокультивирования эмбрионов с аутологичными клетками кумулюса не показала своей эффективности на общей когорте пациенток. Именно поэтому на следующем этапе женщины были стратифицированы по возрасту. Были выделены следующие подгруппы: ≤35 лет и 36+ лет. Клинические результаты показаны в таблице 6.
Как видно из представленных данных, присутствует только тенденция к снижению частоты наступления беременности у пациенток позднего репродуктивного возраста при сокультивировании эмбрионов с аутологичными клетками кумулюса. Требуются дополнительные данные для доказательства негативного эффекта сокультивирования у женщин старше 36 лет.
Исследование метаболома отработанных культуральных сред и клеток кумулюса
Для исследования особенностей метаболизма клеток кумулюса и их возможного влияния на развитие эмбриона и его способности к имплантации мы исследовали метаболом как самих клеток кумулюса, так и питательных сред, где он культивировался в течение 5 дней. Всего было исследовано 190 образцов, их них 90 – отработанные культуральные среды от клеток кумулюса, 90 – непосредственно клетки кумулюса и 10 контрольных образцов среды. После детекции пиков было обнаружено 1722 молекулярных иона в диапазоне m/z от 84 до 1007. Для выявления кластеризации образцов использовался метод многомерной статистики (OPLS-DA), который выявил четкую кластеризацию образцов при сравнении отработанных культуральных сред от клеток кумулюса и контрольных сред (рисунок).
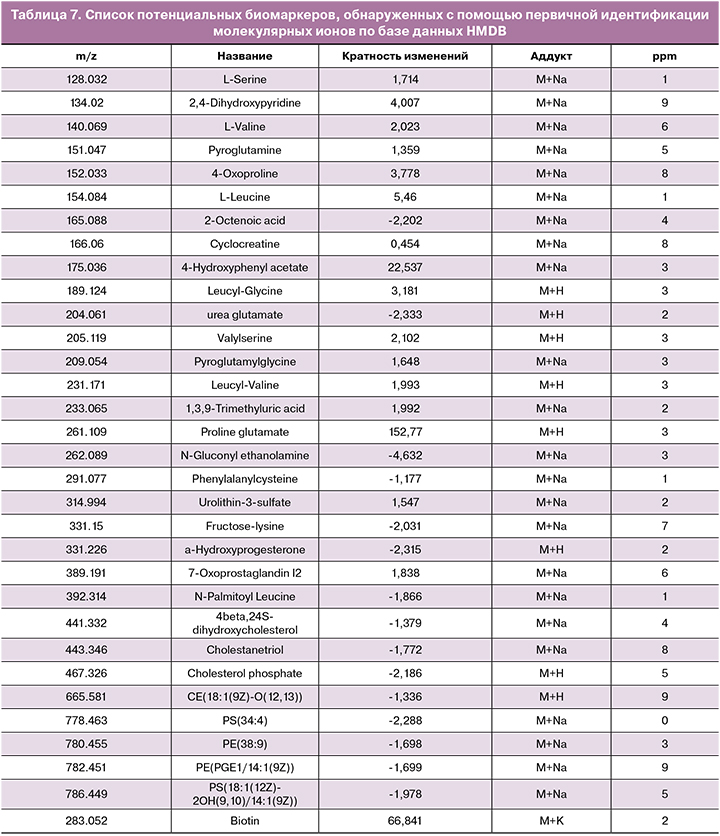
Одномерная непараметрическая статистика закономерно выявила 113 молекулярных ионов, у которых значимо меняется концентрация масс (FDR p<0,05). Согласно результатам анализа кратности и направленности изменений, концентрация 65 молекулярных ионов из 113 изменилась в 2 или более раз между группами сред, содержавших клетки кумулюса, и контрольными. Для этих ионов была произведена первичная идентификация с помощью базы данных HMDB. Результаты идентификации, представляющие собой список потенциальных биомаркеров, показаны в таблице 7. Можно видеть, что обнаруживается целый ряд аминокислот (таких как лейцин, валин, серин) и дипептидов на их основе, концентрация которых в среде с кумулюсными клетками повышена в несколько раз. В то же время для большинства липидов и их производных, обнаруженных в среде, было зафиксировано снижение концентрации (табл. 8).
Списки молекулярных ионов были использованы для анализа представленности метаболических путей, которые определяют различия между группами. Список наиболее важных метаболических путей представлен в таблице 8.
Обращает на себя внимание высокая представленность метаболизма пуринов, что может указывать на важность этого пути для функции клеток кумулюса. На это также указывает и путь метаболизма кофеина – данный путь, помимо кофеина, включает целый ряд других производных пурина. Кроме того, можно видеть большое количество путей, определяющих метаболизм аминокислот и сахаров, что согласуется с физиологическими функциями кумулюсных клеток. Для клеток кумулюса был также проведен анализ представленности метаболических путей на основе пиков молекулярных ионов и их времен удерживания, детектированных в исследованных образцах. Результаты представлены в таблице 9.
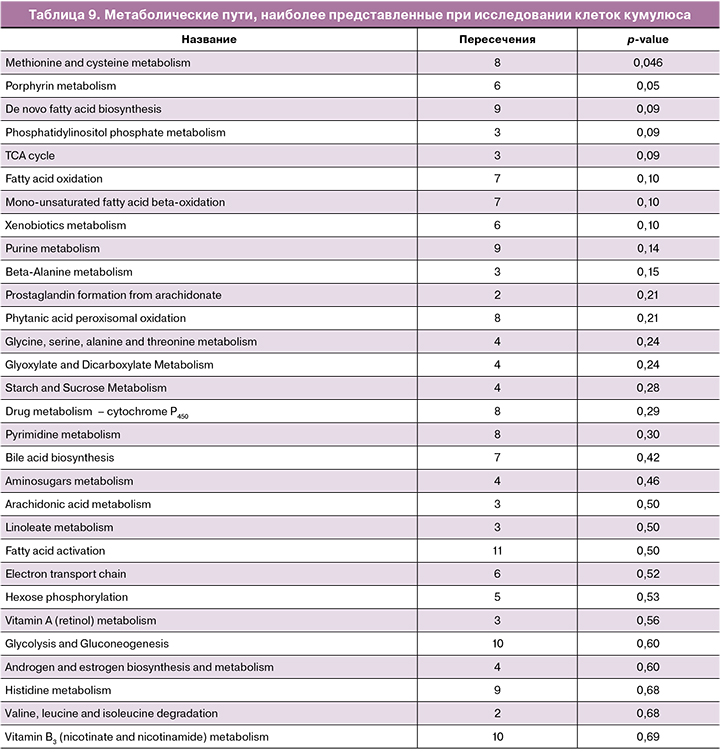
Можно отметить, что большинство путей отличается от обнаруженных для сред культивирования; есть и общие, и взаимосвязанные метаболические пути, такие как метаболизм пуринов, фосфатидилинозитолфосфата и валина, лейцина/изолейцина. Также можно заметить возросшее количество метаболических путей регуляции липидов и их производных и снижение роли метаболизма сахаров.
Обсуждение
Метод аутологичного сокультивирования эмбрионов с клетками кумулюса используется как один из методов терапии повторных неудач имплантации, поскольку ранее в ряде работ была показана разница в скорости роста и развития эмбрионов, а также морфологии эмбрионов между группами классического культивирования и сокультивирования с клетками кумулюса [17, 27]. В то же время в литературе встречаются противоречивые данные о результатах влияния сокультивирования эмбрионов с клетками кумулюса на вероятность имплантации и наступления беременности [28, 29]. Некоторые авторы указывают на повышение частоты имплантации и наступления беременности при переносе эмбрионов на 3-и сутки культивирования [30, 31], другие – демонстрируют отсутствие статистически достоверных различий между частотой имплантации и наступлением клинической беременности в группах с классическим культивированием и сокультивированием с клетками кумулюса при переносе как на 3-й день, так и на 5–6-й день культивирования [32].
Проведенное нами исследование не выявило статистически достоверной разницы между частотой наступления беременности и вероятностью успешных родов при сравнении группы с сокультивированием и группы с классическим культивированием без клеток кумулюса. Однако при более подробном анализе групп и разделении женщин по возрасту было выявлено повышение частоты наступления беременности при классическом культивировании у женщин старше 36 лет. При этом в общей когорте при сокультивировании значительно чаще регистрировались бластоцисты отличного качества – 40,2% против 26,9% всех эмбрионов, а число бластоцист среднего и плохого качества снижалось (10,5 и 38% против 14,2 и 47,8% соответственно). Результаты нашего исследования подтверждают литературные данные о том, что сокультивирование с клетками кумулюса улучшает созревание эмбрионов, позволяя получать больше эмбрионов высокого качества. Как один из механизмов благотворного влияния сокультивирования с клетками кумулюса на развитие ооцитов и эмбрионов ранее были показаны специфические изменения профиля экспрессии генов в ооцитах при сокультивировании с клетками кумулюса, что повышает качество ооцита. Virant-Klun I. et al. в своей работе при сравнении групп ооцитов, культивировавшихся in vitro классическим методом и in vitro с применением сокультивирования, обнаружили, что профиль экспрессии генов ооцитов при сокультивировании наиболее схож с таковым при естественном созревании ооцита in vivo. Кроме того, эти две группы образцов имели наибольшее пересечение экспрессированных генов [32]. В то же время для культивирования классическим способом были характерны более значительные колебания экспрессии генов относительно естественного созревания. Наибольшую разницу демонстрировали белки, связанные с регуляцией транскрипции, эмбриогенезом и эпигенетикой, а также c клеточным циклом. Однако в литературе встречаются единичные работы по изучению сокультивирования ооцитов и эмбрионов с клетками кумулюса, в основном проведенные на животных. Практически отсутствуют исследования особенностей метаболизма ооцитов и эмбрионов при сокультивировании. Это связано, в том числе, с этическими сложностями проведения подобных исследований с ооцитами и эмбрионами человека. Одним из способов обойти данные ограничения является исследование сред культивирования эмбрионов. Уровни потребления метаболитов из среды и выделения продуктов жизнедеятельности в среду эмбрионами напрямую коррелируют с их метаболической активностью; таким образом, профилируя среды культивирования, можно получить представление об активных метаболических процессах в эмбрионах. В литературе представлено большое количество работ по изучению питательных сред – в частности, измеряются концентрации различных белков [33], аминокислот [34], глюкозы, хорионического гонадотропина [35] и других метаболитов. Для подобных исследований наиболее подходящими являются методы, которые позволяют одновременно анализировать большое количество компонентов среды. Ранее метаболом сред культивирования и его влияние на качество эмбрионов, а также их способность к имплантации были изучены с помощью методов инфракрасной спектрометрии и Рамановской спектроскопии [36, 37], ядерно-магнитного резонанса [38], а также масс-спектрометрии в сочетании с хроматографией для разделения сложных биологических смесей. Так, ранее с помощью масс-спектрометрии были показаны особенности метаболома эмбрионов человека в зависимости от качества, кариотипа, состава сред культивирования и влияния внешних факторов.
В данной работе были проанализированы метаболомные профили культуральных питательных сред после культивирования в них клеток кумулюса в течение 5 дней, а также непосредственно самих клеток кумулюса. В качестве контроля была проанализирована 5-дневная культуральная среда. Одномерный и многомерный статистический анализ при сравнении с контрольными средами обнаружил целый ряд метаболитов, достоверно изменяющих свою концентрацию. Эти метаболиты могут быть непосредственно связаны с метаболической активностью клеток кумулюса и включают в себя аминокислоты и их производные, липиды различных классов, дипептиды и витамины. Обращает на себя внимание повышение производных фенилаланина (4-гидроксифенилацетата) в среде, что может свидетельствовать об активном метаболизме фенилаланина клетками кумулюса и эмбрионом [24]. Кроме того, значительно повышена концентрация дипептида пролин-глутамата. В опытах, проведенных на мышах, Morris M. et al. показали, что пролин и глутамат в среде оказывают благотворное влияние на предимплантационное развитие и рост эмбриона [39]. Идентифицированные метаболиты затем использовались для выявления наиболее активных метаболических путей. Метаболизм глюкозы и других гексоз является критически необходимым для активного развития эмбриона, в то время как глутатион действует как антиоксидант, защищая от активных форм кислорода [40]. Поскольку раннее развитие эмбриона сопряжено со значимым увеличением количества нуклеиновых кислот, крайне важным для его развития является и метаболизм пуринов/пиримидинов [41].
Помимо сред культивирования, нами были экстрагированы метаболиты непосредственно из клеток кумулюса для последующего профилирования. В данном случае наибольший интерес представляли изучение активных метаболических путей в клетках кумулюса и их сравнение с путями, ранее выявленными в средах культивирования. В литературе имеются данные о том, что клетки кумулюса играют важную роль в доставке различных аминокислот в ооцит, исключая алифатические аминокислоты с разветвленной боковой цепью – валин, лейцин и изолейцин, которые, вероятно, регулируются иным способом. Это может обуславливать факт обогащения большого количества путей метаболизма аминокислот. При этом одними из важнейших являются серосодержащие аминокислоты, такие как метионин и цистеин, поскольку они необходимы для корректного импринтинга (передачи статуса метилирования), биосинтеза белка, а их недостаток приводит к синдрому депривации серосодержащих аминокислот и запуску каспазонезависимого пути клеточной гибели [42]. Большое количество активных путей метаболизма липидов закономерно ввиду активной роли последних не только в качестве источника энергии, но и как регуляторов различных клеточных процессов [43].
Клетки кумулюса активно участвуют в метаболизме липидов, инициируя, среди прочего, механизм бета-окисления жирных кислот, необходимый для нормального развития ооцита и эмбриона, а ингибирование приводит к серьезным нарушениям нормального развития [44, 45].
Заключение
Таким образом, наше исследование показало, что аутологичное сокультивирование эмбрионов с клетками кумулюса само по себе не приводит к увеличению доли успешных имплантаций и родов, однако значительно повышает число эмбрионов отличного качества. Профилирование выявило в клетках кумулюса компоненты метаболических путей, имеющих критическую важность для физиологического роста и развития эмбрионов. Использование сокультивирования в протоколах ВРТ может повышать вероятность успешного созревания бластоцист и повысить их качество, которое является определяющим при выборе эмбриона для переноса. Особенно актуальным сокультивирование представляется в случае малого количества или плохого качества исходных ооцитов. Данный метод в комбинации с другими неинвазивными методами оценки качества эмбриона, такими как измерение потребления глюкозы эмбрионами, может быть использован для двойной оценки качества эмбриона или как дополнительный критерий выбора эмбриона для переноса в полость матки по морфологическим и биохимическим параметрам. В условиях повсеместного отказа от переноса нескольких эмбрионов такой отбор может повысить вероятность успеха программ ВРТ и привести к рождению большего числа детей.



