Известно, что преждевременные роды являются важнейшей акушерской проблемой, так как
сопровождаются высокой перинатальной и материнской заболеваемостью и смертностью [13,
14]. Частота преждевременных родов в России в последние годы составляет около 7%. Наиболее
неблагоприятные исходы, по данным литературы, наблюдаются при досрочном прерывании
беременности в связи с тяжелыми гестационными осложнениями, когда медицинские показания со стороны матери или плода диктуют необходимость родоразрешения до 33 нед [5, 16]. Глубоко недоношенные новорожденные имеют наиболее низкие шансы на выживание и нормальное развитие. Вместе с тем уже в ближайшем будущем в России статистика преждевременных родов, а также перинатальной заболеваемости и смертности будет осуществляться по рекомендациям ВОЗ с 22 нед беременности и массе плода более 500 г.
Учитывая достаточно высокий риск повторения при последующих беременностях тяжелых
осложнений, особенно с ранней клинической манифестацией (тяжелого гестоза – 21–50%,
задержки роста плода – 22–30%, преждевременных родов – в 4 раза [11, 12]), актуальной является проблема изучения материнских факторов, определяющих риск повторных осложнений [2].
На сегодняшний день установлено, что к развитию тяжелых осложнений беременности предрасполагают фоновые соматические заболевания матери, формирующие системную эндотелиальную дисфункцию [5, 10, 19]. Тем не менее вопрос о том, какое влияние оказывают системные нарушения микроциркуляции, вызванные соматическими заболеваниями, на состояние маточного кровообращения, остается до конца невыясненным и заслуживает дальнейшего изучения. Кроме того, существуют субклинические состояния, негативное влияние которых также реализуется через нарушение структуры и функции стенок сосудов. По мнению А.П. Милованова
(2004), одним из существенных механизмов в развитии гипоксической, циркуляторной, тканевой гипоксии в плаценте является патология спиральных артерий матки [7].
В связи с вышесказанным, целью данного исследования являлось выявление особенностей маточного кровообращения у пациенток с преждевременными родами в анамнезе и их взаимосвязи с сопутствующими факторами, способствующими развитию эндотелиальной дисфункции.
Материал и методы исследования
В исследуемую группу были включены 204 пациентки с преждевременными родами в анамнезе, планирующими следующую беременность. Помимо преждевременных родов 128 из них имели осложненное течение последней беременности, включая задержку роста плода – 62, гестоз – 68,
преждевременную отслойку плаценты – 6, антенатальную гибель плода – 56. В зависимости
от срока беременности, в котором произошли преждевременные роды, все пациентки были разделены на 3 подгруппы: I подгруппу составили 22 пациентки с прерыванием беременности в 22–27 нед, во II подгруппу были объединены 58 пациенток с ранними преждевременными родами в 28–33 нед беременности, в III подгруппу вошли 124 пациентки, родившие в 34–37 нед беременности. Контрольную группу составили 60 пациенток с физиологическим течением и исходом последней беременности, у 12 из них было 2 и более родов, 7 родили крупных плодов.
Из исследования были исключены пациентки с пороками развития и хромосомной патологией
плода в анамнезе, пациентки с гинекологическими заболеваниями, влияющими на внутриматочную гемодинамику: миомой матки, выраженным аденомиозом, хроническими воспалительными процессами матки и придатков.
Возраст пациенток исследуемой группы варьировался от 23 до 42 лет, составив в среднем
30,4 года, без достоверных различий между подгруппами. Нарушения менструальной функции
отмечались у 23% пациенток I подгруппы, у 21% пациенток II подгруппы и у 15% III подгруппы.
Соматический анамнез был отягощен у 90,1% пациенток I подгруппы, 81% пациенток II подгруппы, 57,3% III подгруппы, у 34% контрольной группы (табл. 1).
Таблица 1. Сопутствующие заболевания у пациенток с преждевременными родами в анамнезе.
Всем пациенткам исследуемой группы было проведено клинико-лабораторное обследование, включающее оценку гормонального статуса, развернутой гемостазиограммы, определение суммарного количества и спектра антифосфолипидных антител, антител к кофакторам фосфолипидов (аннексину, протромбину, β2-гликопротеину), волчаночного антикоагулянта, антител к хорионическому гонадотропину человека, антител к тканям щитовидной железы, вирусологическое и бактериологическое исследование и выявление наследственных дефектов гемостаза.
Исследование кровотока в маточных артериях (МА) и их мелких ветвях осуществлялось в середине секреторной фазы менструального цикла (на 7–8-й день после овуляции) при трансвагинальном сканировании с помощью аппарата Siemens Antares. Определяли допплерометрические характеристики кровотока: максимальную систолическую скорость (Vps) и уголнезависимые показатели – систоло-диастолическое отношение (S/D), пульсационный индекс (PI) и индекс резистентности (RI) в главных МА, радиальных (РА), базальных (БА), спиральных (СА) артериях. При изучении профиля кривых скоростей кровотока (КСК) в главных МА учитывалась ранняя диастолическая выемка, характеризующаяся резким падением скорости кровотока в начале диастолы до уровня конечно-диастолической или ниже. Проводилась качественная оценка интенсивности и равномерности внутриматочной перфузии миометрия и эндометрия. Результаты допплерографического исследования состояния кровотока в МА у пациенток с преждевременными родами в анамнезе сравнивали с нормативными показателями, определенными нами при проведении предыдущего исследования [8].
Выявленные НМК как в главных МА, так и их мелких ветвях оценивались по степени тяжести
[8]. Численные значения PI в МА в диапазоне 2,4–2,8 были определены как легкие нарушения
гемодинамики, 2,9–3,3 – как умеренные и более 3,3 – как выраженные. При легкой степени
нарушений кровотока имела место равномерная и интенсивная перфузия миометрия, единичные
БА в эндометрии; при средней степени – неравномерная гиповаскуляризация внутреннего слоя
миометрия, БА в эндометрии единичные или отсутствовали; при тяжелой – обширные аваскулярные зоны в миометрии, БА в эндометрии отсутствовали.
Результаты исследования и их обсуждение
В результате проведенного допплерографического исследования гемодинамики в МА у 81 (39,7%) пациентки с преждевременными родами в анамнезе были выявлены НМК. В контрольной группе частота НМК составила 8,3% (5 из 60). Детальный анализ данных акушерского и соматического анамнезов позволил выделить факторы, имеющие умеренную и сильную корреляционную связь с НМК. При изучении частоты НМК в связи с продолжительностью предыдущей беременности между исследуемыми подгруппами были выявлены достоверные различия (р<0,01). Максимальная частота нарушений маточной гемодинамики (68,2%) имела место в I подгруппе, минимальная (27,4%, т.е. в 2,5 раза ниже) – в III подгруппе. Во II подгруппе частота нарушений гемодинамики составила 55,2%, в контрольной группе пациенток, родивших в 38–40 нед – 8,3%. Таким образом, нарушения кровотока в матке наблюдались у большинства пациенток с ранним прерыванием беременности в анамнезе и только у четверти пациенток,
родивших в 34–37 нед.
Также было отмечено, что не только частота встречаемости НМК, но и степень их выраженности зависела от анамнеза пациентки. Тяжелые НМК наблюдались, преимущественно в I и значительно реже – во II подгруппе. В III подгруппе преобладала легкая недостаточность внутриматочной перфузии при физиологических характеристиках гемодинамики в основных стволах МА.
При более углубленном анализе у пациенток исследуемой группы была выявлена корреляционная связь НМК не только с продолжительностью, но и с характером течения предшествующей беременности (p<0,05) (табл. 2), а также сроками манифестации гестационных осложнений
(p<0,01).
При исследовании частоты выявления НМК в зависимости от сроков манифестации акушерских осложнений мы получили следующие результаты. У пациенток с осложнениями беременности, диагностированными в 22–25 нед нарушения гемодинамики в маточных сосудах наблюдались в 92% наблюдений, в 26–29 нед – в 83%, в 30–33 нед – в 58%, в 34–37 нед – в 37% наблюдений. В контрольной группе НМК имели место у 8,3% женщин.
Таким образом, наибольшая частота НМК в каждой из подгрупп была отмечена при сочетанных осложнениях беременности в анамнезе, наименьшая – при отсутствии гестационных осложнений. При этом, чем тяжелее были осложнения, раньше сроки их манифестации и короче продолжительность беременности, тем чаще наблюдались НМК перед планируемой беременностью.
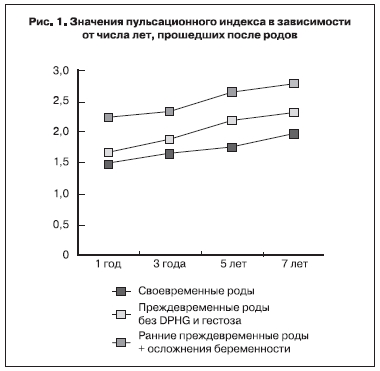
Как показали наши исследования, активность внутриматочного кровообращения снижается с каждым годом, прошедшим после родов, особенно быстро у пациенток с тяжелыми сочетанными гестационными осложнениями. Поэтому у пациенток с осложненным течением беременности и ранними преждевременными родами в анамнезе оптимальное для каждого конкретного наблюдения состояние гемодинамики в сосудах матки сохранялось в течение 2–3 лет после родов.
Важно отметить, что в первые годы после родов (в период наиболее активного кровообращения
в сосудах небеременной матки) ранняя диастолическая выемка на КСК в МА имела место
толькоупациентокспреждевременнымиродами в анамнезе и практически не встречалась у женщин, своевременно родивших здоровых детей. Резкое падение скорости кровотока в МА в начале диастолы отражает более высокий уровень сопротивления периферической сосудистой сети матки у преждевременно родивших пациенток по сравнению с контрольной группой. Это свидетельствует о недостаточности и незавершенности процесса гестационной трансформации
сосудистой системы матки при досрочном окончании беременности.
После своевременных родов, как видно на рис. 1, снижение активности кровотока происходит значительно медленнее. Самые низкие показатели резистентности и самая высокая скорость кровотока были характерны для многорожавших пациенток и пациенток, родивших
крупные плоды.
В последние годы в ряде публикаций фоновые соматические заболевания, сопутствующие гестационным осложнениям, рассматриваются с позиции их влияния на формирование системной ангиопатии и нарушений микроциркуляции [3, 4, 6, 9, 18]. В связи с этим нами было предпринято исследование корреляционной связи между частотой НМК и видом соматической патологии (табл. 3).
Таблица 2. Частота НМК при наличии дополнительных осложнений.
Таблица 3. Частота НМК и соматическая патология у пациенток.
Полученные результаты подтвердили наличие связи между заболеваниями, связанными с эндотелиальной дисфункцией, и частотой выявления НМК в период обследования. Так, максимальная
частота НМК во всех исследуемых подгруппах была характерна для приобретенных тромбофилий. Реже НМК наблюдались при эндокринных и аутоиммунных заболеваниях без антифосфолипидного синдрома (АФС). Также обращает на себя внимание высокая частота НМК (до 80% в I подгруппе) при гипертонической болезни. При этом важно отметить, что у всех пациенток I подгруппы гипертонической болезни сопутствовали тромбофилические, аутоиммунные и/или эндокринные заболевания, усугубляющие дефицит внутриматочной перфузии. Расположив соматические заболевания в порядке убывания силы корреляционной связи между ними и НМК, мы получили следующую последовательность: вторичный АФС, гипертоническая болезнь, гиперпролактинемия, синдром поликистозных яичников, гипотиреоз, первичный АФС, наследственные тромбофилии, аутоиммунный тиреоидит без АФС, варикозная болезнь вен нижних конечностей. Вместе с тем очевидны существенные различия распространенности НМК при одном и том же виде заболевания, но
различной продолжительности предшествующей беременности.
Заслуживают внимания данные, полученные при изучении взаимосвязи частоты НМК и функционального состояния свертывающей системы крови. Оценка гемостазиологических параметров выявила отклонения от нормы (состояние структурной или хронометрической гиперкоагуляции) у 18,0% пациенток исследуемой группы. У 14% пациенток исследуемой группы изменения показателей гемостаза сочетались с НМК (рис. 2).
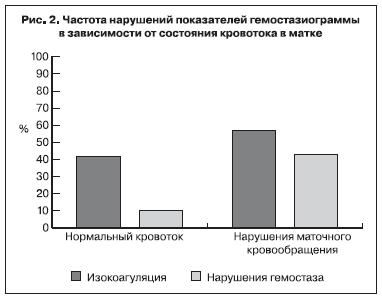
Как видно на рис. 2, при НМК изменения показателей гемостазиограммы встречались в 4 раза чаще, чем при нормальном состоянии кровотока. Частота выявления сочетанных НМК и свертывающего потенциала крови в I подгруппе была в 7,7 раза выше, чем в III. При этом 2/3 тяжелых НМК сопровождались состоянием структурной и/или хронометрической гиперкоагуляции. Процент пациенток с изменениями параметров гемостаза при тяжелых НМК был в 1,8 раза выше, чем при легких (70,0 против 38,0%). Данные литературы свидетельствуют о патологическом влиянии нарушений фибринолитического контроля на процесс инвазии трофобласта в ранние сроки беременности, что в свою очередь предопределяет развитие гестоза и задержки роста плода во II–III триместрах беременности [1, 15, 20]. В нашем исследовании сочетанием НМК и коагуляционного потенциала крови характеризовались наблюдения с наиболее неблагоприятными перинатальными исходами.
Таким образом, результаты проведенного исследования у пациенток с преждевременными
родами в анамнезе свидетельствуют о наличии корреляционной связи между состоянием кровообращения в матке, сроками манифестации и характером гестационных осложнений, сопровождавших течение предшествующей беременности; сроками родоразрешения; состоянием свертывающей системы крови; заболеваниями, способствующими формированию эндотелиальной дисфункции; числом лет, прошедших после родов. Факторы, связанные с нарушениями кровотока в матке, мы расположили в порядке убывания силы корреляционной связи.
Наибольшей частотой и тяжестью НМК сопровождались наблюдения с ранней клинической манифестацией и быстрым прогрессированием гестационных осложнений в предыдущую беременность (задержка роста плода, фетоплацентарная недостаточность, гестоз), неэффективностью традиционной терапии, и, вследствие этого, досрочным родоразрешением в интересах матери или плода. У этих же пациенток были выявлены соматические заболевания, сопровождающиеся эндотелиальной дисфункцией. По-видимому, первичное поражение эндотелия сосудов матки и снижение его антитромботического потенциала на фоне имеющихся соматических заболеваний [10, 17] предопределяет неспособность сосудистой системы матки адаптироваться к непрерывно возрастающим потребностям плода, т.е. имеется «материнский путь» формирования гестационных осложнений с ранним началом и тяжелым течением. Структурные и функциональные изменения стенок маточных артерий, сформированные до наступления беременности, способствуют развитию гестационных осложнений, усугубляются по мере прогрессирования этих осложнений и сохраняются по окончании беременности. Формирование микротромбов в мелких сосудах матки на фоне снижения тромборезистентности эндотелия и дисбаланса в системе коагуляционного гемостаза вызывает блокаду микроциркуляции на отдельных участках, гипоксию в зоне блокады, дисфункцию ишемизированных тканей и дистрофические нарушения [16, 20]. В отсутствии антикоагулянтной терапии в раннем послеродовом периоде нарушения кровообращения сохраняются. НМК в отдаленном постгравидарном периоде у пациенток с отягощенным акушерским анамнезом указывают на возможность повторения гестационных осложнений при последующих беременностях. Поэтому перед планированием следующей беременности у таких пациенток необходима реабилитация сосудистой системы матки.



