В условиях современного мирового развития, карьерных приоритетов имеет место тенденция к планированию беременности женщиной в более позднем репродуктивном возрасте. В связи с этим вопрос вынашивания беременности актуален и требует более углубленной предгестационной подготовки, что, безусловно, повышает вероятность успешного исхода беременности.
Согласно статистическим данным около 20% всех клинически подтвержденных беременностей прерываются до 20 недель гестации, при этом причины не всегда удается верифицировать [1]. Спорадические ранние выкидыши составляют большую часть самопроизвольных прерываний беременностей, при этом около 50,0% из них ассоциировано с анеуплоидиями. Вместе с тем, после 12 недель гестации лишь 2,0% потерь беременностей связаны с хромосомной патологией [2].
В случаях с поздними гестационными потерями, включая ранние преждевременные роды и антенатальную гибель плодов, ключевую роль играют нарушения в системе гемостаза (прежде всего мутации фактора V Лейден (FV), гена протромбина), воспалительные процессы, анатомические проблемы органов репродуктивной системы, истмико-цервикальная недостаточность.
Также изучается роль недостаточного ремоделирования спиральных артерий и нарушений инвазии трофобласта в течение I и II волн миграции в возникновении осложнений беременности, включая ранние и поздние потери [3]. Было показано, что интерлейкин (IL)-8 способен как сам стимулировать инвазию трофобласта, так и индуцировать стимуляцию этого процесса натуральными киллерными клетками [4].
Влияние на данный процесс других цитокинов также изучается. Так, роль IL-6 в процессе инфазии трофобласта до конца не ясна, так как получены противоречивые данные [5, 6].
IL-8 – один из основных провоспалительных цитокинов, синтезируемый макрофагами, эпителиальными и эндотелиальными клетками, а также клетками, содержащими Toll-like рецепторы. Повышение уровней IL-8 приводит к миграции вышеуказанных клеток в очаг поражения, где происходит стимуляция фагоцитоза. Также IL-8 известен как промотор ангиогенеза. В клетках мишенях IL-8 вызывает реакции, необходимые для фагоцитоза, такие как увеличение концентрации внутриклеточного Са2+, экзоцитоза и респираторного взрыва.
Секреция IL-8 усиливается на фоне оксидативного стресса, в результате чего клетками, привлекаемыми в очаг воспаления, синтезируются новые провоспалительные медиаторы, что делает его одним из ключевых цитокинов локализованного воспаления [7].
Прогностическая роль IL-8 была изучена при ряде онкологических заболеваний. Пациенты с высокой экспрессией IL-8 имели более неблагоприятный прогноз [8–11]. В исследованиях, посвященных акушерству, выяснено, что в 12–14 недель беременности уровни IL-6 и IL-8 в децидуальной оболочке повышаются по сравнению с уровнями в 8–10 недель [12].
В отечественной литературе есть данные о повышении уровней провоспалительных цитокинов (IL-6, IL-8, интерферон (IFN)-α, IFN-γ) на фоне снижения уровней цитокинов с противовоспалительным действием (IL-4, IL-10) у беременных с угрозой прерывания беременности в 1-м триместре [13].
В другом исследовании авторы показали 16-кратное увеличение уровня IL-8, 12-кратное увеличение IL-2 и двукратное увеличение IL-1RA в крови беременных с угрозой преждевременных родов в сроках беременности 22–28 недель. Авторы указывают на возможное прогностическое значение уровня IL-8 в исходах беременностей. Также выявлено, что на 1–3-е сутки послеродового периода у женщин с очень ранними преждевременными родами уровни IL-8 и IL-2 в сыворотке крови выросли в 25 раз, IL-6 -в 4 раза, IL-1RА-в 2 раза. Незначительно изменились IL-1β, IL-4. Значительно выросли показатели IFN-α (в 6 раз), IFN-γ (в 2,5 раза) [14].
В доступных источниках литературы мы нашли единичные исследования, посвященные изучению полиморфизма гена IL-8 при беременности. Украинские ученые выявили риск невынашивания беременности у носительниц аллеля Т IL-8 в положении -781 [15]. Также показано, что у матерей новорожденных с реализацией внутриутробной инфекции чаще выявлялось носительство аллеля Т IL-8 в промоторном участке, в положении 251 [16].
В этой связи, целью данного исследования стала оценка роли полиморфизма гена IL-8 у женщин с привычными ранними выкидышами и неоднократными очень ранними преждевременными родами и антенатальными гибелями плодов в сроках до 28 недель беременности.
Материал и методы исследования
Нами были обследованы 100 женщин. I группу составили пациентки с привычными ранними гестационными потерями (до 22 недель беременности, n=30). Во II группу вошли пациентки с очень ранними преждевременными родами и антенатальными гибелями плодов (с 22-й по 28-ю неделю беременности, n=40). Группу сравнения (III группу) составили женщины с неосложненным течением беременности и наличием не менее двух своевременных родов в анамнезе (n=30). Средний возраст обследуемых составил 36,0±3,6 года. Количество беременностей у женщин достоверно не отличалось и составило в первой группе 4,1±0,6, во второй – 4,3±0,5, в третьей – 3,1±0,5.
Критерием включения пациенток в I группу исследования стало наличие в анамнезе не менее 2 самопроизвольных последовательных потерь беременности в сроке до 22 недель, не связанных с аномалиями развития или хромосомной патологией плода. II группу составили пациентки с аналогичными критериями и 2 и более очень ранними преждевременными родами с 22-й по 28-ю неделю беременности либо антенатальной гибелью плодов в указанные сроки.
Критериями исключения из исследования были: наличие анатомических причин привычных потерь беременности (врожденные пороки развития половой системы, миома матки больших размеров или миома с центрипетальным ростом узла, значительно деформирующим полость матки, внутриматочные синехии), аномалии кариотипа родителей, наличие совместимости супругов по системе HLA II класса по 3 и более аллеям, наличие высоких титров антифосфолипидных антител, признаков тромбофилии по данным лабораторных исследований.
В работе проводилось исследование полиморфизма гена IL8: -251 A>T (rs 4073). Выделение ДНК проводили по методу Higuchi (R. Higuchi, H. Erlich, 1989) с некоторыми модификациями. Полимеразную цепную реакцию и определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия) [17, 18].
Результаты исследования и обсуждение
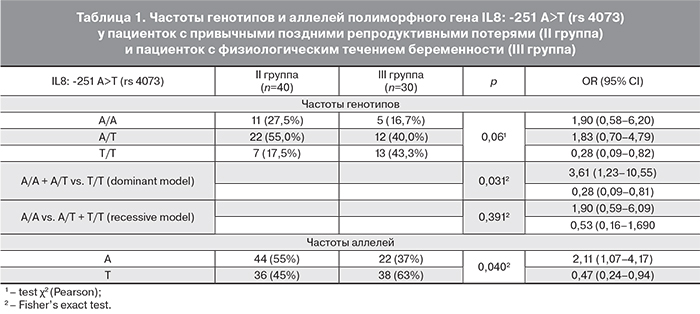
При исследовании частот аллелей полиморфного гена IL8:-251 A>T выявлены статистически значимые различия в группе пациенток с поздними репродуктивными потерями (табл. 1). Так, частота аллеля А в группе женщин с поздними гестационными потерями (II группа) была достоверно выше, чем в группе с физиологическим течением беременности (III группа) и составила 55,0 против 37,0% (p=0,040, OR 2,11, CI 1,07–4,17), частота аллеля Т – достоверно ниже – 45 против 63% (p=0,004, OR 0,47, CI 0,24–0,94). Следовательно, аллель A ассоциируется с риском привычных поздних гестационных потерь.
При изучении распределения генотипов полиморфного гена IL8: -251 A>T в данных группах мы получили данные, близкие к достоверным: при использовании общей модели наследования частоты генотипов А/А и А/Т были выше во II группе (27,5; 55,0%), чем в группе сравнения (16,7%, 40,0% соответственно; p=0,06).
Также был произведен расчет с помощью доминантой и рецессивной статистических моделей, в результате чего мы получили достоверные данные при использовании доминантной модели, что указывает на повышение риска невынашивания беременности поздних сроков у обладателей как гомозиготного, так и гетерозиготного полиморфизма гена IL8: -251 A>T по аллелю А, причем риск одинаков как для гомозигот, так и для гетерозигот.
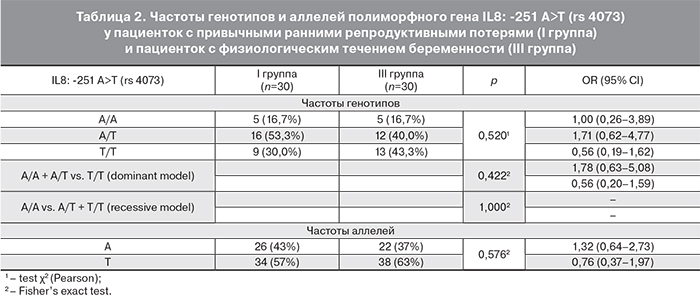
При сравнении распределения частот аллелей и генотипов в группе женщин с ранними гестационными потерями и физиологическим течением беременности статистически значимых различий выявлено не было (табл. 2).
Проанализировав полученные данные, можно сделать заключение о возможном выступлении аллеля А IL8: -251 A>T в качестве фактора риска и протективном значении аллеля Т в отношении поздних гестационных потерь. Не выявлено влияния полиморфизмов гена IL8: -251 A>T на риск привычного невынашивания беременности ранних сроков.
Полученные данные можно объяснить следующими механизмами: IL-8 играет роль в процессах инвазии трофобласта в миометрий и ремоделирования спиральных артерий, последний из которых продолжается с ранних сроков гестации до 20–22 недель. Показано, что во время инвазии трофобласта концентрация макрофагов в децидуальной оболочке высока, что может играть роль в фагоцитозе и тканевом ремоделировании, а также секреции цитокинов, влияющих на инвазию экстравиллезного трофобласта [19]. Таким образом, нарушение процессов инвазии трофобласта может служить этиологическим фактором ранних гестационных потерь. В нескольких работах, проведенных у беременных с привычным выкидышем, исследовались сывороточные уровни IL-6 и IL-8, однако были получены противоречивые данные.
По данным британских ученых, уровни IL-6 и IL-8 в CD56+ и CD14+-клетках, выделенных из децидуальной оболочки, были ниже у пациенток со спорадическими выкидышами, чем при физиологически протекающей беременности в сроках беременности 7–11 недель. [20]. При изучении американскими исследователями уровней IL-8 в децидуальной оболочке в сроках 7–9 недель гестации у беременных с 2 и более выкидышами в анамнезе отмечались более высокие его уровни, чем при физиологическом течении беременности либо однократной потерей беременности. Однако не сообщается, в каких клеточных популяциях исследовался этот цитокин [21].
Установлено, что IL-8 вызывает хемотаксис и активацию нейтрофилов при бактериальных инфекциях, что способствует дальнейшей выработке цитокинов и повышению сократительной способности матки и размягчению ее шейки.
При изучении цитокинового профиля у беременных с преждевременным излитием околоплодных вод в сроках беременности 22–34 недели выявлено значительное повышение в крови уровней IL-1β, IL-6, IL-8, что свидетельствует об усилении антигенной стимуляции моноцитарно-макрофагальных, лимфоидных клеток, эндотелиоцитов, фибробластов в системе «мать-плацента-плод» и указывает на развитие синдрома системного воспалительного ответа [22].
Шведские ученые исследовали цитокиновый профиль в цервикальном секрете у пациенток с преждевременным разрывом плодных оболочек до 34 недель гестации. Показано значительное увеличение концентраций IL-6, IL-8 в цервикальной слизи у беременных с наличием интраамниальной воспалительной реакции и преждевременными родами, наступившими до 34 недель беременности [23].
В аналогичном исследовании у беременных с гестационным сроком менее 34 недель также производился забор амниотической жидкости путем амниоцентеза и цервикальной слизи. После родов проводилось исследование плодных оболочек на наличие Ureaplasma urealyticum и Mycoplasma hominis, которые были обнаружены в 8 случаях из 21, также отмечалось повышение концентраций IL-6 и IL-8 в околоплодных водах этих беременных при амниоцентезе [24].
Данные результаты можно объяснить тем, что IL-8 является хемоаттрактантом для нейтрофилов, которые мигрируют в область шейки матки, где вырабатывают матриксные металлопротеиназы-8 (нейтрофильную коллагеназу) и нейтрофильную эластазу – ферменты, участвующие в разрушении межклеточного матрикса [25].
В результате полученных данных можно сделать вывод о значимой роли ремоделирования спиральных артерий и инвазии трофобласта не только в патогенезе прерывания беременности на ранних сроках, но также и на поздних этапах беременности с 22 по 28 недели гестации. Запуск цитокинового каскада в реализации системного воспалительного ответа может стимулировать сократительную активность миометрия, а также способствовать размягчению шейки матки в более ранних гестационных сроках.
В связи с этим, при выявлении генотипов IL-8 А/А либо А/Т в положении -251 рекомендовано проведение терапии, направленной на улучшение ремоделирования спиральных артерий, а также более тщательное обследование для своевременного выявления маркеров воспалительных реакций и предотвращения реализации системного воспалительного ответа.



