Преодоление бесплодия у больных с генитальным эндометриозом является одной из наиболее актуальных проблем акушерства и гинекологии. Это обусловлено его высокой частотой, мультифакториальной природой нарушения репродуктивной функции при данном заболевании, а также необоснованными повторными оперативными вмешательствами на органах малого таза, отсутствием противорецидивной терапии и поздним использованием вспомогательных репродуктивных технологий [1–3].
Наиболее сложной научно-практической задачей представляется преодоление бесплодия у пациенток с тяжелыми формами наружного генитального эндометриоза (НГЭ), включающими в себя поражение яичников [4, 5]. По разным оценкам, среди пациентов с НГЭ, частота встречаемости эндометриом составляет 17–44% [6]. Оптимальным методом преодоления бесплодия в этом случае является экстракорпоральное оплодотворение (ЭКО) [2].
При планировании протокола ЭКО чрезвычайно важным аспектом является подготовка пациенток, в том числе в период так называемого периконцепционного окна, в течение которого высока вероятность эпигенетических нарушений. Считается, что данный период охватывает время шести месяцев до срока планирования беременности (соответственно даты вступления в протокол ЭКО), период имплантации и раннего развития эмбриона (до 10 недель беременности). По нашему мнению, подготовка должна носить гармоничный характер. Это включает в себя следующие позиции:
- профилактика врожденных пороков развития;
- общие рекомендации (контроль веса, умеренные физические нагрузки, рациональный характер питания, недопущение курения и иных вредных привычек, ограничение употребления ненужных лекарственных препаратов);
- своевременность использования протокола ЭКО;
- гормональная супрессивная терапия в течение 3–6 месяцев до вступления в протокол ЭКО.
Профилактика врожденных пороков развития
Врожденные пороки развития принято рассматривать как результат воздействия комплекса факторов: как экзогенных, так и эндогенных. Фолиевая кислота один из компонентов необходимых для нормального развития плода и ее дефицит может проявить себя повышением риска разнообразных осложнений, в том числе связанных с областями интенсивного деления клеток (трофобласт, эмбриобласт, плацента). Во многих исследованиях выявлена взаимосвязь между дефицитом фолиевой кислоты и ассоциированной с ней гипергомоцистеинемией и оксидативного стресса на формирование плаценты, риск отслойки хориона и плаценты, инфарктов плаценты, развитие плацентарной недостаточности, в том числе обусловленной дефектами формирования плацентарного сосудистого русла. Показано, что кумулятивный риск преждевременных родов имеет обратную зависимость от длительности приема фолиевой кислоты в преконцепционный период. При этом адекватное содержание фолатов в эритроцитах при наступлении беременности снижает вероятность преждевременных родов на 50–70% [7]. Эта позиция является еще более актуальной для больных с тяжелыми формами эндомериоза. В ретроспективном когортном исследовании, опубликованном в 2009 году S. Fernando и соавт., проанализированы исходы беременностей в результате ЭКО у пациенток с эндометриозом в период с 1991 по 2004 годы. В результате анализа установлено, что частота синдрома задержки развития плода и преждевременных родов в группе пациенток с наличием эндометриомы яичника была в два раза выше, чем в группах с другими формами эндометриоза [8], что подтверждает необходимость уделять особое внимание подготовке к протоколу ЭКО и последующей беременности у данной группы пациентов.
Наряду с перечисленным, ключевой особенностью дефицита фолиевой кислоты является значительный риск пороков незаращения нервной трубки у потомства (ДНТ). ДНТ занимают одно из первых мест в структуре врожденных пороков развития, являющихся причиной заболеваемости и смертности новорожденных. Такие формы ДНТ, как анэнцефалия и расщелина позвоночника (spina bifida) несовместимы с жизнью или приводят к тяжелой инвалидизации. О наличии взаимосвязи между нарушением фолатзависимых процессов и развитием ДНТ известно уже давно [9]. Углубленные исследования показали, что риск формирования ДНТ сильно возрастает при повышенной концентрации гомоцистеина в плазме крови. В свою очередь, прием фолиевой кислоты позволяет снизить содержание гомоцистеина и таким образом уменьшить риск развития ДНТ. В связи с этим, в ряде стран были введены меры по профилактике дефицита фолатов. Так, в США с 1998 г. действует программа обогащения зерновых продуктов фолиевой кислотой в количестве 140 мг на каждые 100 г [10]. Для того чтобы оценить эффективность такой профилактики, Центрами по профилактике и контролю заболеваемости США (Centers for Disease Control and Prevention) была проведена сравнительная оценка частоты встречаемости ДНТ до внедрения профилактической программы и после. Для анализа был взят временной период с 1995 по 2011 гг. Полученные авторами результаты выявили снижение случаев ДНТ на 28% в период после 1998 г., что составляет почти треть от общего количества [11]. Исследователи отметили, что в силу генетических особенностей, дефицит фолатов характерен почти для четверти женщин детородного возраста США. Это определяет важность профилактики дефицита фолиевой кислоты на национальном уровне [12]. Сходная политика в отношении профилактики дефицита фолатов принята и в других странах: так, в Индии, для граждан которой характерен витаминный дефицит в силу высокой распространенности вегетарианства, добавление к диете фолиевой кислоты производится в обязательном порядке всем беременным женщинам [13].
В странах, в которых нет практики профилактического применения фолатов, отмечается наиболее высокий уровень ДНТ. Так, в Аддис-Абебе коллектив исследователей провел ретроспективную оценку частоты встречаемости ДНТ за период с 2009 по 2012 гг. по результатам анализа данных двух крупных госпиталей. Частота встречаемости ДНТ, выявленная авторами, была одна из самых высоких относительно средних мировых показателей (6,1 на 1000). За указанный период на 28961 случаев родов было зарегистрировано 177 случаев рождений детей с ДНТ. Из этих 177 женщин только двое принимали фолиевую кислоту в период беременности [14]. Для обобщения множества исследований влияния фолиевой кислоты на минимизацию риска ДНТ, в 2015 г. авторы Кохрановского сообщества провели анализ с целью получения данных об эффективности и безопасности применения комплексов фолиевой кислоты в период беременности. В анализ были включены все рандомизированные исследования в которых использовались препараты фолиевой кислоты как в качестве моно-средств профилактики, так и в комбинации с поливитаминными препаратами. Суммарно была проведена оценка данных 7391 женщины. Результаты показали, что ежедневное применение фолиевой кислоты в период беременности достоверно позволяет снизить риск развития ДНТ (ОР 0,31; 95% ДИ 0,17–0,58) [15]. Поскольку убедительность Кохрановских обзоров во всем мире не вызывает сомнений, целесообразность применения фолиевой кислоты в качестве профилактики ДНР представляется довольно очевидной.
Как подойти к выбору витаминного препарата? Вопрос не простой. Рынок чрезвычайно широк. Интересные данные были получены в Венгрии. Так, анализ рандомизированных и когортных контролируемых исследований показал, что поливитамины, содержащие 800 мкг фолиевой кислоты (элевит) в сутки были более эффективны в профилактике пороков развития нервной трубки, чем высокодозные препараты фолиевой кислоты [16]. Поливитамины, в состав которых входит 800 мкг фолиевой кислоты (элевит) – эффективный способ профилактики фолатзависимых пороков, к которым относят врожденные аномалии ЦНС, сердечно-сосудистой системы, челюстно-лицевые аномалии, дефекты развития мочевыделительной системы, редукционные пороки конечностей.
Общие рекомендации при планировании беременности носят универсальный характер. Это касается веса, характера питания, физической активности, достаточной насыщенности организма витаминами. К настоящему времени получены научные данные и важной роли достаточного содержания витамина D для осуществления репродуктивной функции. Более того, появились работы, в которых исследуется роль витамина D в механизме развития некоторых гинекологических заболеваний (синдрома поликистозных яичников, гиперпластических процессов эндометрия) [17]. Так, например, показано, что в эндометрии активные метаболиты витамина D снижают выработку интерлейкина 6, ТНФ-α, простогландинов за счет снижения экспрессии COX-2. Помимо усиления инактивации простагландинов за счет 15-гидроксипростагландин дегидрогеназы, 1,25-дигидроксихолекальциферол снижает экспрессию рецепторов простагландинов [18]. Дискутируется роль витамина D и его метаболитов в качестве эмбрионов, эффективности протоколов ЭКО.
Анализ имеющихся отечественных и зарубежных данных позволяет выделить 4 основных фактора, влияющих на эффективность протокола ЭКО [19–21]:
- снижение овариального резерва и нарушение фолликулогенеза в яичниках;
- снижение качества половых клеток, нарушение оплодотворения in vitrо;
- нарушение развития эмбрионов in vitrо;
- неадекватные морфофункциональные характеристики эндометрия (нарушение рецептивности).
Снижение овариального резерва часто приводит к использованию высоких доз гонадотропинов, к так называемому «бедному ответу» яичников на гонадотропную стимуляцию, при котором удается получить небольшое количество ооцитов. Прежде всего это касается больных после оперативного вмешательства по поводу эндометриом яичников [22].
Научных сведений о качестве ооцитов у больных НГЭ немного. Считается, что при НГЭ может быть нарушено функциональное взаимодействие между гранулезными клетками фолликула и ооцитом, что, вероятно, изменяет качество последнего [23–25]. В экспериментальных условиях (на грызунах) Cohen и соавт. (2015) выявили, что развитие эндометриоза ассоциировано с уменьшением количества зрелых ооцитов (M II стадия). В некоторых зарубежных работах показано, что клеточный цикл гранулезных клеток фолликулов у больных НГЭ по сравнению с пациентками с бесплодием иного генеза отличается высоким индексом апоптоза (наиболее выражен у больных с эндометриомами яичников) и задержкой клеток в S фазе клеточного цикла [26]. Кроме этого, Toya и соавт. (2002) получили данные о повышении содержания маркеров оксидативного повреждения ДНК и оксидативного стресса в клетках гранулезы [27].
Частота эмбрионов низкого качества у больных НГЭ в 6 раз выше таковой при бесплодии другого генеза [28]. Описаны такие нарушения развития эмбрионов, ассоциированные с НГЭ, как высокая степень фрагментации цитоплазмы, «темная» цитоплазма, снижение числа бластомеров [28]. При НГЭ увеличена также частота остановки развития эмбрионов [29] и снижена частота переноса эмбрионов на стадии бластоцисты [30]. Предполагается, что нарушения развития эмбрионов обусловлены активацией апоптоза клеток вследствие характерного для НГЭ повышения концентрации провоспалительных цитокинов, а также влиянием оксидативного стресса.
Доказанной причиной нарушения рецептивных свойств эндометрия является изменение метаболизма половых стероидных гормонов в эндометрии и нарушение его чувствительности к эстрогенам и прогестерону. Не исключена также роль местной воспалительной реакции и оксидативного стресса в эндометрии при эндометриозе в нарушении процессов пролиферации, апоптоза и ангиогенеза клеток эутопического эндометрия.
Своевременность использования методов вспомогательных репродуктивных технологий, в том числе экстракорпорального оплодотворения (ЭКО), является важной позицией стратегии преодоления бесплодия у больных с этим заболеванием. Лечение бесплодия методом ЭКО показано следующим группам больных НГЭ: III/IV степень тяжести заболевания; I/II степень тяжести заболевания при безуспешности естественного зачатия, а также отсутствии результата от применения индукции овуляции или внутриматочной инсеминации в течение 6 месяцев после хирургического или комбинированного этапа лечения заболевания; старший репродуктивный возраст (при любой степени тяжести заболевания); сниженный овариальный резерв (при любой степени тяжести заболевания); нарушение проходимости маточных труб; отклонения в параметрах спермограммы, требующие применение оплодотворения с помощью ИКСИ; инфильтративные формы заболевания.
Гормональная супрессивная терапия перед протоколом ЭКО. В ряде исследований было показано, что гормональная терапия перед протоколом ЭКО повышает его эффективность [31]. В связи с многолетним опытом применения агонистов гонадотропин-рилизинг гормона (аГнРГ) рядом европейских профессиональных ассоциаций данная группа препаратов рекомендована в этом качестве. В последние годы с целью медикаментозной терапии эндометриоза стали использовать производное 19 норстероидов – диеногест. Опубликованы результаты исследований, подтверждающие его эффективность, сравнимую с аГнРГ, в отношении купирования болевого синдрома [32]. Несомненными преимуществами препарата является отсутствие выраженной гипоэстрогенемии и связанных с ней побочных эффектов. Однако отечественные и зарубежные исследования, посвященные эффективности применения диеногеста с целью преодоления бесплодия у больных с НГЭ методом ЭКО, отсутствуют.
Материал и методы исследования
Исследование проведено на базе ФГБНУ НИИ АГиР им. Д.О. Отта в отделении вспомогательных репродуктивных технологий. Были отобраны 144 пациентки в возрасте от 23 до 42 лет включительно, прошедшие оперативное лечение эндометриомы яичника по поводу бесплодия за последние 3 года. Уровень АМГ пациенток был не ниже 0,5 нг/мл. Все исследуемые пациентки были разделены на 3 группы: в I группу вошли 38 пациенток, получавших в течение 3–6 месяцев перед протоколом ЭКО диеногест (2 мг в сутки); во II группу − 70 пациенток, получавших в течение 3–6 месяцев до протокола ЭКО препараты аГнРГ (депо-форма); в III группу − 36 пациенток, не получавших гормональной терапии перед протоколом ЭКО. Стимуляция в протоколе ЭКО осуществлялась с использованием препаратов рекомбинантного ФСГ (р-ФСГ), введение антагонистов ГнРГ начиналось при достижении фолликулами диаметра 14 мм.
Результаты исследования
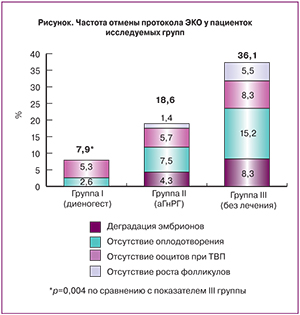 Эффективность протоколов ЭКО оценивали по частоте наступления клинической беременности и частоте родов. Также учитывали общую дозу гонадотропинов, количество фолликулов более 14 мм в день введения триггера, полученных ооцитов при пункции и количество эмбрионов хорошего качества на 3-й день развития.
Эффективность протоколов ЭКО оценивали по частоте наступления клинической беременности и частоте родов. Также учитывали общую дозу гонадотропинов, количество фолликулов более 14 мм в день введения триггера, полученных ооцитов при пункции и количество эмбрионов хорошего качества на 3-й день развития.
Достоверных отличий в длительности гонадотропной стимуляции яичников у пациенток обследованных групп выявлено не было. Общая доза р-ФСГ на протокол ЭКО в группе пациенток без гормонального лечения (2650 МЕ) была выше, чем для группы пациентов, получавших диеногест (1800 ME, p=0,001) и аГнРГ (1862,5 ME, p=0,002).
Количество фолликулов диаметром более 14 мм на момент введения триггера финального созревания фолликулов у больных без гормонального лечения было достоверно меньше (3; (2; 6)), чем у больных получавших диеногест (5,5 (4; 8), р=0,02) и аГнРГ (6; (3; 10), р=0,06).
Среднее количество ооцитов у больных без гормонального лечения (III группа) было достоверно меньше, чем у больных получавших диеногест и аГнРГ: 2 (1; 4); 5 (2; 8) и 4,5 (3; 7) соответственно (p=0,002).
Частота «бедного» ответ яичников на стимуляцию у больных без гормонального лечения (55,6%) достоверно превышала таковую у больных после терапии диеногестом (18,4%, p=0,012) и аГнРГ (32,9%, p=0,003).
Среднее количество зигот у больных без гормонального лечения (III группа) было достоверно меньше, чем у больных получавших диеногест и аГнРГ: 2 (0; 3); 3,5(2; 5) и 3 (1; 6) соответственно (p=0,01).
Среднем количество эмбрионов класса А (6–8 бластомеров) на 3-й день развития у больных, получавших лечение диеногестом (I группа) достоверно превышало таковое у больных без гормонального лечения (III группа): 2,5 (1; 5) и 1 (0; 2) соответственно (p=0,01).
Частота переноса одного эмбриона у больных I группы составила 20,0%, у больных II группы – 26,3%, у пациенток III группы – 39,1% (p=0,651). Средняя частота переноса одного эмбриона у больных обследованных групп составила 25,2%. Высокая частота переноса одного эмбриона в нашем исследовании обусловлена низким количеством полученных ооцитов и, соответственно, эмбрионов у больных после оперативного лечения эндометриом яичников, большинство из которых имели низкий овариальный резерв.
Толщина эндометрия при переносе эмбрионов достоверно не различалась в исследуемых группах и составила 11,3±1,3 мм, 10,8±1,0 мм, 10,9±0,3 мм для I, II и III групп соответственно (p=0,833). Секреторной трансформации по данным УЗИ эндометрий соответствовал в 97,1% случаев в I группе, в 96,5% случаев во II группе и в 95,7% в III группе (достоверные отличия между группами отсутствуют).
Средняя частота отмены протоколов ЭКО у пациенток среди всех групп исследования составила 20,1%. Частота отмены протокола ЭКО в группе пациенток, не получавших гормональную терапию (III группа) была в 4,5 раза выше таковой у больных после терапии диеногестом (I группа) и в 2 раза выше, чем у больных после терапии аГнРГ (p=0,004, рисунок). Основной причиной отмены протокола ЭКО у больных без гормональной терапии была неэффективная стимуляция яичников (у 8,3% пациенток отсутствовал ответ яичников на стимуляцию и у 15,2% не было получено ооцитов при пункции фолликулов). В нашем исследовании впервые проведен анализ структуры причин отмены протокола ЭКО в зависимости от проведения и варианта предварительной гормональной терапии. По данным зарубежных исследований, в общей популяции больных с уни- и билатеральными эндометриомами яичников в анамнезе частота отмены протоколов ЭКО составляла от 6,4 до 24,4% [33].
Частота наступления беременности (в расчете на протокол) у больных I группы (после терапии диеногестом) составила 44,8%, что достоверно выше, чем у больных III группы (без гормонального лечения) — 16,7% (p=0,017). Шансы наступления беременности в группе с использованием диеногеста в качестве гормональной терапии перед протоколом ЭКО в 2,5 раза выше, чем без гормональной терапии.
Частота наступления беременности (в расчете на протокол ЭКО) у больных II группы (после терапии аГнРГ) составила в 34,3% и не имела достоверного отличия от аналогичного показателя у больных I и III групп.
Частота родов в группе пациентов, получавших диеногест, составила 36,8% (I группа), а в группе больных без гормонального лечения (III группа) – в 3 раза ниже (11,1%) (p=0,01). При этом частота родов у больных, получивших перед протоколом ЭКО аГнРГ (II группа) также превышала аналогичный показатель у больных без гормональной терапии (28,6%), однако различия не были статистически достоверными (p=0,053). Также не было получено статистически значимых различий в частоте родов у больных I и II групп (36,8 и 28,6% соответственно, p=0,479).
Частота многоплодной беременности (двойни) составила в среднем 21% (в расчете на число родов), что соответствует нижнему уровню частоты многоплодия после ЭКО (19,5–45,6%) [34, 8].
Средняя масса новорожденных при одноплодной беременности составила 3190 г (3050–3520 г), при многоплодной беременности - 2825 г (2685– 3050 г).
Обсуждение
Повышение эффективности протоколов ЭКО у больных НГЭ после предварительной гормональной терапии агонистами ГнРГ описано в отечественно и зарубежной литературе, а также включено в рекомендации Европейского общества репродукции человека и эмбриологии. Возможно, что повышение эффективности протоколов ЭКО у больных с генитальным эндометриозом после гормональной терапии обусловлено увеличением количества эмбрионов хорошего качества и повышением имплантационной способности эндометрия. В некоторых экспериментальных и клинических исследованиях было показано увеличение экспрессии фактора имплантации интегрина αvβ3 в эндометрии после терапии аГнРГ [20, 35]
Данные об эффективности протоколов ЭКО у больных с генитальным эндометриозом после предварительного лечения диеногестом в отечественной и зарубежной литературе отсутствуют. Вероятно, диеногест оказывает позитивный эффект на фолликулогенез и на функциональные свойства эндометрия у больных генитальным эндометриозом. Так, A. Hayashi и соавт. (2012) показали, что использование диеногеста приводит к увеличению соотношения прогестероновых рецепторов (ПР) типа В и А (ПР В/ПР-A) и снижению соотношения между эстрогеновыми рецепторами (ЭР) типа α и β (ЭРβ/ЭРα), таким образом способствуя преодолению состояния так называемой «прогестероновой резистентности» эндометрия, характерного для больных эндометриозом [36].
Повышении чувствительности яичников к гонадотропной стимуляции, выявленное в нашем исследовании, у больных после оперативного лечения эндометриом яичников и гормональной терапии диеногестом или аГнРГ может быть обусловлено оптимизацией сигнальных путей регуляции фолликулогенеза, в том числе снижением провоспалительной реакции и выраженности оксидативного стресса в яичниках, приводящих к преждевременной активации гранулезных клеток, несвоевременному созреванию фолликулов и апоптозу ооцитов [37].
Заключение
Таким образом, комплексный подход в периконцепционный период, включающий в себя профилактику врожденных пороков развития, общие рекомендации и супрессивную гормональную терапию перед протоколом ЭКО, является перспективным направлением повышения эффективности преодоления бесплодия у больных, имеющих тяжелые степени наружного генитального эндометриоза.



