Доброкачественные заболевания молочных желез являются широко распространенной патологией в женской популяции, достигая частоты 50–60% в зависимости от возраста женщин. Так, до 20 лет мастопатия встречается редко, в 20–30 лет – у 20–30% женщин, в 30–40 лет – у 50–60%, в 41–50 лет – у 70–80%, в менопаузе – до 20% [1–3].
В МКБ 10-го пересмотра данная патология обозначена как доброкачественная дисплазия молочной железы (ДДМЖ). Она характеризуется спектром пролиферативных и регрессивных изменений тканей молочных желез с формированием ненормальных соотношений эпителиального и соединительнотканного компонентов и образованием в молочной железе изменений фиброзного, кистозного, пролиферативного характера [4].
Наиболее часто пациентки с фиброзно-кистозной болезнью (ФКБ) предъявляют жалобы на нагрубание, болезненность в молочной железе с одной или обеих сторон. Боль может быть локальной или иррадиировать в область ключицы, плеча, беспокоить женщину постоянно либо возникать периодически – перед менструацией. Такой вариант боли, связанный с менструальным циклом, возникающий во II фазу менструального цикла и исчезающий непосредственно во время менструации или в течение первых дней после ее начала, принято обозначать термином «циклическая масталгия». Исследователи предполагают, что она обусловлена раздражением чувствительных нервов вследствие отека, фиброза соединительной ткани, а также давления кист и расширения млечных протоков на пике эстрогеновых влияний лютеиновой фазы цикла. Подобные симптомы, безусловно, снижают качество жизни пациенток, вызывая чувство тревоги, снижение настроения, канцерофобию [5, 6].
Следует подчеркнуть, известна ассоциация некоторых видов доброкачественных заболеваний молочной железы с развитием рака молочной железы. Это нашло отражение в различных вариантах классификаций, прежде всего, морфологической [7].
Гистологические варианты опухолей молочной железы были предложены ВОЗ в 1995 г.: доброкачественные эпителиальные опухоли; внутрипротоковая папиллома; аденома соска; аденома (тубулярная и с признаками лактации); смешанные соединительнотканные и эпителиальные опухоли; фиброаденома; листовидная опухоль; дисплазия молочной железы (ФКБ); опухолеподобные поражения (эктазия протоков, воспалительные псевдоопухоли, гамартрома, гинекомастия). Среди них есть нозологии с повышенным риском злокачественной трансформации.
Коллегия американских патологов рекомендовала подразделять женщин с доброкачественными заболеваниями молочных желез, которым выполнена биопсия молочной железы, на 3 категории в зависимости от выявленных морфологических изменений:
1) непролиферативная ФКБ – риск развития рака молочной железы (РМЖ) не повышен и соответствует таковому в популяции;
2) пролиферативная ФКБ без атипии – риск РМЖ повышен в 1,5–2 раза по сравнению с популяцией;
3) пролиферативная ФКБ с атипией – риск РМЖ повышен в 4–5 раз по сравнению с популяцией [8].
Оба последних варианта рассматриваются как предопухолевые.
К сожалению, нет полного соответствия между выраженностью симптомов заболевания, степенью морфологических изменений в органе и риском злокачественной трансформации, даже пролиферативные формы могут быть мало- или бессимптомными [9]. При этом доказано, что циклическая масталгия – независимый клинический маркер повышенного риска РМЖ, увеличивая относительный риск его развития в 5 раз при длительности масталгии ≥3 лет [10], как результат длительного влияния пика эстрогенов 2-й фазы цикла, что объясняет преимущественное развитие мастопатии у нерожавших женщин и в возрастной группе старше 40 лет, т.е. с длительным непрерывным «менструальным стажем».
Но реализация эффектов эстрогенов зависит прежде всего от активации их специфических рецепторов [11]. Установлена закономерность между активностью метаболитов эстрогена и развитием опухолей в эстрогенозависимых тканях, благодаря стимуляции деления клеток молочной железы, которые уже имели какие-либо мутации в ДНК или вновь приобрели их под влиянием хорошо известных факторов риска доброкачественных заболеваний [12].
Кроме того, пролиферативным эффектом на гормональнозависимые ткани влияет не сам уровень женских половых гормонов, а нарушение баланса его метаболитов – эстрогенов, имеющих разную способность к активации клеточной пролиферации [13].
Трансформация метаболитов эстрогена осуществляется в печени ферментами цитохрома Р450 (CYP450), которые катализируют образование гидроксипроизводных эстрогенов (фаза 1), что облегчает их растворимость и выведение с мочой после метилирования, глюкуронидации и сульфатирования (фаза 2). При участии изофермента CYP1A1 образуются 2-ОН метаболиты: 2-гидроксиэстрон (2-OHE1) и 2-гидроксиэстрадиол (2-OHE2). Метаболиты 2-ОН действуют как антиэстрогены. 2-ОНЕ1 ингибирует митотическую активность клеток, предотвращая онкогенез. Понижение уровня этого метаболита может вызвать состояние гиперэстрогенемии. Изофермент CYP1B1 катализирует переход эстрогенов в 4-гидроксиэстрон (4-OHE1), а изофермент CYP3А4 – в 16α-гидроксиэстрон (16α-OHE1). Метаболиты 16α-ОН и 4-ОН обладают высокой эстрогенной активностью, т. е. действуют как агонисты. Повышение их уровня стимулирует усиленную митотическую активность клеток и ассоциировано с развитием эстрогенозависимых опухолей [14]. 4-ОНЕ1, помимо этого, обладает прямым генотоксическим действием, проникая в клетку, минуя рецепторы эстрогена, повреждая ДНК клеток и приводя к возникновению новых мутаций [11].
Таким образом, соотношение метаболитов эстрадиола 2-ОНE1/16a-OHE1 является биомаркером развития патологической клеточной пролиферации в эстрогенчувствительных тканях и при низком риске эстрогензависимой пролиферации должен быть равен или больше 2,0 [15].
Большое внимание и интерес клиницистов привлекают препараты на основе вещества природного происхождения – индолкарбинола, обладающего антипролиферативным действием. В Российской Федерации зарегистрирован лекарственный препарат на основе индолкарбинола в дозе 0,2 г – «Индинол Форто». Показанием для его назначения является лечение циклической масталгии (мастодинии), в т.ч. на фоне доброкачественной гиперплазии молочной железы. Он проявляет мягкий антиэстрогенный эффект и нормализует гормональный баланс, вызывает избирательную гибель клеток молочной железы с аномально высокой пролиферативной активностью. Механизм действия связан с модуляцией цитохромной системы печени таким образом, что изоформа цитохрома Р450 – CYP1A1 гидроксилирует эстрогены во 2-м положении, с образованием 2-ОНЕ1, который блокирует активацию рецептора эстрогенов эстрогенами и 16α-ОНЕ1, доля которого среди метаболитов снижается. Таким образом, клетка перестает получать чрезмерную эстрогензависимую стимуляцию. Препарат также блокирует цитокиновые сигнальные механизмы, стимулирующие патологический клеточный рост в тканях молочной железы, подавляя сигнальные каскады от соответствующих рецепторов [16].
Цель исследования: представить собственный опыт применения препарата «Индинол Форто» в лечении болевого синдрома в молочной железе при циклической масталгии у пациенток с доброкачественной дисплазией молочной железы.
Материалы и методы
В период 2017–2018 гг. проведено обследование и лечение 32 женщин с подтвержденной доброкачественной дисплазией молочной железы, получавших препарат «Индинол Форто» по 200 мг 2 раза в день перед едой в течение 6 месяцев. Средний возраст пациенток составил 40,9±11,2 года. У 20/32 (63,3%) больных выявлена диффузная форма, у 12/32 (36,7%) – узловая или диффузно-узловая мастопатия (наличие одного или нескольких узлов на фоне диффузного уплотнения ткани молочной железы). Критериями исключения из исследования явились: известная индивидуальная повышенная чувствительность к любому компоненту препарата «Индинол Форто», глюкозо-галактозная мальабсорбция, непереносимость галактозы, недостаточность фермента – лактазы, беременность и кормление грудью, возраст до 18 лет.
Медицинская помощь оказывалась в амбулаторных условиях.
Обследование проводилось в соответствии с «Порядком оказания медицинской помощи по профилю “Акушерство и гинекология (за исключением вспомогательных репродуктивных технологий)”», утвержденным Приказом Министерства здравоохранения Российской Федерации № 572н от 01.11.2012 года (приложение 20 «Этапность оказания медицинской помощи женщинам с гинекологическими заболеваниями»), включая осмотр и пальпацию молочных желез, УЗИ молочных желез и допплерографию, рентгеномаммографию, определение уровней ФСГ, ЛГ, ТТГ, свободного Т4, пролактина, эстрадиола, прогестерона по показаниям. 18 пациенток с диффузно-узловой формой были направлены на консультацию к онкологу в РООД, где 8 из них была выполнена биопсия молочной железы.
Всем пациенткам назначали препарат «Индинол Форто» в дозировке по 200 мг (1 капсула) 2 раза в день перед едой в течение 6 месяцев. Женщины использовали дневники, заполняемые ежедневно.
Результаты
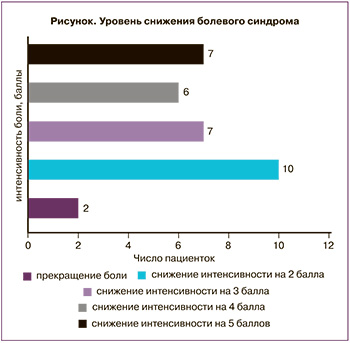 Наиболее частой жалобой пациенток были субъективные болевые ощущения в молочных железах различной интенсивности, встречались у 100% обследуемых женщин. Интенсивность боли оценивалась по визуально-аналоговой шкале (ВАШ). У 28/32 (92,4%) женщин отмечены эмоциональная лабильность, беспокойство, тревожное состояние, канцерофобия. Критерием эффективности лечения был факт уменьшения болевых ощущений (от 2 до 5 баллов по визуально-аналоговой шкале) в течение 6 месяцев у 30/32 (94%) пациенток, у 2 пациенток (6%) исчезли болезненные ощущения в молочной железе (рисунок).
Наиболее частой жалобой пациенток были субъективные болевые ощущения в молочных железах различной интенсивности, встречались у 100% обследуемых женщин. Интенсивность боли оценивалась по визуально-аналоговой шкале (ВАШ). У 28/32 (92,4%) женщин отмечены эмоциональная лабильность, беспокойство, тревожное состояние, канцерофобия. Критерием эффективности лечения был факт уменьшения болевых ощущений (от 2 до 5 баллов по визуально-аналоговой шкале) в течение 6 месяцев у 30/32 (94%) пациенток, у 2 пациенток (6%) исчезли болезненные ощущения в молочной железе (рисунок).
Кроме того, 27/32 (96,4%) женщин отметили улучшение эмоционального состояния, повышение настроения на фоне снижения масталгии.
При этом, согласно данным УЗИ, выполненным через 6 месяцев после начала лечения, узловые образования подверглись регрессу в виде уменьшения размеров и количества кист у 8/12 (67%) пациенток с диффузно-узловой формой мастопатии. У 2/32 (17%) женщин регресс изначально небольших кист был полным. Отмечалось снижение эхографической плотности у всех 32 (100%) пациенток.
Побочные эффекты от проводимой терапии были выражены у 1/32 (3,2%) пациентки: боли в эпигастрии, что не потребовало отмены препарата, поскольку прекратились через несколько дней на фоне применения симптоматической терапии. Помимо этого, все пациентки, принимавшие лекарственный препарат на основе индолкарбинола, не имели отклонений в продолжительности менструального цикла и изменении массы тела. Столь низкий процент побочных эффектов указывает на хорошую переносимость препарата.
Таким образом, современное понимание опасности циклической масталгии, своевременная диагностика возможной причины которой и корректное лечение препаратами, способными избирательно индуцировать в опухолевых клетках процесс программируемой клеточной гибели, обеспечит пациентке не только приемлемое качество жизни, но и профилактику рака молочной железы.
Заключение
Наш опыт подтвердил, что препарат «Индинол Форто» можно применять в качестве одного из средств первой линии в лечении при циклической масталгии, в том числе, у пациенток с доброкачественной дисплазией молочной железы.



