Увеличение продолжительности жизни современных женщин все чаще ставит во главу угла вопросы сохранения их здоровья, качества жизни, социальной активности и работоспособности. Менопауза является нормальной частью жизненного цикла женщины и состоит из ряда изменений в организме, в том числе, со стороны иммунной системы.
Женские половые гормоны, включая эстрогены и прогестерон, действуют как регуляторы врожденного и приобретенного иммунитета, в связи с чем у женщин отмечается высокая реактивность как гуморальных, так и клеточноопосредованных иммунных реакций. Ряд исследований позволил сделать вывод, что женщины являются более устойчивыми к вирусным заболеваниям, в частности к инфекции, вызванной SARS‑CoV‑2 [1].
Анализ данных о COVID‑19 из Италии, Испании, Германии, Швейцарии, Бельгии и Норвегии показывает, что среди всех возрастных групп старше 20 лет смертность среди мужчин была выше, чем среди женщин [2]. Тот факт, что мужчины всех возрастов и женщины после 50 лет имеют самый высокий риск развития серьезных осложнений инфекции COVID‑19, вновь поднимает вопрос о роли половых стероидов в заболеваемости [3, 4]. Это позволяет предположить наличие определенных защитных механизмов женского организма, которые, возможно, потенцируют терапевтический эффект со снижением заболеваемости и смертности от COVID19 [5].
В основе иммунного старения лежат процессы хронического воспаления, повышенная уязвимость к инфекционным заболеваниям, предрасположенность к онкологическим и аутоиммунным заболеваниям у пожилых людей [6]. Иммунологическое старение является следствием возрастных изменений в функции иммунных клеток и их субпопуляционного состава [6]. Отличительные признаки иммунного старения включают иммунный профиль, характеризующийся сниженным соотношением CD4+:CD8+ Т‑клеток, увеличением числа дифференцированных клеток памяти и эффекторных Т‑клеток, истощением наивных Т‑клеток и снижением количества В‑клеток, а также повышенным уровнем провоспалительных цитокинов.
Было показано, что прием менопаузальной гормональной терапии (МГТ) в значительной степени нейтрализует эти изменения. Так, ряд исследований показал, что МГТ приводила к увеличению количества циркулирующих В‑клеток и особенно популяции В2 В‑клеток, а также в меньшей степени – Т‑клеток [7, 8]. Поскольку хорошо известно, что половые стероиды модулируют иммунный ответ, можно предположить, что МГТ может замедлить процессы иммунного старения. Тем не менее точные молекулярные пути, связывающие МГТ и иммунное старение, до сих пор не выяснены [9].
Целью применения МГТ у женщин в перии постменопаузе является частичное восполнение дефицита половых гормонов, используя минимально оптимальные дозы гормональных препаратов, способные улучшить общее состояние женщин, купировать климактерические симптомы, обеспечить профилактику поздних обменных нарушений [10].
В настоящее время эстрогены в составе МГТ назначаются как перорально, так и трансдермально. Известно, что вследствие отсутствия первичной стадии печеночного метаболизма трансдермальные формы эстрогенов имеют более благоприятный профиль безопасности в отличие от эквивалентных доз пероральных эстрогенов: не повышается риск венозных тромбоэмболических осложнений и желчнокаменной болезни, ниже риск сердечно‑сосудистых событий (инфаркта, инсульта) [10].
Возможно, путь введения эстрогенов у женщин в постменопаузе имеет значение в отношении системного воспаления. Так, в исследованиях было показано, что трансдермальные эстрогены ослабляли реакцию гипоталамо‑гипофизарно‑надпочечниковой системы на низкую дозу эндотоксина in vivo, что сопровождалось параллельным снижением эндотоксин‑индуцированной стимуляции воспалительных цитокинов: интерлейкина (IL)‑6, фактора некроза опухоли (TNF)‑α, а также IL‑1ra. Вероятно, это связано с первичным прохождением через печень при пероральном способе доставки эстрогенов, что способствовало увеличению синтеза С‑реактивного белка и маркеров воспаления [11, 12].
В настоящее время опубликованы единичные работы, изучавшие механизмы влияния МГТ на иммунную систему. Таким образом, необходимо провести дополнительные как экспериментальные, так и клинические исследования для выяснения наблюдаемых изменений концентраций других медиаторов молекулярных путей, связывающих МГТ и иммунную систему. В настоящей статье мы оцениваем влияние комбинированной МГТ, содержащей трансдермальный гель эстрадиола в комбинации с микронизированным прогестероном интравагинально, на параметры иммунной системы. Учитывая важную роль иммунной системы как в процессах иммунного ответа у пожилых людей, так и в развитии онкологических, аутоиммунных заболеваний с возрастом, данная тема в настоящее время является актуальной.
Материалы и методы
В период 2021–2022 гг. проведено одноцентровое открытое одногрупповое экспериментальное клиническое исследование с участием 23 женщин в перии постменопаузе (стадии ‑1, +1 по STRAW +10, Stages of Reproductive Aging Workshop, клинико‑гормональная характеристика этапов старения репродуктивной системы 2011 г. [13]) в возрасте от 44 до 57 лет, обратившихся в отделение гинекологической эндокринологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России.
В исследование не включали пациенток с ожирением (индекс массы тела (ИМТ)≥30 кг/м²), системными, онкологическими, аутоиммунными заболеваниями, а также острыми респираторными или обострением хронических заболеваний в течение последних 3 месяцев.
Пациентам была назначена комбинированная МГТ: 0,06% трансдермальный гель эстрадиола гемигидрата – 2,5 г, содержащий 1,5 мг эстрадиола, ежедневно + вагинально микронизированный прогестерон в циклическом или непрерывном режиме (200 мг с 14‑го дня цикла в течение 14 дней ежемесячно/100 мг, ежедневно). Продолжительность лечения составила 3 месяца. Клинико‑лабораторное обследование было выполнено до начала терапии и через 3 месяца использования МГТ.
Исследованиебылоодобренолокальным Этическим комитетом ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России № 11 от 11.11.2021 г. Перед включением в исследование пациенты подписывали информированное добровольное согласие.
Определение тяжести климактерического синдрома проводили с использованием Климактерической шкалы Грина (Greene Climacteric Scale, GCS), включающей оценку психоэмоциональных (1–11 вопрос), физических (12–18 вопрос), вазомоторных (19, 20 вопрос) симптомов и сексуальных расстройств (21 вопрос). На основании суммарного балла по шкале Грина диагностировали климактерический синдром: слабой степени – 1–11 баллов; средней степени – 12–19 баллов; тяжелой степени – 20 баллов и более [13].
Выделение мононуклеаров периферической крови. Для выделения мононуклеаров периферической крови 2 мл цельной крови‑ЭДТА отбирали в отдельную пробирку, добавляли 8 мл буфера для лизиса эритроцитов, на 10 мин помещали пробирку на +4◦С. Далее центрифугировали 300 g 5 мин +4◦С, супернатант удаляли и добавляли к осадку 10 мл фосфатно‑солевого буфера, вновь центрифугировали, супернатант удаляли. Ресуспендировали осадок в 1000 мкл фосфатно‑солевого буфера с БСА (бычий сывороточный альбумин), хранили при +4◦С до измерения.
Проточная цитофлуориметрия. Клетки ресуспендировали в 100 мкл раствора autoMACS (1×105 клеток в 100 мкл) с БСА и окрашивали следующими антителами: CD11b (130‑110‑554), CD14 (130‑110‑518), CD206 (130‑104‑129), CD3 (130‑113‑138), CD4 (130113‑789), CD40 (130‑110‑950), CD56 (130‑114‑549), CD8 (130‑125‑858), CD80 (130‑117‑719), CD86 (130116‑164), CX3CR1 (130‑096‑435), HLA‑DR (130‑111‑789), СD19 (130‑113‑165), CD45 (130‑097‑527), CD16 (130‑045‑701) и CD163 (130‑097‑630), все – Miltenyi Biotec. Анализ проводили на проточном цитометре FACScan (Becton Dickinson, США) с использованием программ CellQuest и FlowJo.
Статистический анализ
Статистическую обработку данных проводили в программе GraphPad Prism 8 и в программе Statistica 10.0. Для проверки характера распределения выборки использовался тест Шапиро–Уилка. Для сравнения количественных параметров в двух связанных совокупностях в случае нормального распределения числовых показателей использовали t‑критерий Стьюдента, в случае распределения, отличного от нормального, применяли ранговый t‑критерий Уилкоксона. Для сравнения бинарных признаков в двух связанных совокупностях использовали критерий Мак‑Немара.
Корреляционный анализ проводился с помощью непараметрического критерия Спирмена (в случае отличного от нормального распределения данных). Величину порогового уровня значимости p принимали равной 0,05.
Результаты
Клинико‑анамнестические данные пациенток в постменопаузе, участвующих в данном исследовании, представлены в таблице 1.

Средний возраст женщин составил 50,0 (3,1) лет, последняя самостоятельная менструация была 6–56 месяцев назад, медиана – 13,5 (7,25; 34,5) месяцев. С использованием Климактерической шкалы Грина у пациенток был диагностирован климактерический синдром легкой степени – в 6/23 (26,1%), средней степени – в 7/23 (30,4%), тяжелой степени – в 10/23 (43,5%) случаях. Исходно медиана суммы баллов по Климактерической шкале Грина составляла 19,0 (12,0; 27,0), что соответствовало климактерическому синдрому средней степени тяжести. Через 3 месяца использования МГТ данный показатель значимо снизился – в 2,2 раза – и составил 8,5 (5,0; 12,0) балла, что соответствовало климактерическому синдрому легкой степени (p=0,001). У пациенток значимо уменьшилась тяжесть вазомоторных симптомов – в 4 раза, физических – в 3 раза, психоэмоциональных и сексуальных – в 2 раза (p<0,05).
Через 3 месяца терапии у пациентов значимо снизилась частота климактерических симптомов: приливов – в 2,7 раза, с 82,6 до 30,4% (р<0,001), ночной потливости – в 1,8 раза, с 73,9 до 39,1% (p=0,012), нарушений сна – в 1,6 раза, с 82,6 до 52,2% (p=0,020), мышечных и суставных болей – в 1,4 раза, с 73,9 до 52,2% (p=0,026).
Для изучения взаимосвязи показателей иммунного статуса с клинико‑анамнестическими характеристиками (возрастом, ИМТ, длительностью периода после последней менструации, тяжестью климактерического синдрома (суммарный балл по Климактерической шкале Грина)) женщин в перии постменопаузе был выполнен корреляционный анализ. По результатам корреляционного анализа была показана значимая положительная корреляция количества цитотоксических Т‑лимфоцитов CD3+CD8+ (r=0,524; 95% ДИ 0,086–0,745; p≤0,001) и естественных клеток‑киллеров (NK‑клеток) CD3‑CD56+CD16+ (r=0,448; 95% ДИ 0,010–0,710; p=0,001) с длительностью постменопаузы; отрицательная корреляция количества Т‑хелперов CD3+CD4+ с длительностью постменопаузы (r=0,397; 95% ДИ ‑0,683–0,041; p=0,005); значимая положительная корреляция количества В‑лимфоцитов CD3‑CD19+HLA‑DR+ с тяжестью климактерического синдрома по шкале Грина и с длительностью постменопаузы (r=0,419; 95% ДИ 0,008–0,709; p=0,046).
Данные представлены в таблице 2. Среди остальных определяемых иммунологических показателей у 9 были выявлены значимые корреляционные связи различной направленности с возрастом, ИМТ, тяжестью климактерического синдрома и длительностью периода после последней менструации. Наиболее сильная прямая корреляционная связь обнаружена между CD14++CD16‑CD86+, CD14++CD16‑CD163+ и возрастом (r=0,547; 95% ДИ 0,174–0,783; p=0,007 и r=0,508; 95% ДИ 0,121–0,761; p=0,013 соответственно).
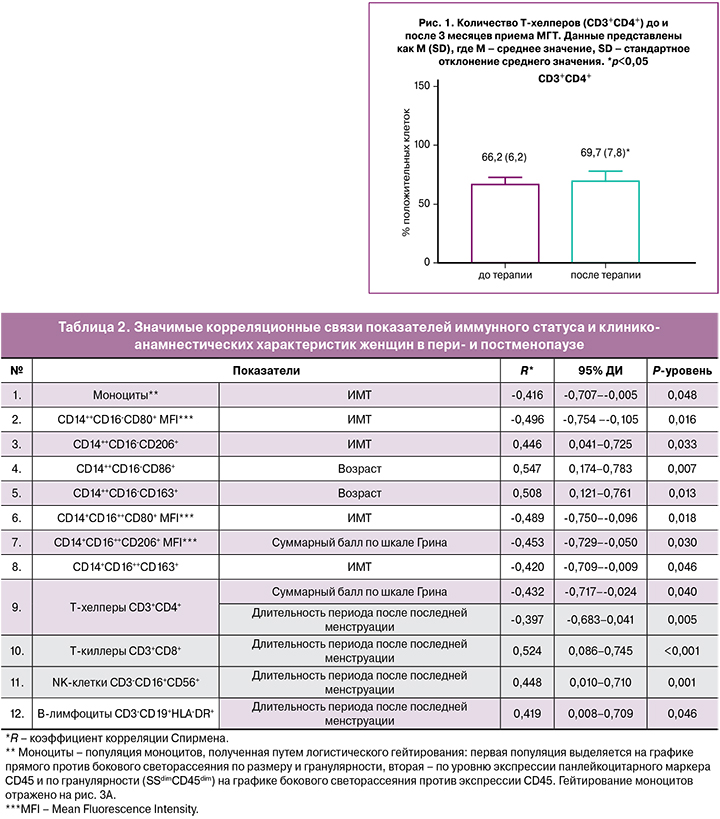
Для 23 женщин, получавших МГТ, было проведено исследование параметров иммунной системы методом проточной цитофлуориметрии: определено количество классических (CD14++CD16‑) и неклассических (CD14+CD16++) моноцитов, общая моноцитарная популяция (CD11b, CX3CR1, HLA‑DR, CD45), оценены уровни экспрессии провоспалительных (CD86, CD80, CD40) и противовоспалительных маркеров (CD163, CD206). Также было проанализировано содержание субпопуляций лимфоцитов периферической крови: T‑, В‑лимфоцитов и NK‑клеток.
Среди Т‑лимфоцитов определяли количество Т‑хелперов (CD3+CD4+) и Т‑киллеров (CD3+CD8+). Было выявлено статистически значимое увеличение количества Т‑хелперов после проведения комбинированной МГТ, содержащей трансдермальный гель эстрадиола в сочетании с микронизированным прогестероном интравагинально. Результаты представлены в таблице 3 и на рисунке 1.
Изменения количества субпопуляций моноцитов на фоне использования МГТ
Среди моноцитарной популяции, определяемой путем логистического гейтирования популяции, выделяемой на графике прямого против бокового светорассеяния по размеру и гранулярности, и популяции, оцениваемой по уровню экспрессии панлейкоцитарного маркера CD45 и по гранулярности (SSdimCD45dim) на графике бокового светорассеяния против экспрессии CD45, определяли уровни экспрессии маркеров CD11b и CD40. При этом не было показано статистически значимых различий до и после применения терапии. Среди классических (CD14++CD16-) моноцитов, постадийное гейтирование которых представлено на рисунке 3, терапия привела к статистически значимому увеличению CD14++CD16-CX3CR1+ клеток (для сравнения использовался непараметрический критерий Уилкоксона, р=0,0011), результат отражен на рисунке 2.
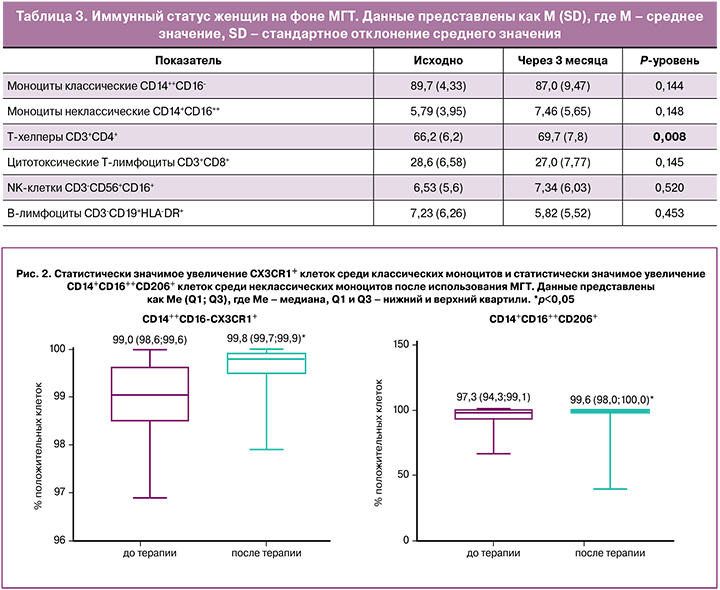
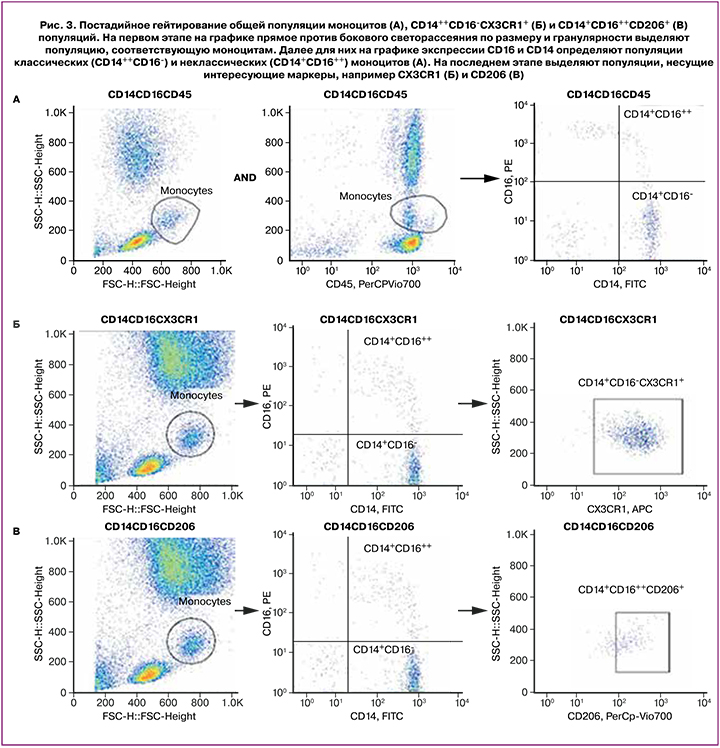
А анализ уровней экспрессии провоспалительных (CD86, CD80, CD40) и противовоспалительных маркеров (CD163, CD206) среди классических (CD14++CD16-) и неклассических (CD14+CD16++) моноцитов показал статистически значимое увеличение количества CD14++CD16++CD206+ (для сравнения использовался непараметрический критерий Уилкоксона, р=0,012). Результат представлен на рисунке 2.
Обсуждение
Снижение функции яичников у женщин с возрастом связано с развитием различных дегенеративных заболеваний, таких как остеопороз и атеросклероз, а также с изменением определенных параметров иммунной системы. МГТ широко используется для купирования или облегчения климактерического синдрома, а также для предотвращения возникновения вышеперечисленных нарушений в постменопаузе [14]. В настоящий момент активно изучается влияние МГТ на иммунную систему. До назначения пациенткам МГТ нами был проведен корреляционный анализ параметров иммунного статуса и клинико-анамнестических характеристик, выявивший значимые корреляции уровня моноцитарных субпопуляций с возрастом и ИМТ. Нужно отметить, что в литературе сложно обнаружить аналогичные работы на схожих выборках пациенток в перии постменопаузе. Большинство литературных данных указывает на положительную корреляцию ИМТ с количеством моноцитов и процентом классических моноцитов, а также на отрицательную корреляцию с уровнем неклассических моноцитов [15–17]. Данные о корреляции количества моноцитов с возрастом разнятся: Snodgrass et al. отмечали снижение их количества с возрастом [18], в то время как Pirabe A. et al. не выявили возраст-ассоциированных различий в уровне и фенотипическом составе моноцитов [19].
Известно, что эстрогены оказывают дозозависимый модулирующий эффект на всех уровнях врожденного и приобретенного иммунитета за счет специфических ядерных и неядерных клеточных рецепторов [20]. Рецептор эстрогена альфа экспрессируется на Т и В‑лимфоцитах, NK‑клетках и макрофагах; моноциты, В‑клетки и макрофаги экспрессируют бета‑рецептор эстрогена. Дефицит эстрогенов у женщин в постменопаузе может изменять как клеточный, так и гуморальный иммунные ответы [21]. У женщин с гипоэстрогенией отмечалось снижение противовирусного ответа и выработки антител [22]. Механизмы иммунных реакций на фоне дефицита эстрогенов сложны и еще не ясны. Т‑клетки играют центральную роль в иммуномодуляции. Т‑хелперы (Th1) через IL‑2, TNF‑α и интерферон‑гамма способствуют клеточному иммунному ответу для борьбы с вирусами, другими внутриклеточными микроорганизмами, злокачественными клетками и способны стимулировать реакции гиперчувствительности замедленного типа. Клетки Th2 через IL‑4, ‑5, ‑6, ‑10 и ‑13 индуцируют гуморальный иммунный ответ против внеклеточных микроорганизмов путем активизации выработки антител [23]. Таким образом, путем индукции изысканно сбалансированных иммунных реакций по типу Th1 и Th2 развивается защита от инфекционных агентов или злокачественных клеток [24]. Ряд исследователей демонстрировали прогрессирующее снижение числа наивных Т‑клеток [25, 26], а также снижение функции Т‑клеток памяти и NK‑клеток у женщин в постменопаузальном периоде [27]. В настоящей работе было выявлено статистически значимое увеличение количества Т‑хелперов через 3 месяца приема комбинированной МГТ, содержащей трансдермальный гель эстрадиола гемигидрата 0,06% – 1,5 мг ежедневно + вагинально микронизированный прогестерон в циклическом или непрерывном режиме. Это можно расценивать как положительный эффект МГТ, действующий в противовес снижению соотношения клеток CD4/ CD8+ , наблюдаемому с увеличением возраста, по сравнению с таковым у женщин в репродуктивном периоде. Исследователи продемонстрировали преимущество МГТ за счет увеличения выработки лимфоцитов и уровня макрофагального колониестимулирующего фактора в сыворотке крови [7, 27]. Xia X. et al. показали, что пероральная и трансдермальная МГТ улучшают баланс цитокинов Th1/Th2, действуя на Т‑лимфоциты преимущественно через рецепторы эстрогенов [28]. Medeiros S.F. et al. отметили увеличение соотношения CD4+/CD8+ на фоне комбинированной МГТ у женщин в постменопаузе [29]. В ряде исследований в то же время не было обнаружено влияния МГТ на лимфоциты [30–32].
Моноциты являются циркулирующими предшественниками макрофагов и дендритных клеток [33] и представляют собой популяцию клеток, играющих важную роль как при воспалении, так и при гомеостазе. В обоих случаях моноциты постоянно возникают из гемопоэтических предшественников в костном мозге и мигрируют в ткани с током крови. Моноциты подразделяются на три подмножества: классические, промежуточные и неклассические на основе их экспрессии на клеточной поверхности CD14 и CD16 у людей и Ly6C, CX3CR1 и CCR2 у мышей. В тканях моноциты далее дифференцируются в макрофаги, происходящие из моноцитов, и дендритные клетки, чтобы опосредовать врожденные и адаптивные иммунные ответы и поддерживать тканевый гомеостаз [34].
В настоящем исследовании среди общей моноцитарной популяции терапия привела к статистически значимому увеличению CD14++CD16‑CX3CR1+ клеток среди субпопуляции классических моноцитов. СX3CR1 – это рецептор фракталкина (CX3CL1), экспрессирующийся при активации воспаления на клетках эндотелия. Анализ уровней экспрессии провоспалительных (CD86, CD80, CD40) и противовоспалительных маркеров (CD163, CD206) среди классических (CD14++CD16‑) и неклассических (CD14+CD16++) моноцитов показал статистически значимое увеличение количества CD14+CD16++CD206+ среди последних. СD206 — это рецептор маннозы, важный для детекции инфекционных агентов клетками моноцит‑макрофагальной системы. Данный результат указывает на то, что МГТ потенцирует как классические, так и неклассические моноциты через 3 месяца после начала приема.
В исследовании Ben‑Hur H. установлено, что количество моноцитов увеличивается у женщин в постменопаузе и снижается на фоне терапии эстрогенами [35]. Аналогичных данных о количестве CD206+ и CD86+ клеток среди субпопуляций моноцитов после МГТ в литературе нет, поэтому мы проанализировали изменения других иммунных параметров, к примеру секреции цитокинов. В исследовании Yasui T. et al. продемонстрировано, что уровень IL‑6 имел тенденцию к увеличению в группе женщин, использующих пероральные эстрогены в составе МГТ, и оставался неизменным на протяжении всего исследования при приеме трансдермальных форм эстрогенов [36]. IL‑6 синтезируется клетками Купфера в печени [37]. Поэтому увеличение IL‑6 при пероральном приеме эстрогенов может быть связано с печеночным метаболизмом. С другой стороны, было показано, что продукция IL‑6 мононуклеарными клетками и уровень IL‑6 в сыворотке крови снижались на фоне трансдермальной терапии эстрогенами [38]. IL‑6 участвует не только в воспалении, но и в регуляции эндокринной и метаболической функции, и производится и высвобождается надпочечниками при стимуляции кортикотропином [39], а также моноцитами, Т‑лимфоцитами, эндотелиальными клетками и адипоцитами. В работе Saucedo R. et al. секреция IL‑6 была ниже в мононуклеарных клетках при монотерапии эстрогенами, но не терапии комбинацией эстрогенов с прогестероном у женщин в постменопаузе [40].
Yasui T. еt al. выявили значительные различия в концентрациях IL‑8 и воспалительного белка макрофагов (MIP‑1b) (провоспалительных цитокинов) между группами пациенток, получавших эстрогены в пероральной и трансдермальной форме в составе МГТ. Как пероральная, так и трансдермальная терапия значительно снижали концентрацию IL‑8 в сыворотке через 12 месяцев приема МГТ. На фоне трансдермальной доставки эстрогенов снижались сывороточные концентрации IL‑8, моноцитарного хемоаттрактантного белка‑1 и MIP1b, но прием пероральной терапии приводил к повышению концентрации IL‑8 [36].
Заключение
Наши результаты указывают на то, что применение МГТ, включающей трансдермальный эстрадиол в сочетании с микронизированным прогестероном интравагинально, ассоциировано с изменением иммунных параметров крови пациентов: лимфоцитов, моноцитов; причем у моноцитов разных субпопуляций меняется фенотип, что, вероятно, вносит свой вклад в иммунопотенцирующие свойства МГТ.



