Фаллопиевы трубы соединяют матку с брюшной полостью и осуществляют функцию транспортировки половых клеток, создавая благоприятную среду для оплодотворения и раннего развития эмбриона [1]. Многочисленные и сложные функции маточных труб наиболее часто нарушаются воспалительными заболеваниями, приводящими к бесплодию [2]. Реконструктивно-пластические операции на маточных трубах являются традиционными методами восстановления фертильности при трубном бесплодии [3]. В настоящее время экстракорпоральное оплодотворение (ЭКО) и перенос эмбриона (ПЭ) исключают участие этого органа в репродуктивном процессе [4]. Хронический воспалительный процесс в маточных трубах может оказать негативное влияние на эффективность вспомогательных репродуктивных технологий (ВРТ) [5]. Вероятность успешного исхода ЭКО может быть повышена хирургической окклюзией маточных труб, дренированием гидросальпинкса и сальпингэктомией [6]. Удаление маточных труб с 1999 года после публикации многоцентрового проспективного рандомизированного исследования, выполненного в Скандинавии A. Strandell и соавт. [7], вошло в рутинную практику репродуктолога. Несмотря на более высокую частоту имплантации после сальпингэктомии, многие вопросы подлежат обсуждению [8]. Тесная анатомо-функциональная взаимосвязь мезосальпинкса и кровоснабжения гонад обусловливает поиск механизмов положительного эффекта операции и ставит под сомнение необходимость шаблонного применения метода.
Цель исследования: изучить ответ яичников в программах ВРТ у пациенток с трубным бесплодием в возрасте до и после 35 лет.
Материал и методы исследования
Проведено ретроспективное сравнительное исследование 143 пациенток репродуктивного возраста, находившихся на лечении в отделении репродуктивных технологий Сибирского государственного медицинского университета в 2012–2016 гг. Критерии включения в исследование: установленный диагноз «бесплодие» в соответствии с терминологией Международного комитета по исследованию вспомогательных репродуктивных технологий (ICMART) и ВОЗ (WHO) [9], возраст оптимального состояния репродуктивного здоровья для осуществления генеративной функции – 21–45 лет [10]. Критерии исключения составили: комбинированные и сочетанные формы бесплодия, операции на матке (миомэктомия со вскрытием полости матки) и яичниках в анамнезе, гиперпролактинемия, гипоталамический синдром, соматическая патология в стадии суб- и декомпенсации, злокачественные новообразования. Конечный объем выборки составил 128 пациенток. Общий план исследования представлен в табл. 1.

Основную группу (I) составили пациентки с трубным бесплодием (N 97.1 согласно МКБ-10) и билатеральной сальпингэктомией в течение 6 месяцев до ВРТ (n=80); группу сравнения (II) – с проксимальной окклюзией обеих маточных труб к моменту ВРТ (n=48). Непроходимость маточных труб (II группа) установлена при гистеросальпингографии или во время лапароскопии при гидротубации. Указанная группа операций на маточных трубах до начала ВРТ не имела. I и II группы разделены на возрастные подгруппы в соответствии с популяционными исследованиями о прогрессивном ухудшении естественной фертильности и снижении возможности успешной имплантации в возрасте старше 35 лет [11].
Группу контроля составили условно здоровые женщины (n=15), обратившиеся на консультацию по поводу планирования беременности, и не имеющие операций на органах малого таза в анамнезе (Z31.6 согласно МКБ-10). Группа контроля использована только для сравнения показателей овариального резерва в возрасте 21–34 лет (IA и IIA).
Обследование проводилось в соответствии с приказом Минздрава России №107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» от 30.08.2012.
Индукция суперовуляции проводилась по протоколу с антагонистами гонадотропин-рилизинг гормона (антГнРГ). Для стимуляции использовались рекомбинантные гонадотропины, содержащие фоллитропин-α (± лутропин-α), или менотропины [12]. Добавление антГнРГ производилось в середине фолликулярной фазы для предотвращения преждевременного выброса ЛГ по фиксированной схеме на 6–7-й день стимуляции гонадотропинами (multiple-dose fixed), либо при размере доминантного фолликула 14–15 мм (multiple-dose flexible) [13]. Показателем завершенности стимуляции яичников считали диаметр лидирующих одного-двух фолликулов более 16–18 мм [14]. В качестве триггера овуляции использовались рекомбинантный хориогонадотропин-α или агонист ГнРГ (в целях профилактики синдрома гиперстимуляции яичников) [15]. При замене триггера для поддержки лютеиновой фазы дополнительно вводили 1500 МЕ хориогонадотропина в день трансвагинальной пункции.
Статистическая обработка данных выполнялась с использованием статистического пакета IBM SPSS Statistics v.23.0. Расчет мощности (1-β) при α=0,05 проводили с использованием программы G*Power v.3.1. Методы статистического исследования включали расчет описательных статистик, проверку формы распределения (критерий Шапиро–Уилка), оценку гомогенности дисперсий (критерий Левена). Анализ количественных данных проводили H-тестом Краскела–Уоллиса, апостериорные сравнения – U-критерием Манна–Уитни с критическим уровнем значимости (p), рассчитанным по формуле: 1–0,951/n, где n – количество сравнений. Анализ номинальных данных проводили с использованием таблиц сопряженности, χ2 Пирсона, поправки на правдоподобие (Λχ2) и точного теста R. Fisher (1922). Результаты представлены в виде MLE (оценка максимального правдоподобия) и 95% CL.
Результаты исследования
Медиана возраста всех обследуемых пациенток (n=143) составила 33,0 (29,0–36,0) года. Исследуемые группы (IA, IIA и контроля) были однородны по возрасту (H(2)=3,8; p=0,147). Исходная клиническая характеристика пациенток основной группы представлена в табл. 2.
При анализе анамнестических данных установлено, что репродуктивная функция реализована только у 15–25% пациенток вне зависимости от возраста (Λχ2=2,129, p=0,345), одинаково часто до и после 35 лет (Λχ2=3,4, p=0,066 и Λχ2=2,7, p=0,266 соответственно). Артифициальные аборты имели 37 (29%) женщин, спонтанные – 23 (18%). Согласно точному критерию Фишера общее число прерываний беременности не зависело от группы (p=0,192).
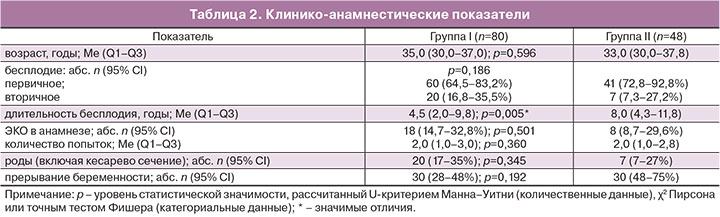
Первичное (отсутствие живорождения в анамнезе) и вторичное нарушение репродуктивной функции одинаково часто встречалось при трубно-перитонеальном бесплодии вне зависимости от проведения сальпингэктомии (р=0,186). Закономерно чаще первичное бесплодие встречалось в возрасте до 35 лет – 64/66 (97%), и только 37/62 (60%) в старшей возрастной группе (χ2=26,7, p<0,001).
Средняя продолжительность бесплодия всех пациенток с трубным бесплодием составила 7,1 (95% ДИ 6,2–7,9) года. Медиана длительности бесплодия оказывалась одинаковой в возрасте до 35 (5,0; 3,0–9,3) и после 35 лет (8,0; 3,0–13,0; U=1785, z=–1,2, p=0,212). В старшей возрастной группе (35–45 лет) продолжительность бесплодия равнозначна при сальпингэктомии и окклюзии маточных труб (U=299, z=–1,7, p=0,093). В более молодом возрасте (21–34 года) медиана продолжительности бесплодия при билатеральной окклюзии выше таковой в группе сальпингэктомии (U=354, z=–2,4, p=0,018).
Опыт использования ВРТ (ЭКО и ПЭ) имела каждая пятая пациентка – 26/128 (20%). Согласно точному тесту Фишера показатель частоты применения метода был одинаков в группах I и II (p=0,501) и внутри подгрупп IA-IIA (p=1,000), IB-IIB (p=0,149). Возраст также не влиял на наличие ЭКО в анамнезе (p=0,517). Среднее количество попыток ВРТ составило 2,1 (95% ДИ: 1,7–2,6), по медианам не различалось в группах (U=67, z=–0,3, p=0,749).
Показатели функционального овариального резерва представлены в табл. 3.
При сравнениях маркеров в возрасте до 35 лет (IA, IIA и контроль) установлено статистически значимое отличие в концентрациях ФСГ (H(2)=16,8; p<0,001), эстрадиола (H(2)=9,9; p=0,007) и ингибина В (H(2)=23,0; p<0,001). Концентрация АМГ, объем яичников и AFC оказывались не отличимыми (H(2)=0,9, p=0,628; H(2)=2,4, p=0,295; H(2)=1,1, p=0,577). Post hoc сравнениями установлено отсутствие разности концентраций ФСГ, эстрадиола и ингибина В между группами «сальпингэктомия до 35 лет» и «окклюзия до 35 лет» (U=408, z=–1,7, p=0,097; U=287, z=–1,9, p=0,057; U=99, z=–1,5, p=0,131 соответственно). Мощность тестов последовательно составила 61,9, 30,4, 71,6%. В группе пациенток с билатеральной окклюзией маточных труб (IIA) показаны более высокая концентрация ФСГ (Me=6,9 мЕд/мл) и более низкая ингибина В (Me=72 пг/мл) по сравнению с контролем (Me=3,6 мЕд/мл, U=104, z=–2,8, p=0,005; 1-β=94,9% и Me=126 пг/мл, U=47, z=–2,7, p=0,006; 1-β=6,0% соответственно). Аналогичный результат установлен у женщин с билатеральной сальпингэктомией (IA): ФСГ (Me=8,1 мЕд/мл) и ингибин В (Me=63 пг/мл) при ФСГ (Me=3,6 мЕд/мл, U=81, z=–4,0, p<0,001; 1-β=99,7%) и ингибине В (Me=126 пг/мл, U=1, z=–4,9, p<0,001; 1-β=100,0%) в контроле. Кроме того, при сальпингэктомии в возрасте до 35 лет показана более низкая концентрация эстрадиола (Me=140 пмоль/л) при (Me=226 пмоль/л) в контроле (U=89, z=–3,2, p=0,001; 1-β=53,0%).
В возрасте старше 35 лет методологически возможным оказывалось сравнение только между группами «сальпингэктомия» и «окклюзия» (возраст контроля не превышал 35 лет). После удаления маточных труб показаны относительно более высокие концентрации эстрадиола (Me=202 пмоль/л) и снижение V яичников (Me=12,1 см3) по сравнению с таковым у женщин с непроходимостью маточных труб (Me=110 пмоль/л; U=188, z=–2,4, p=0,018; 1-β=82,0% и Me=15,6 см3; U=204, z=–2,1, p=0,037; 1-β=40,0%) соответственно. Концентрации АМГ, ФСГ, ингибина В и AFC значимо не отличались (p=0,724, p=0,347, p=0,553, p=0,403 соответственно).
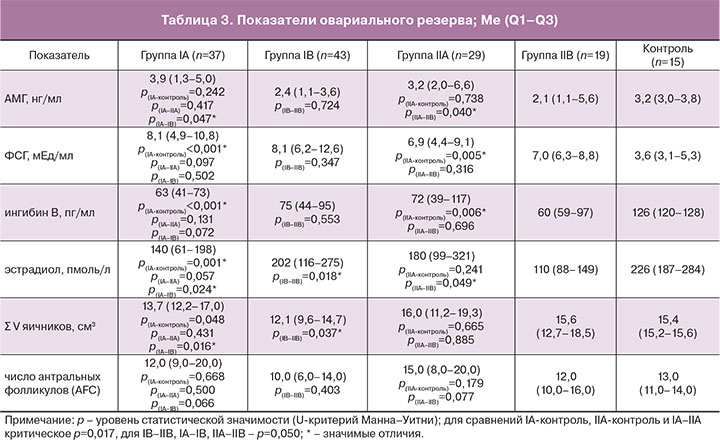
При сравнениях основных параметров овариального резерва в каждой группе в зависимости от возраста до и после 35 лет (IA-IB и IIA-IIB) установлено значимое снижение АМГ (U=416, z=–2,0, p=0,047; 1-β=86,0%) и объема яичников (U=382, z=–2,4, p=0,016; 1-β=33,6%), повышение эстрадиола (U=362, z=–2,3, p=0,024; 1-β=39,1%) после сальпингэктомии. При билатеральной окклюзии маточных труб также показано снижение АМГ (U=178, z=–2,1, p=0,040; 1-β=94,7%) и эстрадиола (U=154, z=–2,0, p=0,049; 1-β=75,9%).
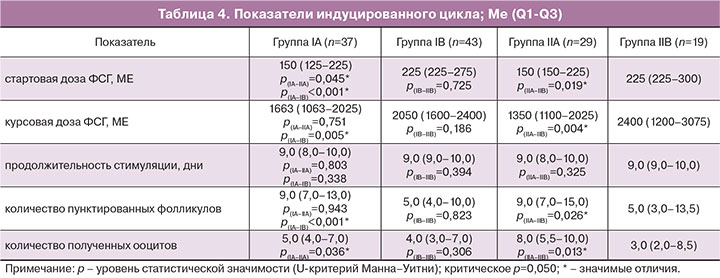
Данные показателей индуцированного цикла представлены в табл. 4. Средняя стартовая доза ФСГ всех пациенток с трубным бесплодием (n=128) составила 205 ME (95% ДИ 195-216). Медиана стартовой дозы в возрасте до 35 лет (IA+IIA: 150 МЕ) оказывалась ниже таковой после 35 лет (IB+IIB: 225 МЕ; U=1054, z=–4,9, p<0,001). Общая тенденция к увеличению дозы ФСГ сохранялась как при сальпингэктомии (IA vs IB: U=338, z=–4,6, p<0,001), так и при окклюзии маточных труб (IIA vs IIB: U=169, z=–2,4, p=0,019). Несмотря на значимый результат сравнения между группами «сальпингэктомия» (IA) и «окклюзия» (IIA) в возрасте до 35 лет (U=387, z=–2,0, p=0,045), мощность теста оказывалась низкой (1-β=50,8%); в старшей возрастной группе результат сравнения между IB и IIB оказывался незначимым (U=387, z=–0,4, p=0,725, табл. 4).
Средняя курсовая доза ФСГ всех пациенток с трубным бесплодием (n=128) составила 1873 МЕ (95% ДИ 1726-2021). Аналогично стартовой дозе медиана курсового назначения ФСГ в возрасте до 35 лет (IA+IIA: 1425 МЕ) оказывалась ниже таковой после 35 лет (IB+IIB: 2100 МЕ; U=1176, z=–4,2, p<0,001). Общая тенденция к большей дозе гонадотропинов сохранялась, как при сальпингэктомии (IA vs IB: U=502, z=–2,8, p=0,005), так и при окклюзии маточных труб (IIA vs IIB: U=138, z=–2,9, p=0,004). Однако при сравнении курсовой дозы между группами «сальпингэктомия» и «окклюзия» в возрасте до (IA vs IIA) и после 35 лет (IB vs IIB) результат сравнения оказывался незначимым (U=512, z=–0,3, p=0,751 и U=322, z=–1,3, p=0,186).
Средняя продолжительность стимуляции всех пациенток с трубным бесплодием (n=128) составила 9,1 дня (95% ДИ 8,9–9,4). Длительность назначения гонадотропинов не зависела от возраста (IA+IIA vs IB+IIB): U=1796, z=–1,2, p=0,218. Аналогичные результаты установлены при сальпингэктомии (IA vs IB: U=700, z=–1,0, p=0,338) и окклюзии маточных труб (IIA vs IIB: U=230, z=–1,0, p=0,325), а также при сравнении между указанными группами: IA vs IIA (U=517, z=–0,3, p=0,803) и IB vs IIB (U=357, z=–0,9, p=0,394).
Среднее количество пунктированных фолликулов и полученных ооцитов у всех пациенток с трубным бесплодием (n=128) составили 9,9 (95% ДИ 8,2–11,6) и 6,4 (95% ДИ 5,6–7,2). Медианы пунктированных фолликулов и полученных ооцитов в возрасте до 35 лет (IA+IIA: 9,0 и 6,0) оказывались выше таковых после 35 лет (IB+IIB: 5,0; U=1182, z=–4,1, p<0,001 и 4,0; U=1317, z=–3,5, p<0,001 соответственно). Общая тенденция к снижению количества пунктированных фолликулов и полученных ооцитов сохранялась как при сальпингэктомии (IA vs IB: U=432, z=–3,5, p<0,001 и U=580, z=–2,1, p=0,036), так и при окклюзии маточных труб (IIA vs IIB: U=170, z=–2,2, p=0,026 и U=158, z=–2,5, p=0,013). Однако при сравнении между группами «сальпингэктомия» и «окклюзия» в возрасте до (IA vs IIA) и после 35 лет (IB vs IIB) (U=531, z=–0,1, p=0,943; U=401, z=–1,8, p=0,078 и U=394, z=–0,2, p=0,823; U=342, z=–1,0, p=0,306) результат сравнения оказывался незначимым.
Обсуждение
Проведенное исследование демонстрирует особенности преморбидного фона пациенток с трубным бесплодием. Анализ структуры нарушений репродуктивной функции показывает, что преобладает первичное бесплодие (3/4–4/5 всех женщин). Генеративная функция реализована только у 20% пациенток. У каждой второй женщины в анамнезе отмечается прерывание беременности. Средняя продолжительность бесплодия составляет 7 лет (от 1 до 20 лет). При билатеральной окклюзии маточных труб пациентки более длительно не обращаются за специализированной медицинской помощью, оставляя шанс на спонтанную беременность, или длительно получают неэффективное лечение. ЭКО в анамнезе отмечается у 20% пациенток. Сальпингэктомия, наоборот, сокращает период между появлением проблемы бесплодия и ее решением методом ВРТ. Частота попыток ЭКО более двух раз свидетельствует о низкой эффективности и стойком нарушении репродуктивного здоровья.
Стимуляция суперовуляции является одним из наиболее важных шагов в рутинной практике репродуктолога, направлена на получение достаточного количества ооцитов для оплодотворения [16].
К неудовлетворительной реакции яичников в ответ на стимуляцию приводят многочисленные факторы, большее значение уделяется возрасту и параметрам функционального овариального резерва [17]. Сальпингэктомия является вариантом подготовки к ЭКО у пациенток с гидросальпинксом [18]. Однако из-за тесной связи мезосальпинкса и кровоснабжения гонад удаление маточных труб может иметь потенциально неблагоприятный ответ яичников [19]. Результаты представленных в литературе исследований разнородны, не учитывают возраст пациентов, и в связи с этим противоречивы. В некоторых сообщается, что сальпингэктомия вызывает гипоэргическую реакцию на стимуляцию [20–22], в то время как другие свидетельствуют об отсутствии изменений [23–26].
В нашей работе продолжительность стимуляции пациенток с трубным бесплодием составляет 9 дней, не зависит от возраста (p=0,218) и сальпингэктомии (p=0,566). Средние стартовые и курсовые дозы гонадотропинов в позднем репродуктивном возрасте оказываются выше таковых в возрасте 21–35 лет на 1/3 (p<0,001). После удаления маточных труб имеет место снижение стартовой дозы ФСГ (p=0,045), однако суммарная доза препаратов нивелирует данный эффект (p=0,751). Количество пунктированных фолликулов и полученных ооцитов также зависит от возраста, оказывается закономерно выше в 21–35 лет (p<0,001). Вклад сальпингэктомии несущественен (p=0,554 и p=0,255). Обзор 13 исследований, представленный F. Qin, D.F. Du, X.L. Li. (2016), демонстрирует аналогичные результаты [27]. Суммарная доза ФСГ и количество полученных ооцитов оказываются одинаковыми в группах «сальпингэктомия» и контроль. Мета-анализ 25 исследований M. Fan и L. Ma (2016) с включением 1935 пациентов, перенесших сальпингэктомию (2893 женщины группы контроля), показывает увеличение суммарной дозы гонадотропинов (p=0,03, I2=58%), продолжительности стимуляции (p=0,04, I2=45%), базальной концентрации ФСГ (p=0,01, I2=69%) и снижение количества получаемых ооцитов (p=0,001, I2=48%) при двустороннем удалении маточных труб [16]. Однако, несмотря на значимые различия, авторами отмечена очевидная неоднородность указанных параметров оценки стимуляции, а также отсутствие значимых различий в количестве полученных ооцитов при включении в анализ пациенток с унилатеральной сальпингэктомией.
Овариальный резерв является важнейшей составляющей репродуктивного потенциала женщины. Точная оценка его параметров определяет не только выбор оптимального и безопасного метода стимуляции в протоколах ЭКО, но и может прогнозировать эффективность ВРТ [17]. Данное исследование показало, что возраст является фактором ограничения овариального резерва: снижается АМГ (p=0,004), повышается частота «бедного ответа» (p=0,003) вне зависимости от сальпингэктомии, уменьшается объем яичников (p=0,016) после удаления маточных труб. В возрасте до 35 лет при сравнении с контролем установлено повышение ФСГ (p=0,038) вне зависимости от проведения сальпингэктомии, снижение ингибина В (p<0,001) и тенденция к снижению эстрадиола (p=0,001) после удаления маточных труб. H-тестом Краскела–Уоллиса показано, что концентрации АМГ, ультразвуковые маркеры (AFC, V яичников) не отличаются от контроля. В возрасте старше 35 лет после сальпингэктомии установлены относительно высокие концентрации эстрадиола (p=0,018) и снижение объема яичников (p=0,037) по сравнению с таковым у женщин без операции.
Первые публикации об отрицательном воздействии сальпингэктомии на овариальный резерв появились сравнительно недавно. В 2006 г. назад X.H. Meng и Y.M. Zhu показали, что операция не влияет на эффективность ЭКО и концентрацию гонадотропинов, однако снижает ответ яичников на стимуляцию [28]. Другие авторы установили не только меньшее количество получаемых ооцитов при пункции фолликулов, но и более высокие концентрации ФСГ [22, 29], низкие АМГ [4, 22] после лапароскопической сальпингэктомии.
Учитывая установленное в нашем исследовании ограничение овариального резерва, можно предположить, что в долгосрочной перспективе операция ухудшает реакцию яичников. N.P. Johnson и соавт. в 2010 г. представили кохрановский обзор, обсуждающий необходимость хирургического лечения гидросальпинкса до проведения ЭКО с одной стороны, возможные неблагоприятные исходы сальпингэктомии, требующие поиска альтернатив радикальной операции – с другой [30].
Заключение
Трубное бесплодие не влияет на ультразвуковые параметры овариального резерва (AFC, Σ V яичников). Из гормональных маркеров заслуживают внимание снижение ингибина В после удаления маточных труб (снижение гормона при билатеральной окклюзии имеет низкую мощность теста) и повышение ФСГ (высокая мощность обоих тестов при сравнении с контролем). После радикальной операции на маточных трубах отмечена тенденция (низкая мощность тестов) к большему повышению ФСГ и снижению ингибина В (по сравнению с пациентками без оперативного лечения), снижению эстрадиола (по сравнению с контролем и у женщин без операции). Возраст не влияет на продолжительность стимуляции, но является ведущим фактором снижения овариального резерва: значимо снижается АМГ, объем яичников (при сальпингэктомии), количество получаемых ооцитов и повышается частота «бедного ответа».
В позднем репродуктивном возрасте (35–45 лет) требуются более высокие стартовые и курсовые дозы гонадотропинов. При удалении маточных труб в более молодом возрасте (21–35 лет) отмечается тенденция к более низким стартовым дозам ФСГ. Учитывая установленное ограничение овариального резерва, можно предположить, что в долгосрочной перспективе сальпингэктомия ухудшает реакцию яичников.



